尿路上皮癌重磅研究荟萃:KEYNOTE-361、DANUBE、TROPHY-U-01
2020-09-21 医药魔方 医药魔方
尿路上皮癌是世界范围内常见的高发恶性肿瘤。对于不能手术的转移性尿路上皮癌患者,一线治疗多为含铂药物的化疗,但是随着铂敏感性的下降,会导致肿瘤复发和疾病进展,这个时候二线治疗选择就极其有限。
尿路上皮癌是世界范围内常见的高发恶性肿瘤。对于不能手术的转移性尿路上皮癌患者,一线治疗多为含铂药物的化疗,但是随着铂敏感性的下降,会导致肿瘤复发和疾病进展,这个时候二线治疗选择就极其有限。
2016年5月,PD-L1抗体药物阿替利珠单抗率先获得FDA批准,用于治疗铂类药物化疗后疾病进展或术前/术后接受铂类药物化疗12个月内疾病恶化的局部晚期或转移性尿路上皮癌患者,让尿路上皮癌的临床治疗进入了免疫治疗的时代。2019年,泛EGFR抑制剂erdafitinib以及靶向Nectin-4的抗体偶联药物Padcev(enfortumab vedotin)又分别为尿路上皮癌的二线治疗以及接受过含铂化疗和PD-L1药物的晚期患者带来了新选择。
ESMO大会上,尿路上皮癌领域有几项重磅研究结果公布,涉及Keytruda (PD-1单抗)、Imfinzi(PD-1单抗)、Sacituzumab Govitecan (TROP-ADC)等重磅药物。
1KEYNOTE-361研究:帕博利珠单抗联合化疗 vs 化疗单药一线治疗晚期尿路上皮癌
铂类药物化疗是晚期尿路上皮癌的标准一线治疗,目前,PD-(L)1疗法包括pembrolizumab都已经获得FDA批准用于二线治疗晚期尿路上皮癌(UC)。此次公布的KEYNOTE-361研究评估了pembrolizumab单药或联合铂类化疗用于一线治疗晚期UC的疗效和安全性。
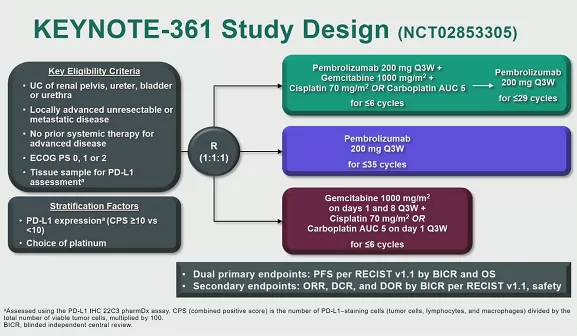
研究设计
KEYNOTE-361研究共纳入1010例患者,分别给予pembrolizumab单药、pembrolizumab+化疗(吉西他滨+顺铂或卡铂)、化疗。研究主要终点为OS和PFS,次要终点包括DOR、DCR、ORR和安全性。
(来源:ESMO 2020,下同)
研究结果
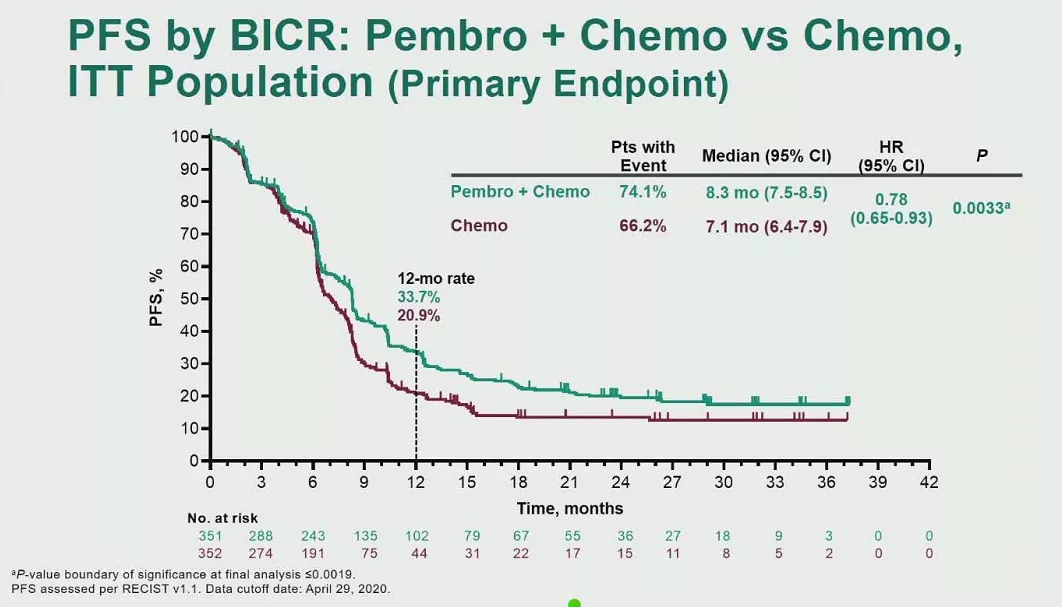
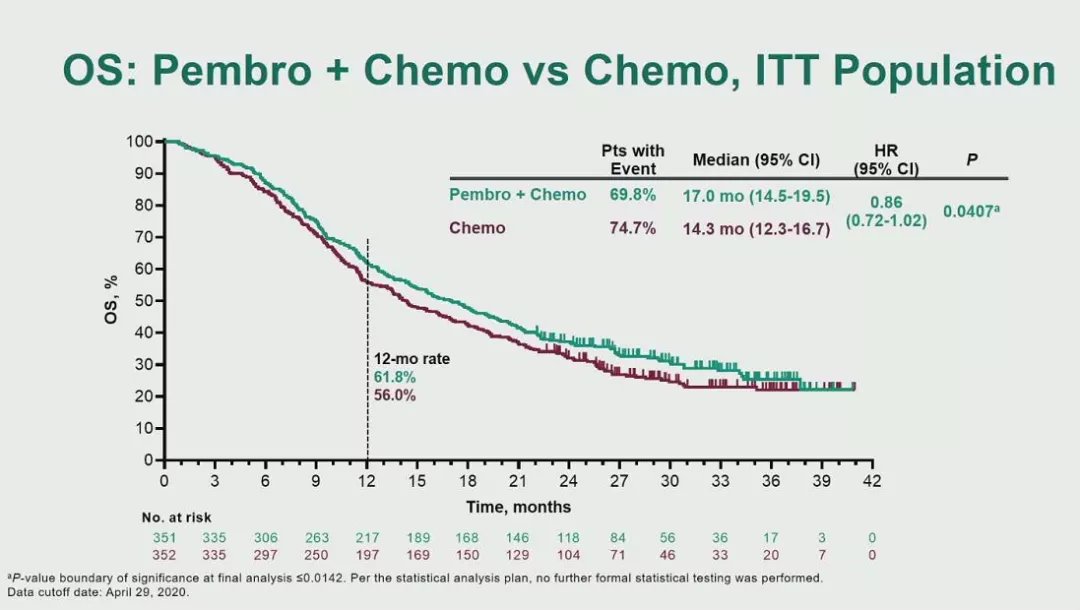
数据截止至2020年4月29日,中位随访时间为31.7个月。研究结果显示,pembrolizumab+化疗相比单独使用化疗改善了PFS(8.3 vs 7.1个月,HR 0.69,p=0.0033)和OS(17.0 vs 14.3,HR 0.86,p=0.0407),但均无统计学差异,未到达主要终点。
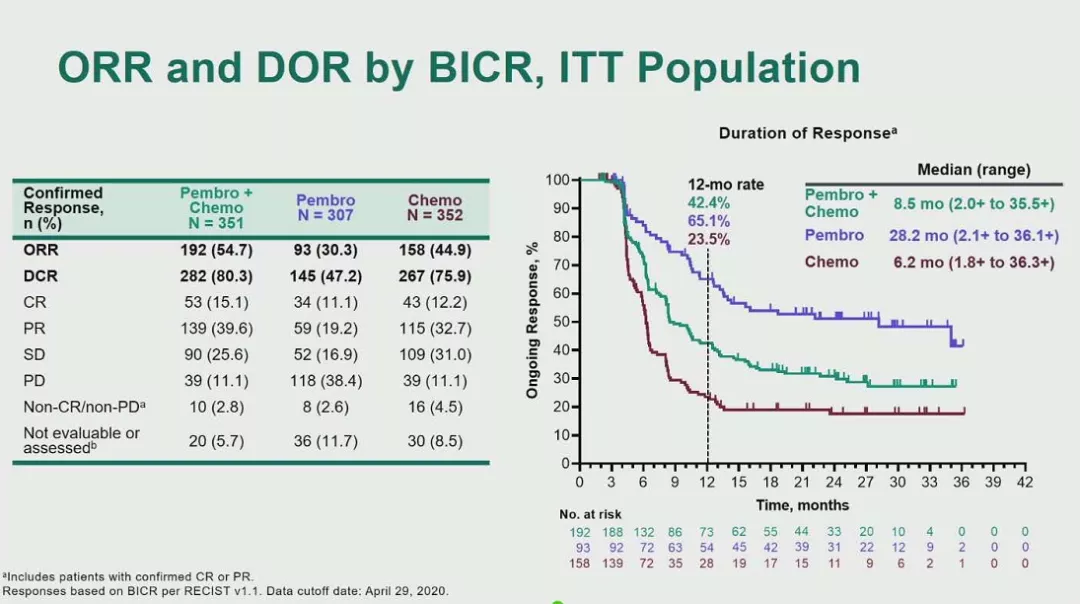
次要终点方面,pembrolizumab+化疗组、pembrolizumab单药组和化疗组的ORR分别为54.7%、30.3%和44.9%,DCR分别为80.3%、47.2%和75.9%。
研究结论
在既往接受过治疗的晚期UC患者中,pembrolizumab+化疗组较化疗组的PFS和OS均无统计学差异。安全性方面,pembrolizumab+化疗组与化疗组相当,pembrolizumab单药治疗组安全性与既往研究一致,不良反应发生率低于化疗组。
2
DANUBE研究:度伐利尤单抗联合或不联合替西木单抗与标准化疗一线治疗不可切除的局部晚期或转移性尿路上皮癌的疗效对比:一项随机、开放标签的Ⅲ期研究结果
铂类药物化疗是晚期尿路上皮癌的标准一线治疗,然而大部分患者会在约9个月内出现疾病进展。Imfinzi(度伐利尤单抗)是一种PD-L1单抗,已经获得FDA批准用于治疗铂类化疗期间或之后发生进展的局部晚期或转移性尿路癌(UC)患者。此次公布的DANUBE研究是一项III期临床试验,旨在评估度伐利尤单抗联合或不联合tremelimumab(CTLA4单抗)一线治疗不可切除、局部进展或转移性尿路上皮癌的疗效和安全性。
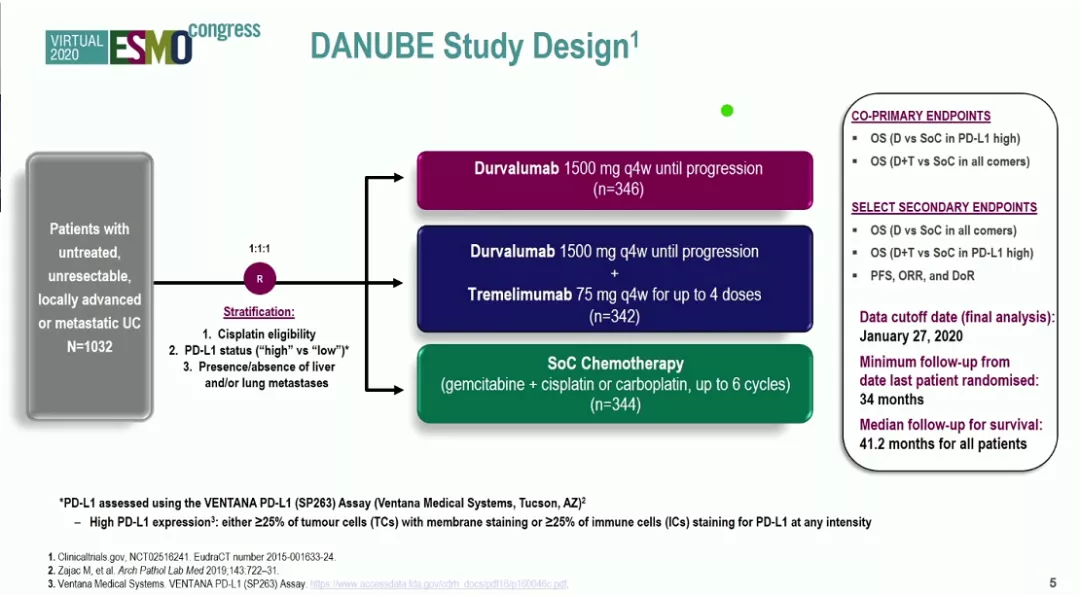
研究设计
研究共入组1032例患者,按1:1:1随机分为度伐利尤单抗治疗组、度伐利尤单抗+tremelimumab(PD-L1+CTLA4)治疗组和铂类化疗组。主要终点是比较度伐利尤单抗治疗组较铂类化疗组在PD-L1高表达患者中的中位OS差异,以及度伐利尤单抗+tremelimumab治疗组较铂类化疗组在ITT人群中的中位OS差异。
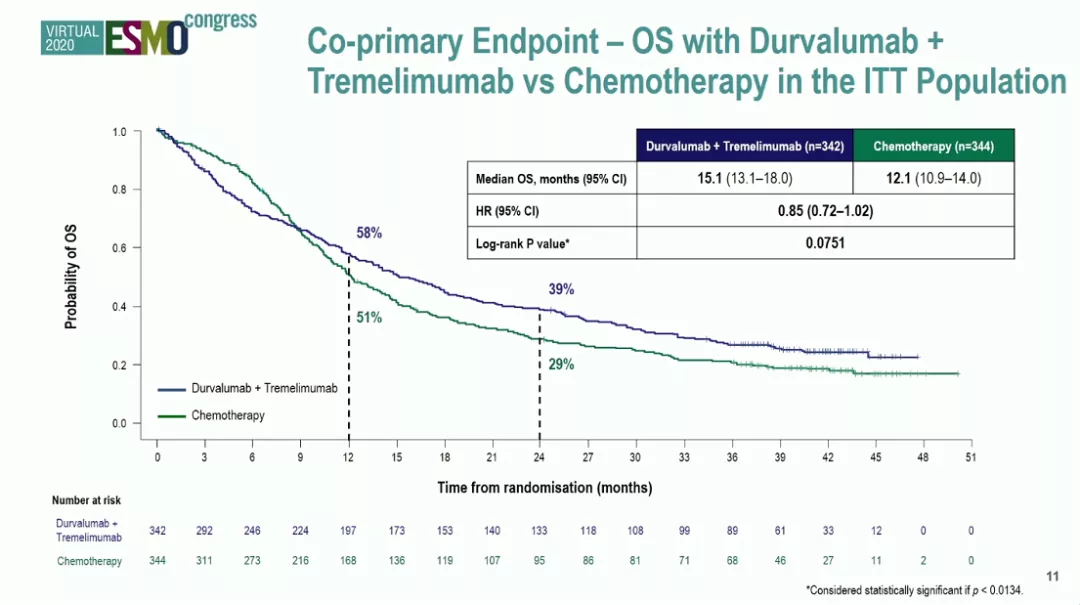
研究结果
数据截至2020年1月27日,最短随访时间为34个月。在PD-L1高表达患者中,度伐利尤单抗治疗组较铂类化疗组中位OS无显着差异(14.4 vs 12.1个月,HR 0.89,p=0.3039);度伐利尤单抗
安全性方面,度伐利尤单抗治疗组和度伐利尤单抗+tremelimumab联合治疗组最常见的3/4级治疗相关不良反应为脂肪酶升高,化疗组为中性粒细胞减少和贫血。
研究结论
DANUBE研究未到达共同的OS终点。二级分析提示,度伐利尤单抗+ tremelimumab联合治疗对于PD-L1高表达患者具有活性。在安全性方面,度伐利尤单抗治疗组和度伐利尤单抗+ tremelimumab联合治疗组较化疗组不良反应发生率较少。
3
TROPHY-U-01队列1最终结果:转移性尿路上皮癌(mUC)患者在铂类和免疫检查点抑制剂治疗进展后采用Sacituzumab Govitecan (SG)的II期研究
晚期尿路上皮癌(UC)在铂类化疗或免疫治疗进展后,治疗方案有限。sacituzumab govitecan(SG)是Immunomedics公司(已被吉利德收购)开发的一款Trop-2 ADC,该药治疗三阴性乳腺癌的适应症已经与2020年4月获得FDA加速批准,治疗UC适应症的临床试验也已经进入III期,并获得FDA授予的快速通道资格。
Immunomedics公司曾经在ESMO2019大会上公布过TROPHY-U-01队列1研究的中期分析结果,35例纳入分析的患者ORR为29%。此次公布的是该队列研究的最终分析结果。
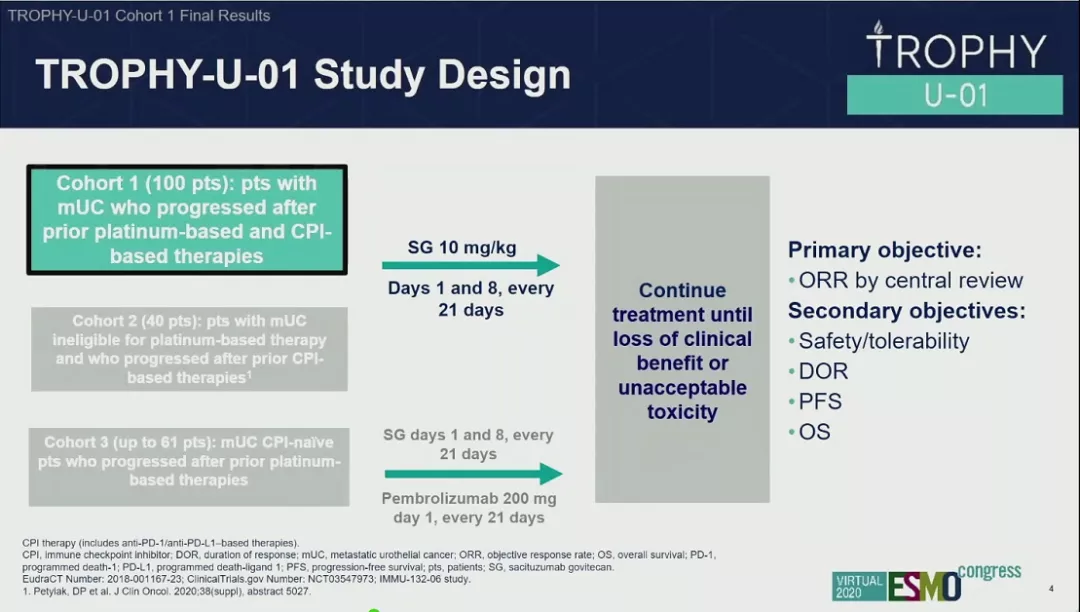
研究设计
II期TROPHY-U-01队列1研究计划入组100例既往接受含铂化疗以及免疫检查点抑制剂治疗后进展的mUC患者,这些患者分别第1天和第8天接受SG的治疗(每21天为一个周期)。主要研究中终点为ORR,次要终点为安全性/耐受性、DOR、PFS以及OS。
研究结果
数据截至2020年5月18日,基于RECIST1.1评估的113例患者ORR为27%,其中CR为5%,PR为22%;76%的患者肿瘤体积缩小;mPFS为5.4个月,mOS为10.5个月。安全性方面,6%的患者因治疗相关不良事件终止治疗,主要为中性粒细胞减少症及其并发症;30%的患者接受了粒细胞集落刺激因子(GCSF)治疗;1例患者发生与治疗相关的死亡事件,为发热性中性粒细胞减少引起的败血症。
研究结论
TROPHY-U-01队列1研究的最终结果正式了证实了中期分析结果以及先前的I/II期临床研究结果;SG对于铂类化疗和免疫疗法治疗之后进展的mUC患者依然有效并且安全。接受SG治疗的患者ORR为27%,mDOR为5.9个月,mPFS为5.4个月;而接受化疗的患者ORR为10%,PFS为2-3个月。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#荟萃#
66
#KEYNOTE#
102
#上皮癌#
80
#重磅#
80