JMC:EZH2共价抑制剂的设计、合成及在卵巢癌中的应用
2023-02-06 精准药物 精准药物 发表于上海
癌症仍然是世界范围内的一个主要公共卫生问题,其中,卵巢癌是最恶性的女性癌症之一。由于缺乏有效的筛查策略,大多数卵巢癌患者在晚期被诊断发现。
导 语
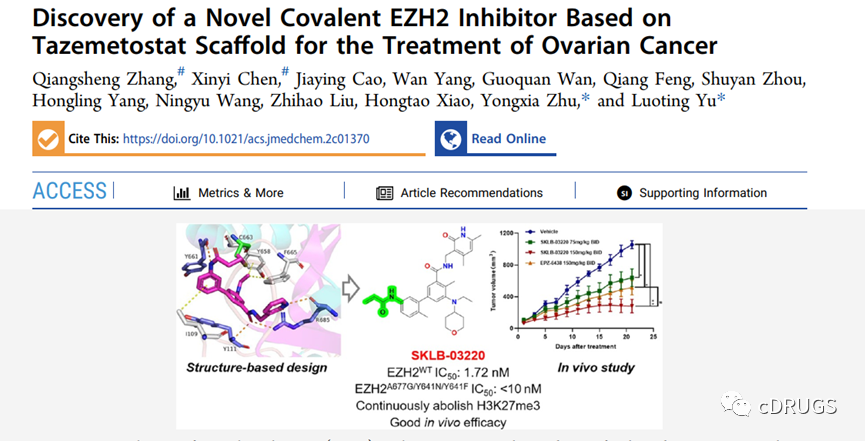
EZH2作为一种癌症驱动因素,靶向EZH2是一种有前景的癌症治疗的新策略。2023年1月24日,在《Journal of Medicinal Chemistry》发表的一篇名为《Discovery of a Novel Covalent EZH2 Inhibitor Based on Tazemetostat Scaffold for the Treatment of Ovarian Cancer》,设计并合成一系列新型的EZH2共价抑制剂。其中,SKLB-03220共价结合在EZH2的SAM口袋,并且在体外显示出优良的抗卵巢癌细胞活性,在PA-1异种移植模型中,口服的SKLB-03220显著地抑制肿瘤生长,并且没有明显的副作用。这一研究结果表明SKLB-03220是一种有效的选择性EZH2共价抑制剂,在体外和体内都具有显著的抗肿瘤活性。
前 言
癌症仍然是世界范围内的一个主要公共卫生问题,其中,卵巢癌是最恶性的女性癌症之一。由于缺乏有效的筛查策略,大多数卵巢癌患者在晚期被诊断发现。目前,晚期卵巢癌最有效的治疗方法仍然是手术后化疗,然而化疗的耐药性仍然是一个主要的临床挑战。表观遗传药物已在临床前和临床试验中显示出对不同类型癌症的治疗潜力。EZH2作为一种甲基转移酶调节PRC2,EED,SUZ12和RbAp46/48的转录活性,并且在组蛋白的翻译后修饰中起重要作用。研究表明,EZH2的异常表达和功能获得性EZH2突变与肿瘤的发生和发展以及不良预后相关。因此,靶向EZH2进行肿瘤治疗已发展为有前景的治疗策略。
EZH2作为一种肿瘤抑制基因,在卵巢癌中的过度表达已被广泛证实,并与细胞增殖和转移有关。EZH2通过多种途径驱动卵巢癌细胞的增殖、侵袭和转移,包括抑制肿瘤抑制基因的转录、调节转化生长因子β1 (TGF-β1)的表达等(图1)。
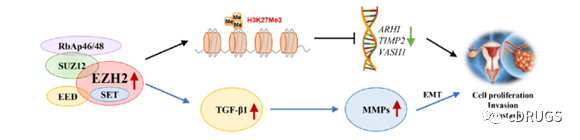
图1
EZH2抑制剂的研发被不断报道。2020年1月23日,FDA批准tazemetostat (EPZ-6438)用于治疗转移性或局部晚期上皮样肉瘤;同年6月,FDA加速批准tazemetostat治疗滤泡性淋巴瘤。此外,不少化合物也处于临床研究。然而,由于部分抑制剂的高剂量、频繁给药的局限性和获得性EZH2突变促使新型EZH2抑制剂的研发。共价抑制剂以不可逆地与蛋白质结合并发挥持续的抑制活性,使其有望减少剂量并克服耐药性。因此,开发新的和有效的共价抑制剂来治疗EZH2驱动的肿瘤是有前景的研究方向。
EZH2共价抑制剂的设计及生物学评价
基于EPZ-6438和EZH2的对接研究发现,半胱氨酸位于EPZ6438的侧链苯基附近,其可能通过修改苯基侧链(橙色部分)上的共价基团与Cys663形成共价键(图2),丙烯酰胺共价基团被选择进行后续研究。
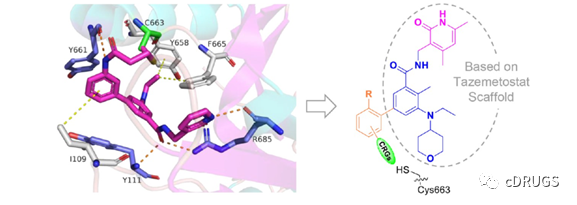
图2
作者以野生型EZH2的IC50值和ClogP值分析这类抑制剂,发现所有的目标化合物均对野生型EZH2的活性均处于纳摩尔级别,其中,化合物12a-12d的活性与阳性对照GSK126相当,且这类化合物的活性明显优于已报道的EZH2共价抑制剂GNA002和SKLB-0335(图3)。
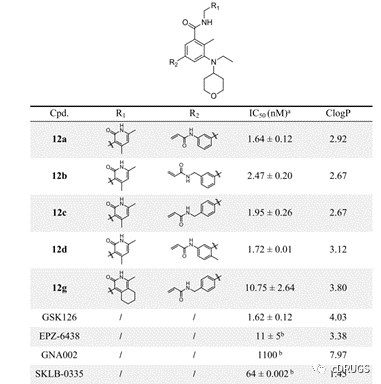
图3
12a和12d(SKLB-03220)的可逆类似物12e和12f(SKLB03224)被合成,可逆类似物对野生型EZH2的抑制活性与共价抑制剂相当。为了进一步研究这类化合物与EZH2的共价结合,作者采用解离速率常数(Koff),发现SKLB-03220以非常缓慢的速度与EZH2蛋白解离,同时解离速率不随时间变化,符合共价抑制剂的典型特征。通过分子对接研究EZH2上SKLB-03220的结合位点,,SKLB-03220结合在与EPZ-6438相同的位置,被残基Ile109、Met110、Tyr661、Cys663和Phe665包围。侧链苯的丙烯酰胺与Cys663相对接近,可以与半胱氨酸发生加成反应形成C-S键(图4C)。并且分子模拟研究表明SKLB-03220可以共价结合到EZH2的SAM口袋中。作者还进一步采用了质谱分析,结果表明化合物SKLB-03220与EZH2产生共价结合。

图4
EZH2突变,包括SET结构域中的A677G、Y641N/F/S/H/C和Y687V,已在多种癌症中检测到,并与肿瘤的发展和进展有关。因此,作者研究了SKLB03220对野生型EZH2的抑制活性影响,结果表明,在10 nM的SKLB-03220对EZH2A677G、EZH2Y641N和EZH2Y641F显示出良好的抑制活性,与EPZ-6438产生的活性相同,在1 nM的浓度下,SKLB03220仍保持对EZH2A677G的高抑制作用,并对EZH2Y641N和EZH2Y641F表现出中等抑制活性(图5)。
SKLB-03220对HMTs、EZH1和激酶的选择性进行了评估,结果表明化合物对于大多数的HMTs显示出微弱的抑制活性,对激酶也未显示出活性。基于SKLB-03220对EZH2的特异性抑制作用,可能显示出较低的毒副作用和较小的脱靶效应(图5)。

图5
目标化合物的细胞活性和分子机制研究
研究表明,EZH2可逆抑制剂(GSK126或EPZ-6438)对实体肿瘤具有中度治疗效果。而EZH2共价抑制剂可能显著抑制实体肿瘤的生长,因此,作者选择了多种实体瘤细胞,包括卵巢癌、肺癌和乳腺癌,以研究化合物的活性。其中,化合物12a和SKLB-03220表现出比GSK126和EPZ-6438更强的增殖抑制活性,并且活性优于相应的可逆类似物12e和SKLB03224。在人卵巢癌细胞系中,SKLB-03220显示出最高的增殖抑制能力,因此研究SKLB-03220在卵巢癌细胞中可能的分子机制是很有必要的。WB测量人卵巢癌细胞系(PA-1、ES-2、SKOV-3、OVCAR-3、COV362和A2780)中EZH2的蛋白表达水平,结果证明EZH2的蛋白表达水平在PA1和A2780细胞系中相对高表达,SKLB-03220处理后卵巢癌细胞中的增殖抑制作用与EZH2蛋白表达一致,选择PA-1和A2780细胞系用于抗肿瘤活性和机制的进一步研究。作者发现SKLB-03220以剂量和时间依赖的方式抑制PA-1和A2780卵巢癌细胞系的增殖,抑制活性效果远好于EPZ-6438,克隆形成实验表示出SKLB03220优于类似物SKLB-03224的抑制活性(图6)。此外,流式细胞术分析SKLB-03220以剂量依赖方式诱导卵巢癌细胞凋亡,抑制卵巢癌细胞中H3K27me3的表达,而对于EZH2的蛋白表达水平无明显影响。为了证实SKLB-03220作为共价抑制剂,可以持续抑制EZH2的功能并发挥持续的抗增殖活性,作者进行细胞清除实验和RT-qPCR实验,其结果显示,SKLB-03220作为共价抑制剂,在持续激活相关肿瘤抑制基因方面比可逆抑制剂具有明显的优势。
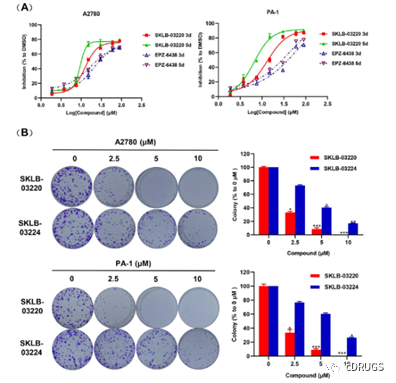
图6
SKLB-03220的药代动力学性质和体内效果评价
SKLB-03220的药代动力学模型分析,其在血液中消除速度快,在体内停留时间短。由于相对快速的消除,每日两次给药用于随后的体内疗效评估。SKLB-03220的口服生物利用度较低,当口服剂量为100 mg/kg时,为8.73%,低于EPZ-6438的口服生物利用度。而SKLB-03220在SD大鼠血浆中的蛋白结合率为99.78%,是一种高度结合的化合物。
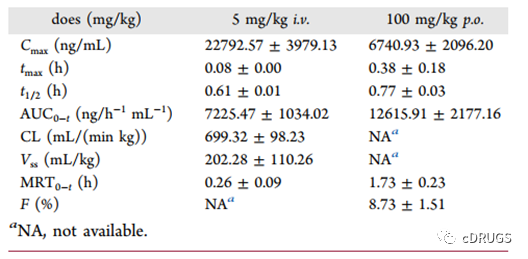
图7
为了研究SKLB-03220的体内抗肿瘤活性,在BALB/c裸鼠中建立了PA-1肿瘤异种移植模型,结果表明SKLB03220以剂量依赖性方式表现出有效的抗肿瘤活性并诱导肿瘤生长抑制(图8)。进一步分析SKLB-03220活性的潜在机制,SKLB-03220以剂量依赖的方式引起增殖细胞(Ki-67阳性)的显著减少,在体内诱导细胞凋亡,抑制PA-1肿瘤异种移植模型中H3K27me3的表达来抑制PA-1肿瘤异种移植物模型中的肿瘤生长。此外,在安全性评估中显示,PA-1模型中小鼠体重无明显差异,血液学参数和血清生化值未显示任何病理变化。同时,对器官(包括心脏、肝脏、脾脏和肾脏)的显微镜检查显示,在用SKLB-03220治疗后没有出现病理变化。综上所述,这些结果表明SKLB-03220处理后无明显毒性。

图8
结 语
作者设计、合成了一系列化合物,并对其作为EZH2共价抑制剂进行了评价。其中,SKLB-03220对EZH2的抑制活性最强,远远优于已报道的EZH2共价抑制剂GNA002和SKLB-0335。质谱、分子模拟和细胞洗脱实验的结果证实SKLB-03220可以共价结合到EZH2的SAM口袋中。SKLB-03220对EZH2突变体高度有效,并对EZH2突变驱动的癌症表现出治疗潜力。SKLB-03220在低微摩尔水平下表现出对卵巢癌细胞系的显著增殖抑制能力。SKLB-03220在体内外均可有效、持续地降低H3K27me3的表达水平,并诱导卵巢癌细胞凋亡呈剂量依赖性。此外,口服SKLB-03220显著抑制PA-1异种移植动物模型中的肿瘤生长,与EPZ-6438相比具有更好的抗肿瘤活性。然而,SKLB-03220在口服生物利用度方面表现出不利的PK特性,有待进一步优化。综上所述,SKLB-03220是一种有效的选择性EZH2共价抑制剂,在体外和体内均具有显著的抗卵巢癌能力。
参考文献: https://doi.org/10.1021/acs.jmedchem.2c01370
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言