JCO:重磅ADC对13种癌症有效,疾病控制率达90.3%!
2024-08-18 医学新视点 医学新视点 发表于上海
研究结果显示,在通过cfDNA检测出的晚期HER2扩增实体瘤患者中,给予T-DXd治疗可带来持久缓解,客观缓解率(ORR)达56.5%,疾病控制率(DCR)达90.3%,且总体安全性良好。
人类表皮生长因子受体2(HER2)是一种跨膜酪氨酸激酶受体。HER2扩增与癌细胞增殖、迁移和分裂过程有关,发生在15%-20%的乳腺癌、胃癌中,在其他实体瘤中的发生率约2%-3%,因此HER2扩增可作为多种实体瘤的潜在治疗靶点。
德曲妥珠单抗(Enhertu,T-DXd)是一款HER2靶向抗体偶联药物(ADC),已获批包括乳腺癌、胃癌在内的多个适应证,包括今年4月由美国FDA批准的不限癌种适应证,用于治疗不可切除或转移性HER2阳性(免疫组化[IHC] 3+)实体瘤成年患者。尽管一项T-DXd的1期研究纳入了乳腺癌和胃癌以外的HER2表达实体瘤患者,但其针对广泛的HER2扩增实体瘤患者的研究仍然较少。
近日,T-DXd相关临床研究取得新的突破,发表于Journal of Clinical Oncology。研究结果显示,在通过cfDNA检测出的晚期HER2扩增实体瘤患者中,给予T-DXd治疗可带来持久缓解,客观缓解率(ORR)达56.5%,疾病控制率(DCR)达90.3%,且总体安全性良好。
研究人员指出,该研究为T-DXd应用于HER2扩增实体瘤的治疗提供了有希望的循证证据。

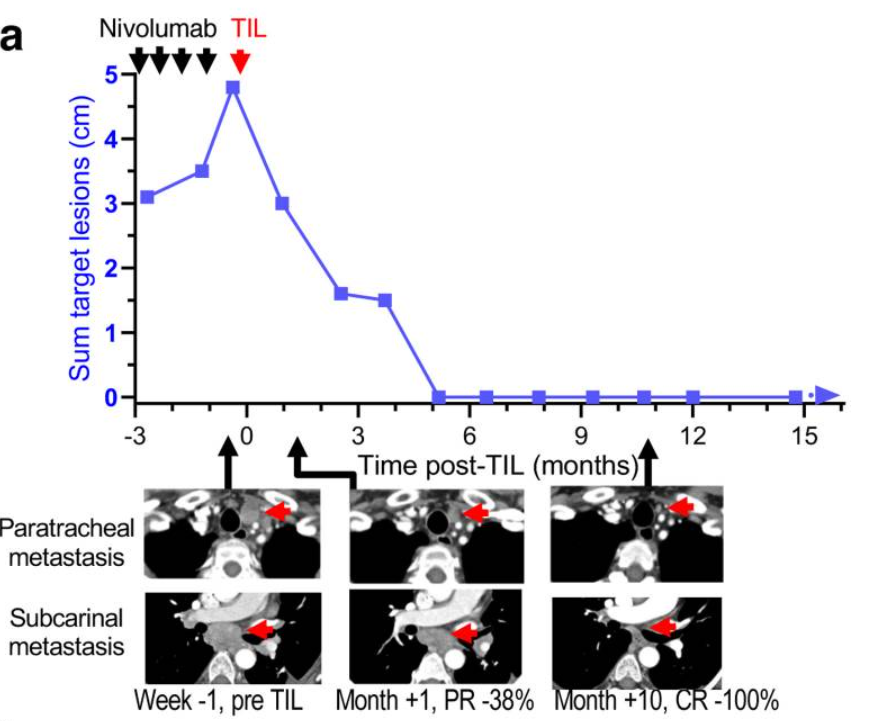
截图来源:Journal of Clinical Oncology
HERALD/EPOC1806是一项多中心、开放标签、单臂2期研究,在日本7个医疗机构开展,评估T-DXd在HER2扩增实体瘤患者中的疗效和安全性。研究招募的患者符合以下条件:年龄≧20岁;确诊为晚期或转移性实体瘤,且在研究开始前8个月内通过血浆游离DNA(cfDNA)二代测序检测出HER2扩增。
入组患者每3周接受一次T-DXd治疗(5.4 mg/kg),直至出现疾病进展或无法耐受的毒性。研究主要终点是研究者评估的ORR(阈值下限设5%,预期值为25%),定义为完全缓解(CR)和部分缓解(PR)持续≥4周的患者比例之和。次要终点包括无进展生存期(PFS)、缓解持续时间(DoR)、总生存期(OS)以及不良事件的发生率等。
在2019年12月至2022年1月期间,共有4734例患者接受了cfDNA检测,其中252例患者显示HER2扩增。研究最终纳入了62例患者,涉及16种癌症类型,包括食管癌(12例)、结直肠癌(10例)、唾液腺癌(7例)、子宫内膜癌(6例)、宫颈癌(5例)、胰腺癌(4例)、胆道癌(4例)、尿路上皮癌(2例)、卵巢癌(2例)、非小细胞肺癌(2例)、胃癌(2例)、小肠癌(2例)、乳房外佩吉特病(1例)、黑色素瘤(1例)、前列腺癌(1例),以及原发部位不明的癌症(1例)。
所有62例患者均被纳入了疗效和安全性分析。分析结果显示:
研究者评估的ORR为56.5%(95% CI, 43.3%-69.0%),显著高于5%阈值。这些患者均达到了部分缓解。此外,达到疾病稳定(SD)的患者比例为33.9%。独立审查委员会评估的ORR为58.1%(95% CI, 44.8%-70.5%),有一例患者实现了完全缓解,DCR为90.3%(95% CI, 80.1%-96.4%)。
在13种癌症类型中都观察到了患者缓解,包括KRAS突变的结直肠癌(1/3)、PIK3CA突变的子宫内膜癌(5/6)和组织学HER2阴性胃癌(1/2)。据研究团队介绍,存在KRAS和PIK3CA突变的情况下,T-DXd表现出了临床抗肿瘤活性,这与曲妥珠单抗联合帕妥珠单抗治疗的早期发现不同。存在该差异的原因可能是,T-DXd作为具有独特设计的ADC疗法,由人源化抗HER2单克隆抗体通过稳定的可裂解四肽连接子与拓扑异构酶-I抑制剂(DXd)连接组成,药物抗体比(DAR)达到理论上最高值 8:1,具备精准靶向和高效低毒的双重优势。
44例(71%)患者发生了疾病进展,研究者评估的中位PFS为7.0个月(95% CI,4.9-9.7),中位OS为14.6个月(95% CI,10.8-22.3个月),中位DoR为8.8个月(95% CI,5.8-11.2)。
研究团队进一步分析了HER2扩增具体情况与疗效的关联。在基线时,患者的血浆HER2拷贝数中位值为8.55。基于cfDNAD的生物标志物分析显示,血浆HER2拷贝数高于或低于基线中位值,对肿瘤缓解并没显著影响。然而,治疗第2周期第1天时,在47例(79%)提供样本的患者中,42例(89%)HER2拷贝数出现了下降,包括25例(60%)患者实现了HER2拷贝数的完全清除。分析发现,HER2拷贝数的动态变化与肿瘤缓解相关:cfDNA检测中HER2扩增清除的患者相比扩增持续的患者,其ORR更高(88.0% vs 22.7%)。
在安全性方面,最常见的治疗相关不良事件(trAEs)包括恶心、食欲减退、和贫血等。52%(32例)的患者出现了严重(≥3级)trAEs,主要表现为贫血和中性粒细胞减少。大多数并发症为轻度至中度,26%(16例)的患者被诊断出肺炎/间质性肺疾病,其中23%为1级病例,而2级和3级病例各有2%。
研究团队还特别探讨了HER2扩增的检测方式选择。在本研究中HER2扩增患者识别方法为cfDNA检测,而非传统的组织分析方法。既往研究提示,在通过组织学检测出HER2扩增/过表达的乳腺癌、胃癌、结直肠癌患者中,血浆cfDNA检测的灵敏度在56%~97%。尽管可能出现患者组织学HER2阳性、cfDNA检测阴性的情况(受到肿瘤脱落率低的影响),但鉴于cfDNA检测的基因分型一致性高、周转时间短,便于更快筛选适合治疗的患者。另外,相比T-DXd 1期研究中通过组织学检测筛选,此次研究中通过cfDNA筛选患者,乳腺癌、胃癌以外的实体瘤患者的ORR还更高。虽然尚不确定cfDNA检测是否适用于T-DXd以外的其他HER2靶向药的患者筛选,但值得进一步探索同时采用cfDNA基因分型和组织HER2检测来指导实体瘤的治疗。
总之,研究表明,通过cfDNA识别确定的晚期HER2扩增实体瘤患者,对T-DXd显示出较高的总缓解率,并产生了持久的缓解。此外,安全性特征与之前报告的T-DXd单药治疗一致。该研究结果也支持了HER2扩增可能是广泛癌症类型的治疗靶点的假设。
近年来,ADC疗法在肿瘤治疗领域蓬勃发展。ADC通过将单克隆抗体与强效的细胞毒性药物结合,有助于提升疗效。HER2是ADC领域的热门靶点之一。目前全球已有3款靶向HER2的ADC创新疗法获批上市,1款已在中国申报上市,此外还有10多款已进入2-3期临床试验阶段,研发进展最快的适应证以乳腺癌为主,其次为胃癌、肺癌、尿路上皮癌;这些创新ADC也普遍正在更广泛的HER2表达或HER2基因异常实体瘤中进行早期临床研究。
全球已上市、处于临床试验2期及以后且研发状态活跃的靶向HER2的ADC抗癌疗法
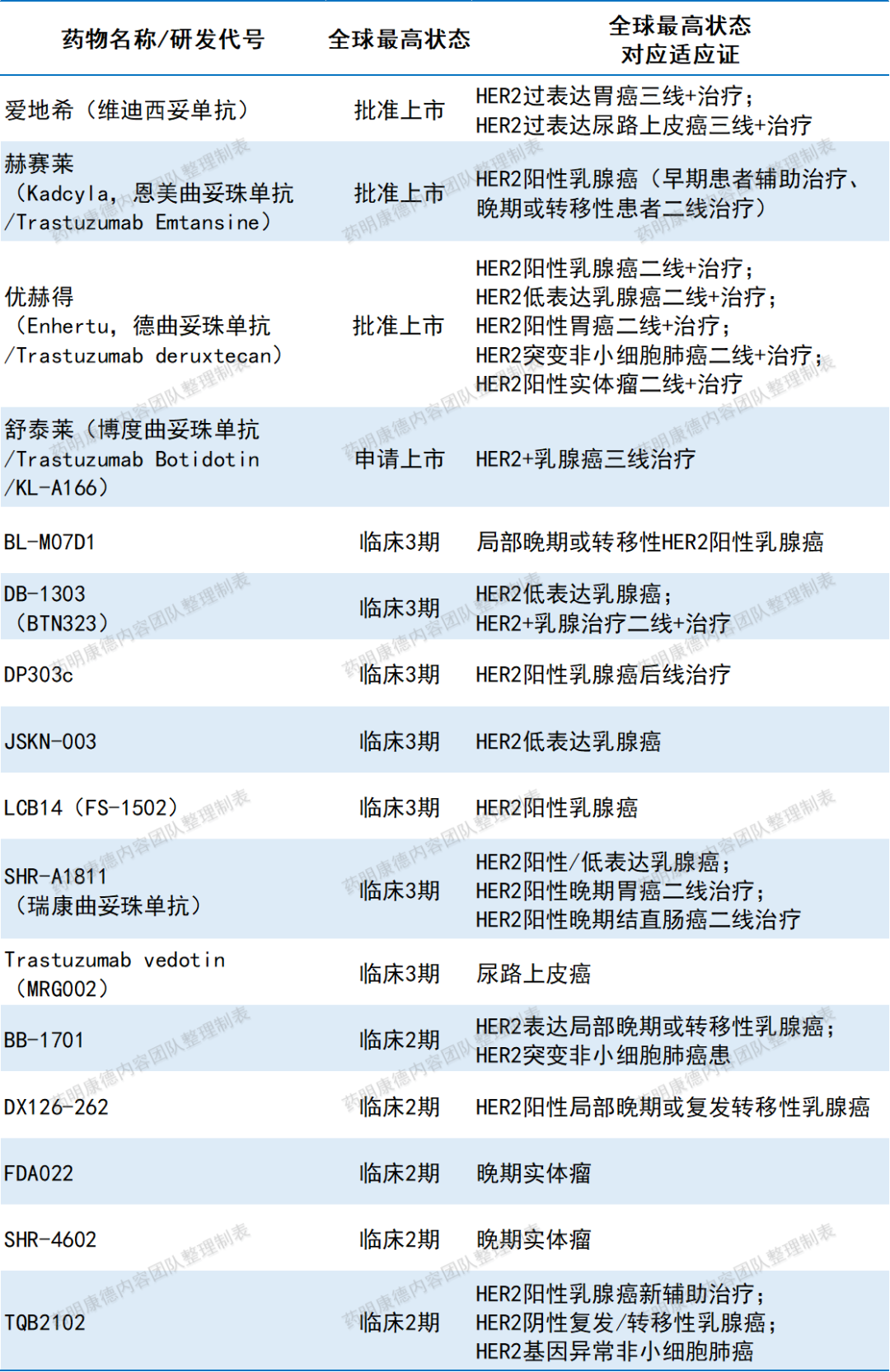
注:本表由药明康德内容团队根据公开资料梳理,为不完全统计,数据截至2024年8月9日。如有遗漏,欢迎补充。
期待这些ADC疗法的积极进展能够造福广泛HER2通路相关癌症患者。
参考资料
[1] Yagisawa M, et al., (2024). Trastuzumab Deruxtecan in Advanced Solid Tumors With Human Epidermal Growth Factor Receptor 2 Amplification Identified by Plasma Cell-Free DNA Testing: A Multicenter, Single-Arm, Phase II Basket Trial. J Clin Oncol. doi: 10.1200/JCO.23.02626.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#实体瘤# #德曲妥珠单抗#
55