4月份,FDA和NMPA批准了哪些新药?
2020-05-07 MedSci MedSci原创
2020年1-4月批准了42个NDA/BLA申请新药,包括5个生物药,12个新分子实体(Type 1),7个新剂型(Type3),5个新组合(Type4),7个新配方或新制造商(Type5),2个已上
2020年1-4月批准了42个NDA/BLA申请新药,包括5个生物药,12个新分子实体(Type 1),7个新剂型(Type3),5个新组合(Type4),7个新配方或新制造商(Type5),2个已上市但未经NDA批准的药品(Type7),4月份国际重磅药品上市不断,FDA加速批准了10款重磅新药,1个新适应症;国内重磅药品受理不断:2个PD-1药物申请新适应症、临床急需境外新药及罕见病新药均申请上市等等。
FDA药品上市动态
FDA在3-4月份批准的新药
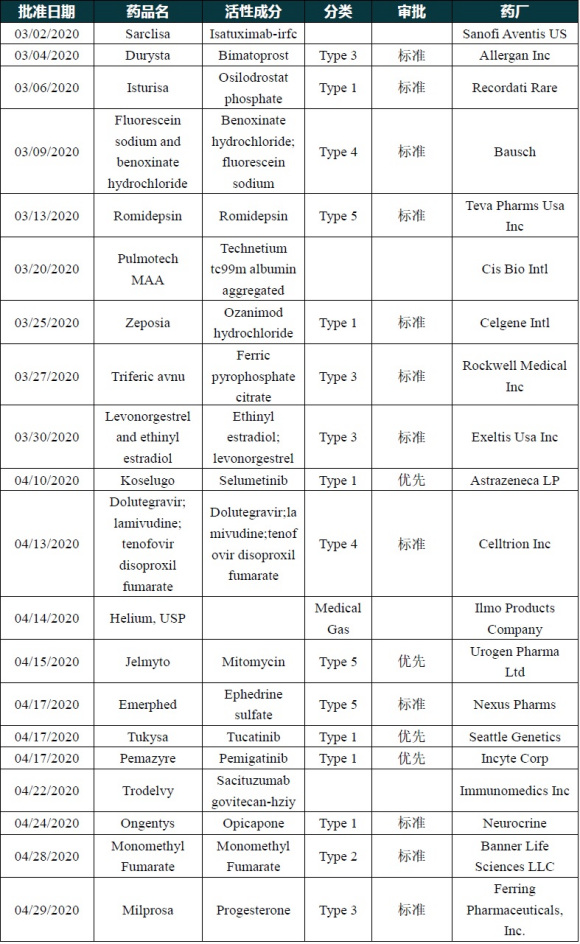
FDA批准了赛诺菲的MenQuadfi脑膜炎球菌(A、C、Y、W群)结合疫苗上市,用于预防2岁及以上人群的侵袭性脑膜炎球菌病,这是FDA批准的唯一一种适用于2至56岁及以上人群的四价脑膜炎球菌疫苗,也是美国首个且唯一一个使用破伤风类毒素作为蛋白载体的四价脑膜炎球菌疫苗。报道:FDA批准四价脑膜炎球菌疫苗MenQuadfi的生物制剂许可
FDA批准UroGen Pharma公司开发的Jelmyto(丝裂霉素凝胶)上市,治疗低级别上尿路上皮癌(UTUC)。这是第一款针对这一特定患者群获批的药物疗法,曾获FDA授予快速通道资格、孤儿药资格、优先审评资格和突破性疗法认定。报道:FDA批准UroGen的丝裂霉素凝胶Jelmyto,治疗低级别尿路上皮癌
FDA加速批准Seattle Genetics公司开发的HER2特异性抑制剂Tukysa(tucatinib)上市,与曲妥珠单抗和卡培他滨联用,用于治疗手术无法切除或转移性经治晚期HER2阳性乳腺癌成人患者。Tukysa的新药申请从获优先审评资格到获批准只花了2个月时间。
FDA加速批准Incyte公司开发的FGFR2抑制剂Pemazyre(pemigatinib)上市,治疗携带FGFR2基因融合或其它重排类型的经治晚期胆管癌成人患者。这是首款批准治疗晚期胆管癌成人患者的靶向疗法。FDA曾授予优先审评资格和突破性疗法认定。信达生物拥有这款创新疗法在大中华区的开发和商业化权益。报道:FDA批准胆管癌FGFR靶向药pemigatinib
FDA批准Immunomedics公司的Trodelvy(sacituzumab govitecan hziy)上市,用于治疗转移性三阴性乳腺癌(mTNBC)成人患者,Trodelvy是首款获得FDA批准治疗mTNBC患者的靶向TROP-2抗原的ADC药物,也是全球首款获得监管机构批准的靶向TROP-2的抗体偶联药物。据悉,目前国内布局TROP-2靶点的有四川科伦、百奥泰和杭州多禧3家企业。报道:FDA授予ADC药物sacituzumab govitecan快速通道指定,用于治疗转移性尿路上皮癌
FDA批准艾伯维和杨森联合开发的伊布替尼扩展适应症,与利妥昔单抗联用,治疗先前未接受治疗的慢性淋巴细胞白血病(CLL)/小淋巴细胞白血病(SLL)患者。目前,自2013年上市以来该药已收获了11项适应症批准,在CLL适应症上收获了6项批准。报道:NEJM:伊布替尼-利妥昔单抗治疗慢性淋巴细胞白血病
国内审评审批新受理
本周CDE新增报生产受理号31个(22个品种),除了2款PD-1(替雷利珠单抗和贝伐珠单抗)均申请肺癌新适应症外,还有1款罕见病新药和1款血小板减少症新药申请上市,基石新药首次国内申请上市等,更多动态如下:
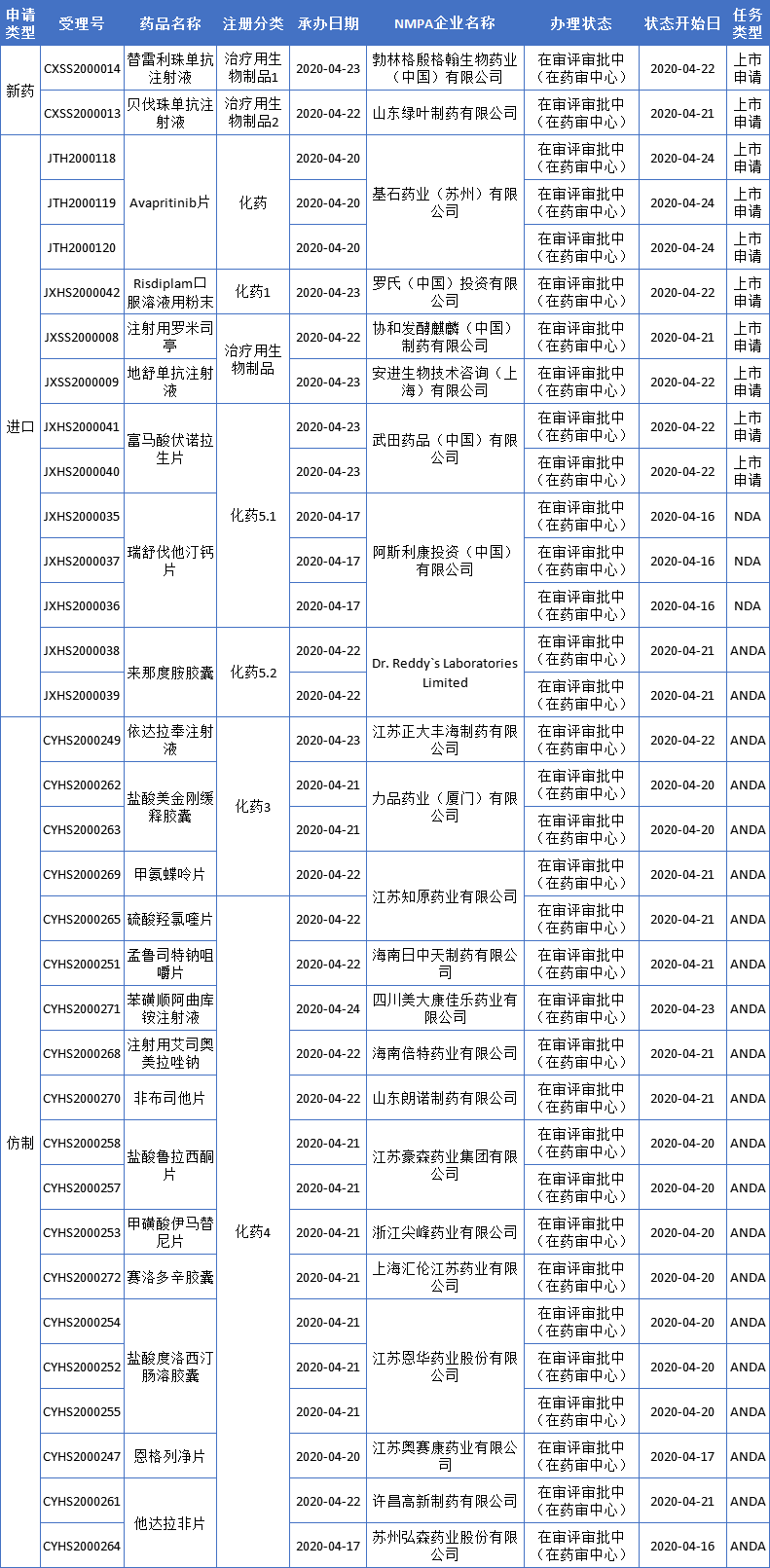
临床急需境外新药:安进「地舒单抗」
地舒单抗(denosumab)是安进公司开发的一种新型RANKL抑制剂,对可溶性、跨膜形式的人RANKL具有高度亲和力和特异性。在全球范围内,地舒单抗已获批治疗骨巨细胞瘤、恶性肿瘤引起的高钙血症、多发性骨髓瘤患者骨骼相关事件的预防等多种适应症。根据安进公司2019年报,地舒单抗去年全球销售额为19.35亿美元,同比增长8%。报道:首个骨巨细胞瘤治疗药物安加维®地舒单抗在中国获批
在中国,地舒单抗是第一批临床急需境外新药之一,并于2019年在中国加速获批,用于骨巨细胞瘤不可手术切除或者手术切除可能导致严重功能障碍的成人和骨骼发育成熟的青少年患者治疗,是首个在中国获批用于骨巨细胞瘤治疗的药物。目前,安进也在探索地舒单抗治疗其它适应症的效果。今年2月,地舒单抗在中国获批一项临床试验,针对的是一项新适应症——“用于多发性骨髓瘤患者和实体肿瘤骨转移患者中骨相关事件的预防。”
目前,安进在探索地舒单抗治疗其它适应症的效果。今年2月,地舒单抗在中国获批一项临床试验,针对的是一项新适应症——“用于多发性骨髓瘤患者和实体肿瘤骨转移患者中骨相关事件的预防。”
SMA罕见病药:罗氏「risdiplam」
Risdiplam是罗氏与SMA基金会和PTC Therapeutics共同开发的一款SMN2 RNA剪接调节剂,主要通过调节SMN2 RNA的剪接过程,增加能够产生正常SMN蛋白的mRNA的水平,从而缓解患者症状。该药可用于治疗所有类型(1型、2型、3型)脊髓性肌萎缩症(SMA)的婴幼儿、儿童、成人患者。在美国,FDA已授予risdiplam孤儿药资格和快速通道资格。
risdiplam是一种口服液体、运动神经元存活基因2(SMN2)剪接修饰剂,于2017年1月被FDA授予孤儿药资格,同年4月授予快速通道资格认定,目前FDA推迟了该药的PDUFA日期,若顺利获批,将成为首个用于治疗脊髓性肌萎缩症(SMA)患者的口服药物。报道:罗氏的risdiplam 在1型脊髓性肌萎缩症婴儿中展现出治疗潜力
2018年5月,SMA被列入我国《第一批罕见病目录》。随后,渤健的Spinraza(诺西那生)走优先审评审批程序成为我国获批的首款且唯一一款SMA治疗药物。据悉,诺西那生在北京的零售价是699700人民币/支(5ml:12mg),治疗成本大。
目前国内申报上市,随着我国近年来对罕见病的重视,risdiplam将有望被纳入优先审评程序,加速其上市进程。届时,risdiplam将打破诺西那生在我国SMA领域的唯一地位,并凭借口服优势,成为其强劲对手。
协和发酵麒麟「罗米司亭」
注射用罗米司亭(Nplate)由安进原研,于2008年8月获FDA批准用于免疫性血小板减少症(ITP)的二线治疗,2019年11月,FDA授予其治疗再生障碍性贫血的孤儿药资格,目前已在全球69个国家和地区获批上市,本次是该药首次在中国提交上市申请,协和发酵麒麟拥有该药在中国等地区的开发权。报道:FDA批准Amgen的Nplate治疗儿科免疫性血小板减少症
罗米司亭(romiplostim)是安进(Amgen)开发的一种基因重组蛋白,属血小板生成素(TPO)受体激动剂。慢性ITP通常通过抑制血小板破坏来改善血小板计数,罗米司亭可通过刺激血小板生成来改善血小板计数。日本协和发酵麒麟拥有罗米司亭在大中华区(含中国大陆、香港、澳门和台湾)、韩国、新加坡、马来西亚等地区的开发权。
目前,罗米司亭已在美国、欧盟、加拿大等全球69个国家和地区获批上市,获批的适应症包括对其他药物或手术治疗不佳的ITP成人患者, ITP持续至少6个月并且对皮质类固醇、免疫球蛋白或脾切除术应答不足的1岁及以上儿科患者等等。2019年,罗米司亭在全球范围创造了为7.95亿美元销售额,同比增长率为10.9%。
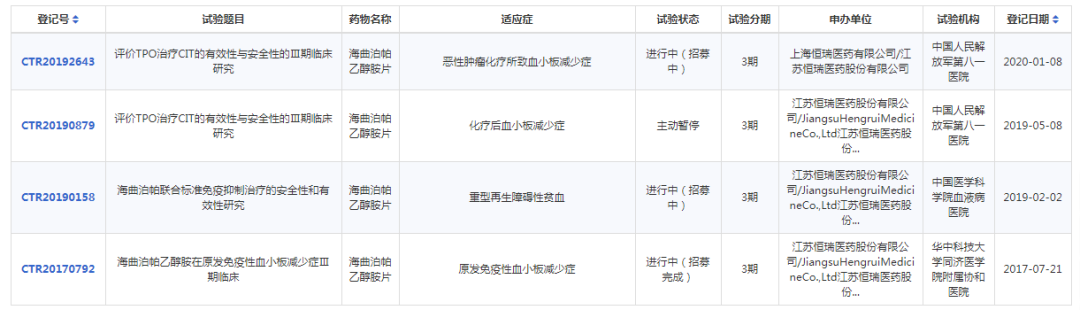
罗米司亭是一种第二代口服TPO-R激动剂,是FDA批准的首个升血小板药物。在国内市场,日前,复星医药引进的阿伐曲泊帕刚获批上市。其他同类TPO-R类药物,国内还有亿腾医药引进的芦曲泊帕和恒瑞医药的海曲泊帕,目前恒瑞医药的海曲泊帕进度最快,共有3个III期临床研究正在进行。
基石药业「avapritinib」
Avapritinib是Blueprint Medicines开发的一款强力的高特异性KIT和PDGFRA突变激酶抑制剂,基石药业拥有该药在大中华区的独家开发和商业化授权。2020年初,avapritinib刚刚获得美国FDA批准,是目前首个且唯一一个在美国上市的GIST精准靶向药物。值得注意的是,这是基石药业首个获NMPA受理的新药上市申请,标志着公司向商业化转型迈出重要一步。
NMPA已受理胃肠道间质瘤(GIST)精准靶向药物avapritinib的新药上市申请,覆盖两个适应症:
用于治疗携带血小板衍生生长因子受体α(PDGFRA)外显子18突变(包括PDGFRA D842V突变)的不可手术切除或转移性GIST成人患者;
四线不可手术切除或转移性GIST成人患者。
该药物于2020年初刚获美国FDA批准,是目前首个且唯一一个在美国上市的GIST精准靶向药物。目前在国内是首次递交新药上市申请。
安斯泰来(Astellas)吉瑞替尼提交中国上市申请
吉瑞替尼(gilteritinib)是安斯泰来与日本寿制药株式会社(Kotobuki Pharmaceutical)合作开发的下一代FLT3酪氨酸激酶抑制剂(TKI),安斯泰来拥有该药物在全球开发、制造和商用吉瑞替尼的独占权利。吉瑞替尼能够对携带FLT3-ITD基因变异和FLT3酪氨酸激酶蛋白域基因变异的FLT3产生抑制作用。这两种常见的FLT3基因变异出现在大约三分之一的急性骨髓性白血病(AML)患者中。
2018年11月,吉瑞替尼已获得美国FDA批准上市,用于治疗携带FLT3基因突变的复发/难治性急性骨髓性白血病成人患者。本次在中国,吉瑞替尼申请的适应症为——用于治疗FLT3突变阳性的复发或难治性(治疗抵抗)急性髓系白血病成人患者。
信迪利单抗新适应症——一线治疗非鳞状非小细胞肺癌提交申请
信迪利单抗是信达生物和礼来制药共同开发的一款PD-1单克隆抗体,于2018年12月首次在中国获批,治疗复发/难治性经典型霍奇金淋巴瘤,是目前唯一一个进入新版国家医保目录的PD-1抑制剂。2019年,信迪利单抗创造了10.159亿元的销售收入。
本次,信迪利单抗申请的新适应症是——一线治疗非鳞状非小细胞肺癌。据介绍,此次申请是基于一项随机、双盲、3期对照临床研究,基于独立数据委员会(IDMC)进行的期中分析,与安慰剂联合力比泰(注射用培美曲塞二钠)和铂类相比,信迪利单抗联合力比泰和铂类显著延长了无进展生存期(PFS),达到预设的优效性标准。
目前,信达生物还在开展二十多个临床研究(其中10多项是注册临床试验),以评估信迪利单抗在各类实体肿瘤和血液肿瘤上的抗肿瘤作用。
替雷利珠单抗适应症:联合两项化疗方案治疗一线晚期鳞状非小细胞肺癌(NSCLC)
替雷利珠单抗是百济神州开发的一款PD-1单克隆抗体。该药已在中国获批两项适应症:①治疗至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤患者,以及②治疗 PD-L1 高表达的含铂化疗失败包括新辅助或辅助化疗 12 个月内进展的局部晚期或转移性尿路上皮癌患者。
替雷利珠单抗本次申请的新适应症为——联合两项化疗方案治疗一线晚期鳞状非小细胞肺癌(NSCLC)患者。与此同时,百济神州还在探索替雷利珠单抗治疗其它适应症的潜力,适应症覆盖尿路上皮癌、非小细胞肺癌、鳞状非小细胞肺癌、非鳞状非小细胞肺癌、小细胞肺癌、肝细胞癌等。
参考资料:
中国国家药监局药品审评中心(CDE)网站. Retrieved April 27, 2020, from http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=3
上述内容来自于药智,新浪等网站综合而成。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言