Nature Neuroscience:段文贞团队等使用CRISPR-Cas13d靶向RNA,治疗亨廷顿舞蹈症
2022-12-16 王聪 “生物世界”公众号 发表于上海
虽然亨廷顿症病因明确,但目前尚无有效方法治疗、延缓或改善疾病的发作和发展。
亨廷顿症(Huntington's disease,HD),也叫作亨廷顿舞蹈症,全世界大概有20万人患此疾病。这是一种常染色体显性遗传性神经退行性疾病,四号染色体上的亨廷顿基因(HTT)中的 CAG 三核苷酸异常扩增产生了突变亨廷顿蛋白(mHTT),该突变蛋白在细胞内逐渐聚集在一起,形成大的分子团,在脑中积聚,影响神经细胞的功能。
一般患者在中年发病,表现为舞蹈样动作,随着病情进展逐渐丧失说话、行动、思考和吞咽的能力,病情大约会持续发展10年到20年,并最终导致患者死亡。虽然亨廷顿症病因明确,但目前尚无有效方法治疗、延缓或改善疾病的发作和发展。
我们知道,CRISPR是一类基因组编辑工具,能够在基因组的特定位置添加、删除或改变DNA。但目前最常用、最成熟的基于CRISPR-Cas9的基因编辑技术还存在着脱靶风险,这可能导致永久性或可遗传的风险。因此,许多研究开始聚焦于靶向RNA的CRISPR系统,从而不永久改变基因组。
2022年12月12日,加州大学圣地亚哥分校Gene W. Yeo团队和约翰·霍普金斯大学段文贞团队合作,在 Nature Neuroscience 期刊发表了题为:An RNA-targeting CRISPR–Cas13d system alleviates disease-related phenotypes in Huntington’s disease models 的研究论文。
该研究使用靶向RNA的CRISPR-Cas13d开发了一种新型治疗策略,用于消除导致亨廷顿症的异常扩增的毒性RNA,有效改善了亨廷顿症小鼠模型的运动协调能力,减缓大脑纹状体退化,并降低了毒性蛋白水平。这种改善持续了至少8个月,没有发现不良反应,而且对其他RNA的脱靶效应也很小。

对于亨廷顿症,患者HTT基因中的 CAG 三核苷酸异常扩增,导致产生突变亨廷顿蛋白(mHTT),这些突变蛋白倾向于在大脑纹状体中聚集形成毒性蛋白团块,纹状体对于调节运动非常重要,突变蛋白导致纹状体中功能性神经元丧失,最终导致亨廷顿症的舞蹈样症状。
在这项研究中,研究团队首先使用慢病毒载体递送的CRISPR-Cas13d疗法对体外培养的神经元进行治疗,这些神经元是由亨廷顿患者的干细胞诱导开发而来。结果显示,该疗法不仅能够靶向和破坏突变的RNA分子,还能清除有毒突变蛋白的积累,而且并未影响其他基因的表达。
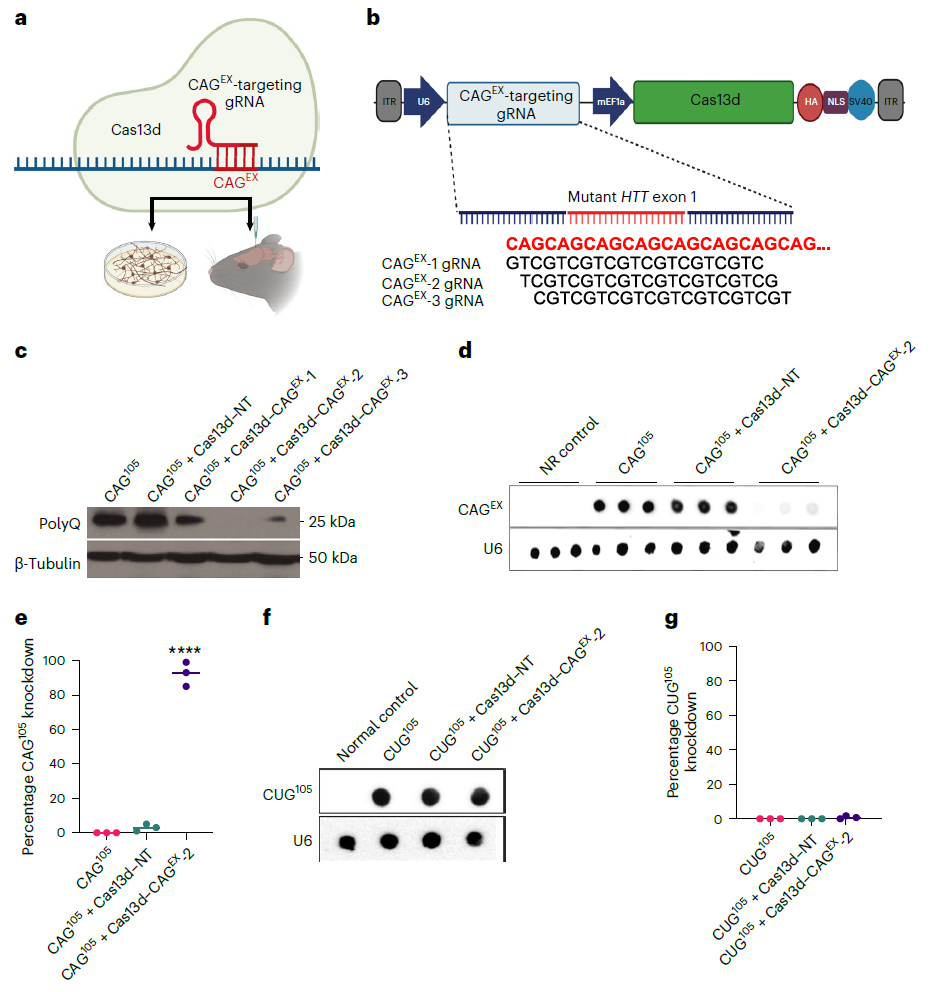
研究团队表示,该研究的目标是设计一种能够特异性靶向导致亨廷顿症的毒性RNA的治疗方法,并且保持人类其他基因组和转录组的完整。
实际上,开发有效的亨廷顿症疗法非常具有挑战性,例如,在2021年,两项有前景的亨廷顿症基因疗法因临床试验效果不佳而被停止。这两款潜在疗法都曾被寄予厚望,但实际结果却令人失望。虽然目前有一些药物可以减轻一些亨廷顿症状,但还没有任何延误或疗法可以改变疾病进程。

Gene W. Yeo(左),段文贞(右)
在这项最新研究中,段文贞团队在亨廷顿症小鼠模型上进行了进一步研究,他们发现,腺相关病毒(AAV)递送的RNA靶向的CRISPR-Cas13d疗法能够有效改善亨廷顿症小鼠模型的运动协调能力,减缓大脑纹状体退化,并降低了毒性蛋白水平。这种改善持续了至少8个月,没有发现不良反应,而且对其他RNA的脱靶效应也很小。
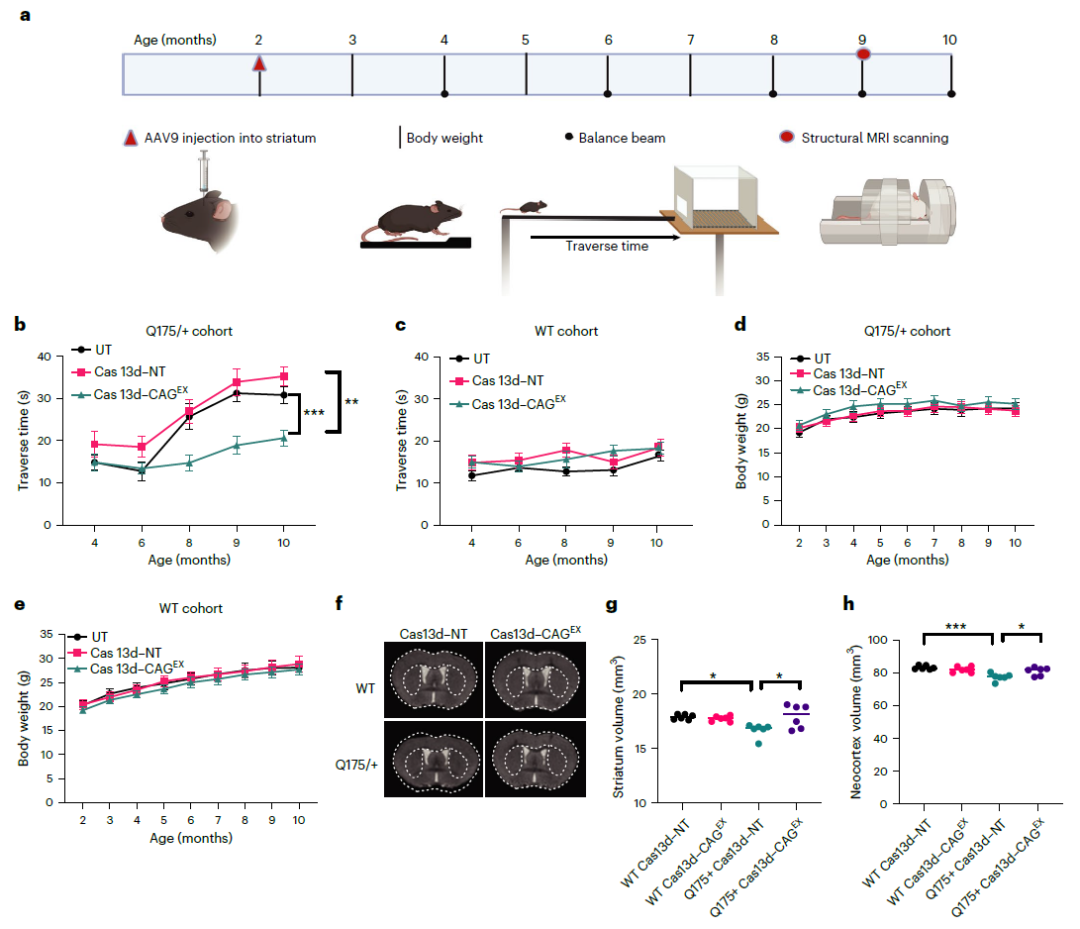
总的来说,这项研究证明了RNA靶向的CRISPR-Cas13d系统作为亨廷顿症治疗方法的技术原理,这一策略还对其他显性遗传性疾病的治疗具有意义。
原始出处:
Morelli, K.H., Wu, Q., Gosztyla, M.L. et al. An RNA-targeting CRISPR–Cas13d system alleviates disease-related phenotypes in Huntington’s disease models. Nat Neurosci (2022). https://doi.org/10.1038/s41593-022-01207-1.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言