NCB:浙江大学季业伟/密歇根大学齐岭揭示内质网中负向调节STING的机制
2023-05-09 iNature iNature 发表于上海
该研究表明SEL1L-HRD1内质网相关降解通过限制可激活STING池的大小来控制STING介导的先天免疫。
干扰素基因刺激因子(STING)对胞质双链DNA的反应,协调促炎细胞因子的产生;然而,新生STING蛋白在内质网(ER)折叠和成熟的病理生理学中的意义和分子机制尚不清楚。
2023年5月4日,浙江大学季业伟及密歇根大学齐岭共同通讯在Nature Cell Biology在线发表题为“SEL1L-HRD1 endoplasmic reticulumassociated degradation controls STING-mediated innate immunity by limiting the size of the activable STING pool”的研究论文,该研究表明SEL1L-HRD1内质网相关降解通过限制可激活STING池的大小来控制STING介导的先天免疫。该研究报道了SEL1L-HRD1蛋白复合物—ER相关降解(ERAD)最保守的分支—是STING先天免疫的负调节因子,通过泛素化和靶向新生STING蛋白进行基础状态下的蛋白酶体降解。
巨噬细胞中的SEL1L或HRD1缺乏特异性增强STING信号传导和对病毒感染和肿瘤生长的免疫力。从机制上讲,新生STING蛋白是SEL1L-HRD1在基础状态下的真正底物,与内质网应激或其传感器肌醇需求酶1α解耦。因此,该研究不仅通过限制可激活STING池的大小,确立了SEL1L-HRD1 ERAD在先天免疫中的关键作用,而且确定了靶向STING的调节机制和治疗方法。

干扰素基因刺激因子(STING)信号级联在协调针对致病性双链DNA(dsDNA)的先天免疫和自身免疫中发挥着重要作用。病原体来源的胞质dsDNA被环状GMP-AMP合酶(cGAS)识别,后者将ATP和GTP转化为环状GMP-AMP。cGAMP然后与内质网(ER)上的跨膜蛋白STING结合,触发其构象变化和激活。活化的STING离开内质网并易位到反式高尔基体网络,在那里STING募集并激活下游激酶TANK结合激酶1(TBK1)和转录因子干扰素调节因子3(IRF3),导致诱导参与先天免疫的关键炎症细胞因子基因。除了病原体衍生的dsDNA外,源自受损线粒体或不稳定基因组的胞质自身DNA也可导致STING激活和各种病理中自身免疫性疾病的发作。因此,需要严格调节STING活性以维持免疫稳态。
最近的研究表明,活化的STING在ER后区室中受到蛋白酶体或溶酶体介导的降解的负调控。两种E3泛素连接酶环指蛋白5(RNF5,也称为RMA1)和含有三重基序的蛋白30α(TRIM30α)-可能参与活化STING的降解,作为一种负反馈调节机制,减弱病毒感染后STING介导的反应。然而,STING在基础(静息)条件下是如何调节的,在很大程度上仍不清楚。最近的研究表明,STING可能在基础状态下与Ca2+传感器-基质相互作用分子1(STIM1)或Toll相互作用蛋白相互作用,从而阻止其活化或降解。有趣的是,STING的溶酶体降解需要肌醇需要酶1α(IRE1α)的活性,这是内质网应激或未折叠蛋白反应(UPR)的内质网固有传感器,尽管其机制尚不清楚。
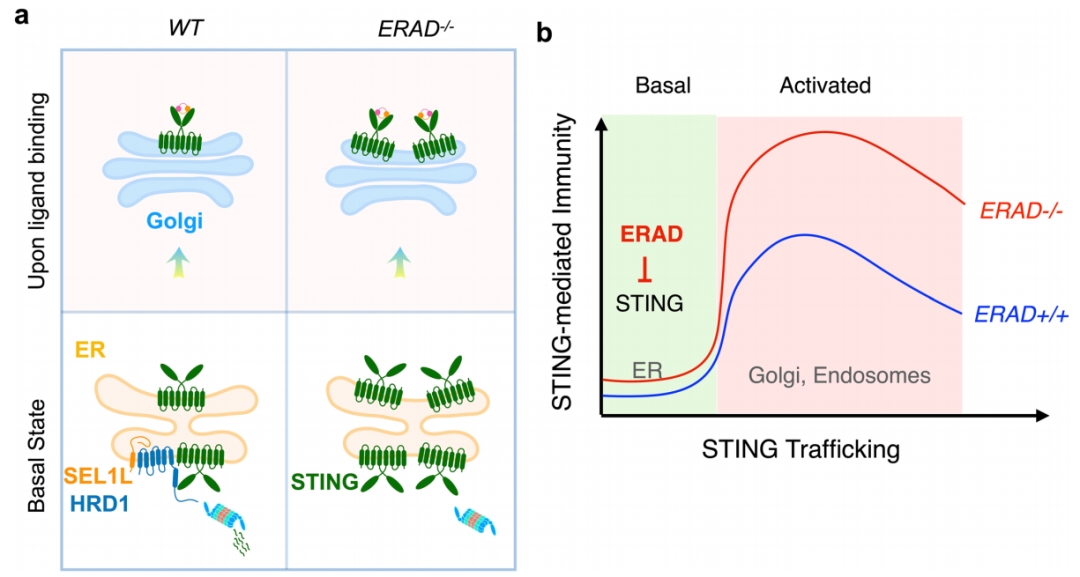
SEL1L-HRD1 ERAD在ER调节STING介导的免疫的可能模型(图源自Nature Cell Biology)
观察到cGAMP结合触发ER上STING的构象变化是其ER存在的先决条件,这表明ER保留在STING激活中的重要性。然而,在ER发生的分子事件在很大程度上仍未被探索。ER中错误折叠蛋白的蛋白酶体降解需要ER相关降解(ERAD)。lin-12样抑制剂(SEL1L)-HMG-CoA还原酶降解1(HRD1)复合物是从酵母到人类的ERAD最保守的分支。此外,在成熟B细胞中,最近的一项研究表明,活化的STING与SEL1L-HRD1 ERAD结合,降解B细胞受体;然而,SEL1L-HRD1 ERAD在STING生物学中的作用尚未被探索。
该研究报道了新生STING与ER中的SEL1L-HRD1 ERAD相互作用并被其泛素化,这一事件先于配体结合并调节STING信号传导潜力。髓系细胞中的SEL1L-HRD1 ERAD-STING轴在胰腺癌症移植模型中对DNA病毒的先天免疫和肿瘤发生起着重要作用。相反,该研究数据表明,SEL1L-HRD1 ERAD在TLR4信号传导中不起作用,ER应激、IRE1α和自噬对STING信号传导都是可有可无的。
本研究由密歇根大学齐岭教授、浙江大学附一院季业伟特聘研究员构思和指导。感谢浙大一院梁廷波教授对本研究的支持。大多数实验由季业伟及浙大一院特聘副研究员罗媛完成。浙大一院课题组研究助理吴雅婷、孙瑶,博士后赵连丰及其他成员,以及齐岭团队已毕业博士薛祯及其他成员也为该研究做出了贡献。
原文链接:
https://www.nature.com/articles/s41556-023-01138-4
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










很有意义
80