Cell Res:终于搞清楚了!中山大学康铁邦等团队发现激活的STING在细胞间转移以促进抗肿瘤免疫的潜在机理
2022-10-25 iNature iNature
该研究发现,Rafeesome调节激活STING的细胞间转移,激活的含有STING的ER诱导受体细胞的抗肿瘤免疫。
STING是一种内质网(ER)跨膜蛋白,在cGAMP刺激下介导先天免疫激活,并通过自噬降解。
2022年10月24日,中山大学康铁邦及Wei Denghui共同通讯在Cell Research 在线发表题为“Intercellular transfer of activated STING triggered by RAB22A-mediated non-canonical autophagy promotes antitumor immunity”的研究论文,该研究报道了激活的STING可以在细胞间转移以促进抗肿瘤免疫,这一过程是由RAB22A介导的非典型自噬触发的。机制上,RAB22A与PI4K2A结合产生PI4P, PI4P募集Atg12-Atg5-Atg16L1复合体,诱导ER衍生的RAB22A介导的非典型自噬体形成,其中封装有激动剂或放化疗激活的STING。这个RAB22A诱导的自噬体与RAB22A阳性的早期核内体融合,产生一个新的细胞器,研究人员称之为Rafesome (RAB22A介导的非规范自噬体与早期核内体融合)。

同时,RAB22A使RAB7失活,抑制Rafesome与溶酶体的融合,从而使具有活化STING的自噬体内囊泡分泌成为一种新的细胞外囊泡,该研究将其定义为R-EV (RAB22A诱导的细胞外囊泡)。激活的含有STING的R-EV诱导IFNβ从受体细胞释放到肿瘤微环境,促进抗肿瘤免疫。RAB22A可以增强STING激动剂diABZI在小鼠体内的抗肿瘤作用,RAB22A水平高预示着鼻咽癌放化疗患者的良好生存率。总之,该研究结果揭示了Rafeesome调节激活的STING的细胞间转移以触发和传播抗肿瘤免疫(来源于ER的非典型自噬体内囊泡分泌为R-EV),为理解细胞器膜蛋白的细胞间通信提供了新的视角。
cGAS-STING信号通路在先天免疫中起着重要作用。STING是一种内质网(ER)跨膜蛋白,由cGAS产生的天然配体cGAMP激活,cGAMP招募TANK-Binding kinase 1 (TBK1),通过磷酸化激活干扰素调节因子3 (IRF3)。该途径诱导各种细胞因子的产生,包括I型干扰素(IFNs)。STING通路最近成为癌症免疫的关键调控因子,并被作为潜在的治疗靶点进行探索。STING激动剂或cGAMP在体内具有很强的抗肿瘤作用,但临床前和临床资料显示,STING激动剂在全身给药中的作用有限。
事实上,肿瘤细胞产生的cGAMP可以在肿瘤微环境中转移到NK细胞,激活这些NK细胞中的STING来执行抗肿瘤免疫。然而,cGAMP是高度不稳定的,因为它可以被外核苷酸焦磷酸酶/磷酸二酯酶水解,导致治疗活性不佳。因此,如何更好地利用STING途径作为治疗靶点仍然是一个挑战。
据报道,激活的STING可以传递下游信号,并通过自噬降解。通常认为ER驻留蛋白没有信号肽是非分泌蛋白,它们经常被用作外泌体的排斥标记物。因此,STING能否被转运到细胞外囊泡(EVs)是一个令人困惑的问题。
EV存在于生物液体中,并在细胞间通讯中发挥作用,使细胞能够交换蛋白质、脂类、遗传物质、氨基酸和代谢物。EVs是一种异质的细胞源性膜结构,主要由外泌体和微泡(MVs)组成,分别来源于内体系统和从质膜脱落。因此,有充分的文献证明外泌体和MV含有许多细胞膜蛋白。外泌体在核内体成熟为多泡核内体(MVEs)的过程中,在其腔内形成腔内囊泡(ILVs),并由多泡核内体与质膜融合分泌。由MVEs向内出芽形成的ILVs主要由Syntenin-Alix-ESCRT-III或RAB31-FLOTs机制介导。
典型自噬是一种高度保守的细胞组分自消化过程,对细胞内稳态和适应应激必不可少,通过选择性或非选择性降解底物,包括蛋白质聚集物、受损的线粒体、内质网、脂滴和细胞内病原体,在各种生理和病理过程中发挥着重要作用。经典自噬体形成的保守机制包含两个主要的起始复合体:ULK1复合体和产生PI3P的III类PI3 -激酶复合体I;PI3P的产生是典型自噬启动的一个重要的早期事件。
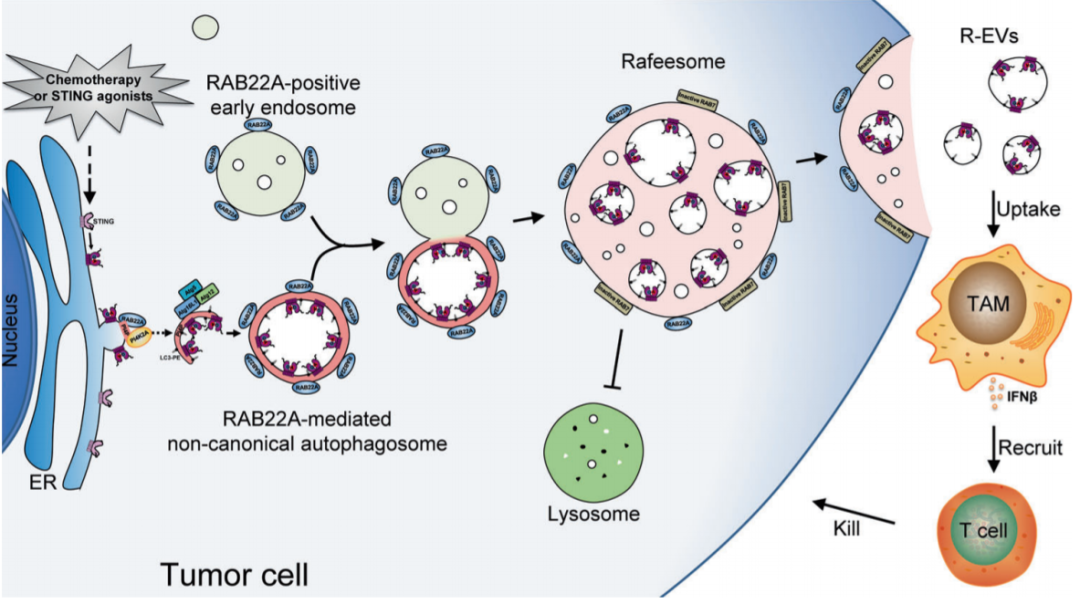
文章模式图(图源自Cell Research )
然而,越来越多的证据支持非规范自噬的存在,其特征是自噬机制的共享使用和不同的组件在多个不同的场景中起作用。在过去的十年中,非规范自噬功能的报道在技术上并不涉及“自食”。其中一种非典型自噬过程被命名为分泌性自噬,它促进胞质物质如Acb1、IL-1β和溶菌酶的非常规分泌。
在这篇报道中,发现了一种新的细胞器Rafesome (RAB22A介导的非典型自噬体与早期核内体融合),并发现激活的STING被包装到这种自噬体中,并在一种新型的EV中作为货物分泌,R-EV (RAB22A诱导的细胞外囊泡)。总之,该研究发现,Rafeesome调节激活STING的细胞间转移,激活的含有STING的ER诱导受体细胞的抗肿瘤免疫。
参考消息:
https://www.nature.com/articles/s41422-022-00731-w
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言