读书报告 | MODUL研究:生物标志物驱动的转移性结直肠癌的维持治疗
2023-11-04 iCombo iCombo 发表于上海
MODUL研究是针对转移性结直肠癌(mCRC)患者一线诱导治疗后生物标志物驱动的维持治疗的适应性信号搜索试验。
导读
目的:MODUL研究是针对转移性结直肠癌(mCRC)患者一线诱导治疗后生物标志物驱动的维持治疗的适应性信号搜索试验。我们报告了第1组(BRAFmut)、第3组(人表皮生长因子2 [HER2]+)和第4组(HER2-/高微卫星不稳定性、HER2-/微卫星稳定[MSS]/BRAFwt或HER2-/MSS/BRA mut /RASmut)。
方法:既往未经治疗的不可切除 mCRC 患者在接受标准诱导治疗(5-FU/LV]+奥沙利铂+贝伐珠单抗)后疾病未出现进展,被随机分配接受对照组(5-FU+贝伐珠单抗)或特定队列的实验性维持治疗(队列 1:维莫非尼+西妥昔单抗+ 5-FU/LV;队列 3:卡培他滨+曲妥珠单抗+帕妥珠单抗;队列 4:考比替尼+阿替利珠单抗)。主要疗效终点是无进展生存期(PFS)。
结果:由于研究提前结束,队列 1、3 和 4 未达到目标样本量。在队列 1(n=60)中,不同治疗组的 PFS 没有差异。然而,队列 1 的探索性生物标志物数据显示,实验组优先选择了丝裂原活化蛋白激酶(MAPK)通路突变(主要是 KRAS、NRAS、MAP2K1 或 BRAF),而对照组则没有。在队列 3(n=5)中,实验组和对照组的 PFS 分别为 3.6 至 14.7 个月和 4.0 至 5.4 个月。在队列 4(n=99)中,实验组的 PFS 更短。
结论:维莫非尼+西妥昔单抗+5-FU/LV作为BRAFmut mCRC的一线维持治疗值得进一步研究。MAPK通路出现的基因组改变可能会为BRAFmut mCRC提供新的治疗机会。在HER2-/MSS/BRAFwt mCRC中Cobimetinib联合atezolizumab的获益风险比并不理想。需要新的策略来提高MSS mCRC对免疫疗法的敏感性(Eur J Cancer. 2023 May;184:137-150. doi: 10.1016/j.ejca.2023.01.023)。
背景
约8%-9%的结直肠癌存在BRAF突变(BRAFmut),最常为V600E,它可使MAPK信号通路激活。
BRAFmut为转移性结直肠癌(mCRC)的不良预后标志,对标准化疗(基于奥沙利铂或伊立替康的化疗加或不加贝伐单抗)效果不佳,同时单药BRAF抑制剂的疗效也有限。临床前研究表明,这可能是EGFR快速重新激活MAPK通路所致,提示需要进行联合治疗。
目前的研究明确了BRAF V600E的mCRC治疗模式,一线为化疗联合抗血管生成药,进展后更换为BRAF抑制剂+EGFR抑制剂±化疗。
MODUL是一项基于生物标记物做分类的临床试验,在标准的一线诱导治疗后,为mCRC患者选择新的维持治疗方案。
方法

Cohort 1(BRAFmut); Cohort 2 (BRAFwt); Cohort 3 (HER2+);Cohort 4 (HER2‒/MSI-H,HER2‒/MSS/BRAFwt or HER2‒/MSS/BRAFmut/RASmut).
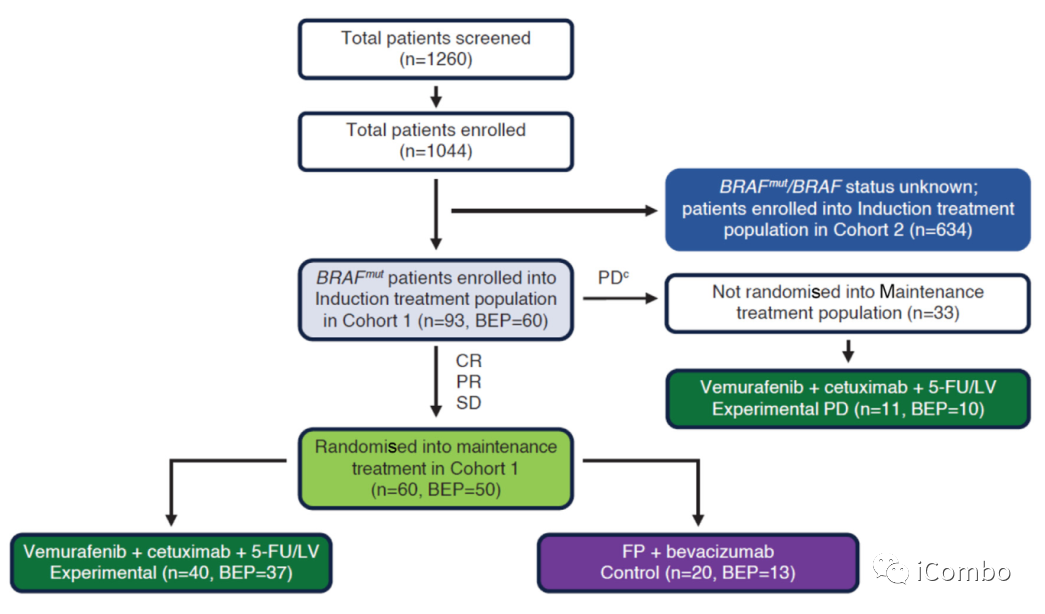
-
研究人群包括18岁或以上的组织学确诊、可测量、不能切除的mCRC患者,既往未接受化疗,ECOG≤2。
-
主要终点:PFS;次要终点:OS, ORR, DCR。
-
维持治疗阶段的定义是从第一次维持治疗开始至维持治疗最后一天起30天。
Cohort1基线
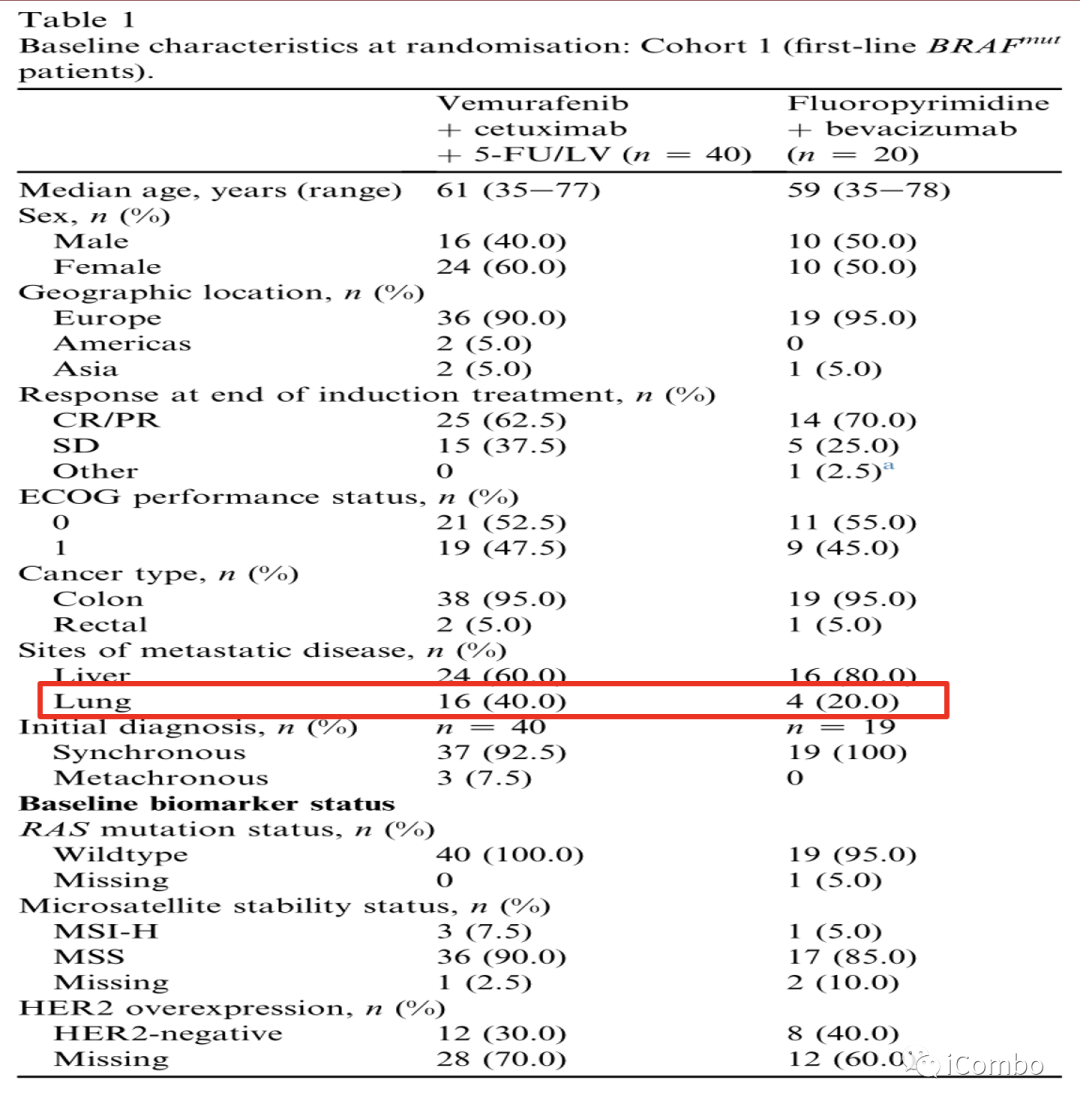
除了试验组的肺转移率较高(40.0%比20.0%)外,试验组和对照组之间在地理位置、年龄、性别、癌症类型、初始诊断、ECOG表现状态或诱导治疗结束时的反应等亚组没有统计学差异。
Cohort1疗效:PFS未改善
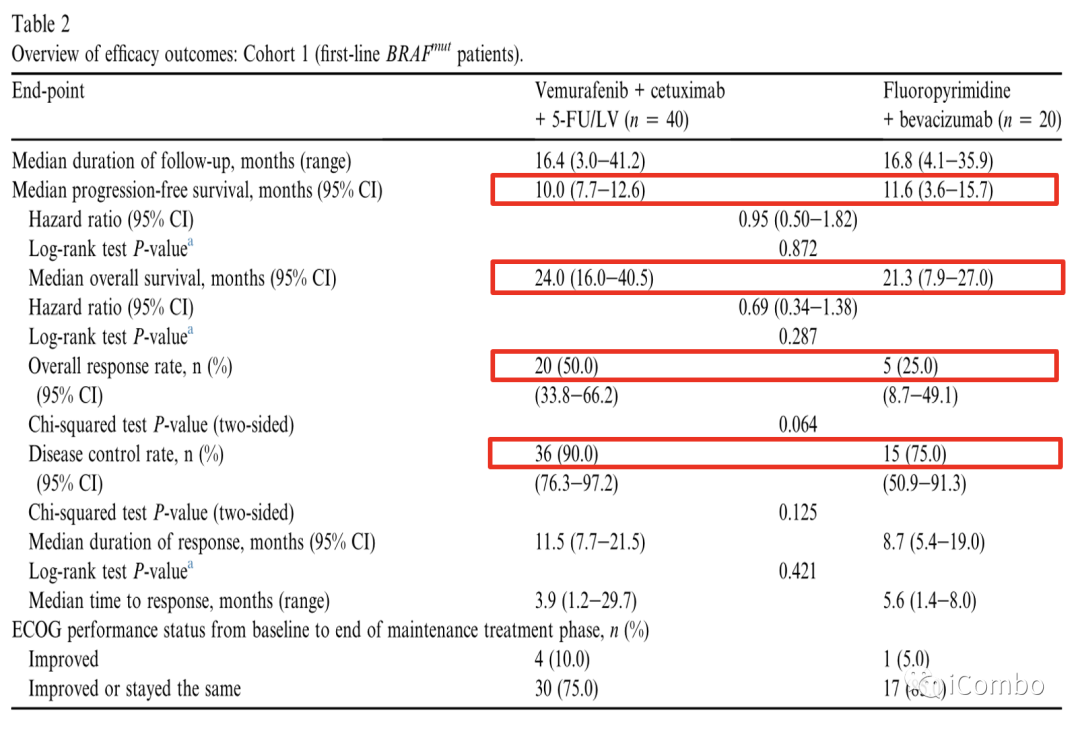
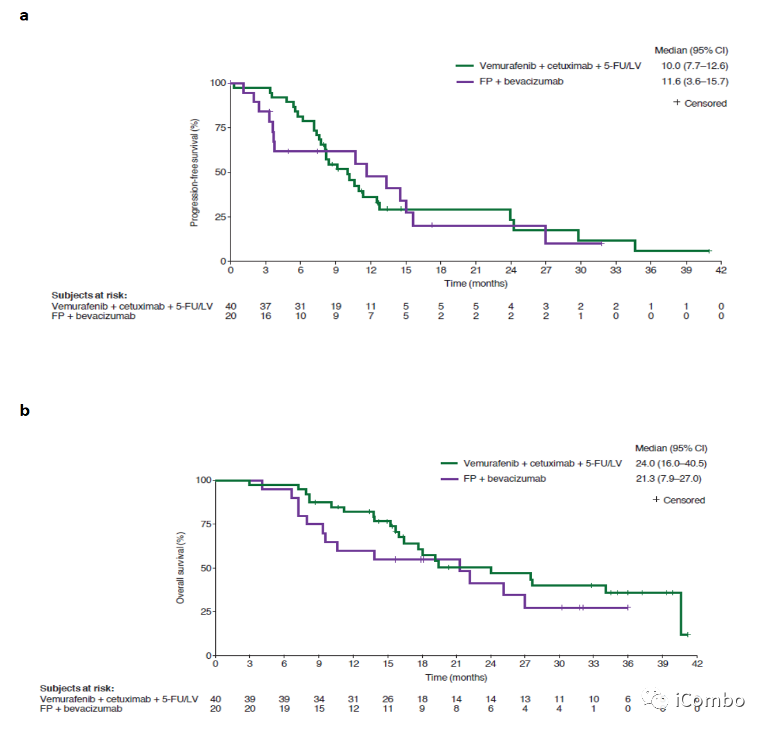
试验组与对照组相比,中位PFS没有改善,ORR和DCR在试验组中数值较高。
预先计划的PFS和OS亚组分析因患者数量较少而受到限制。
Cohort1安全性
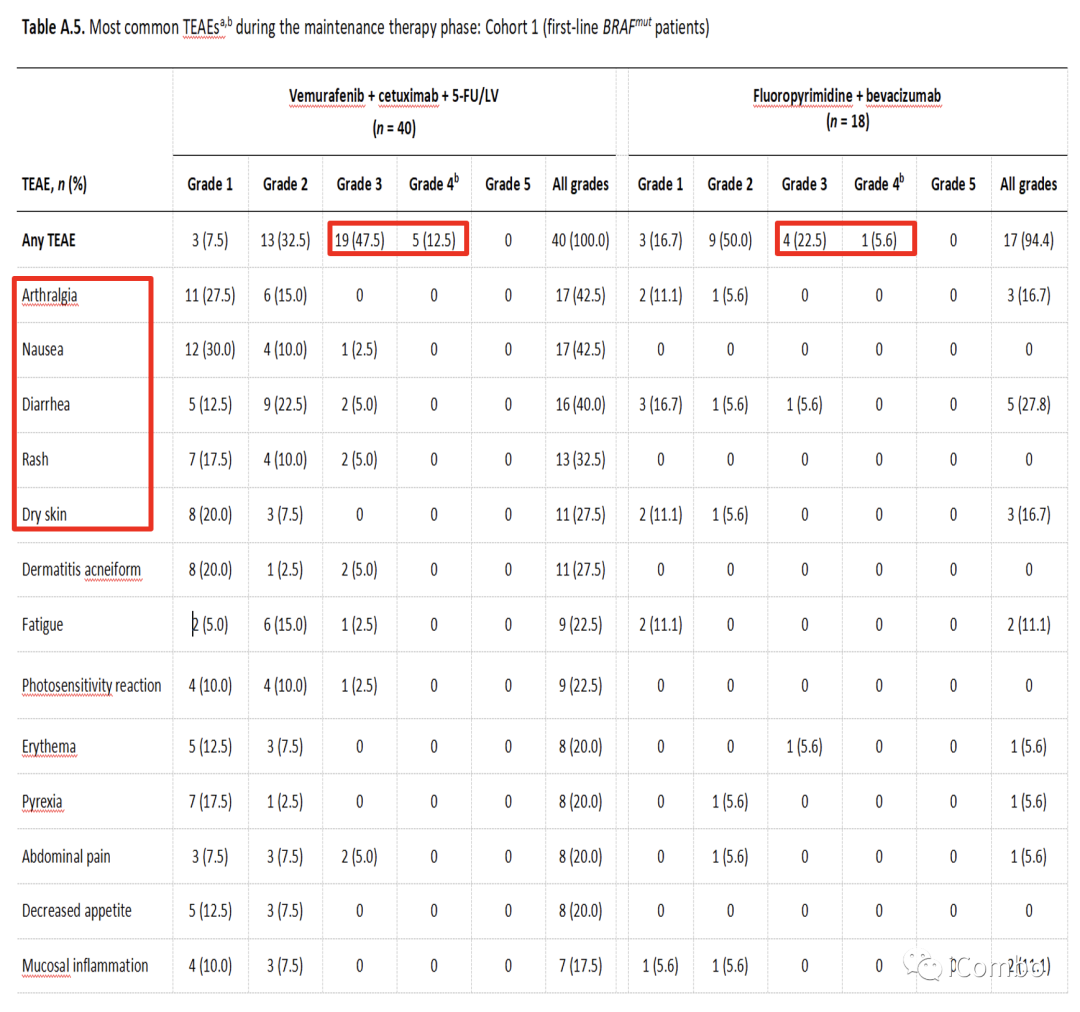
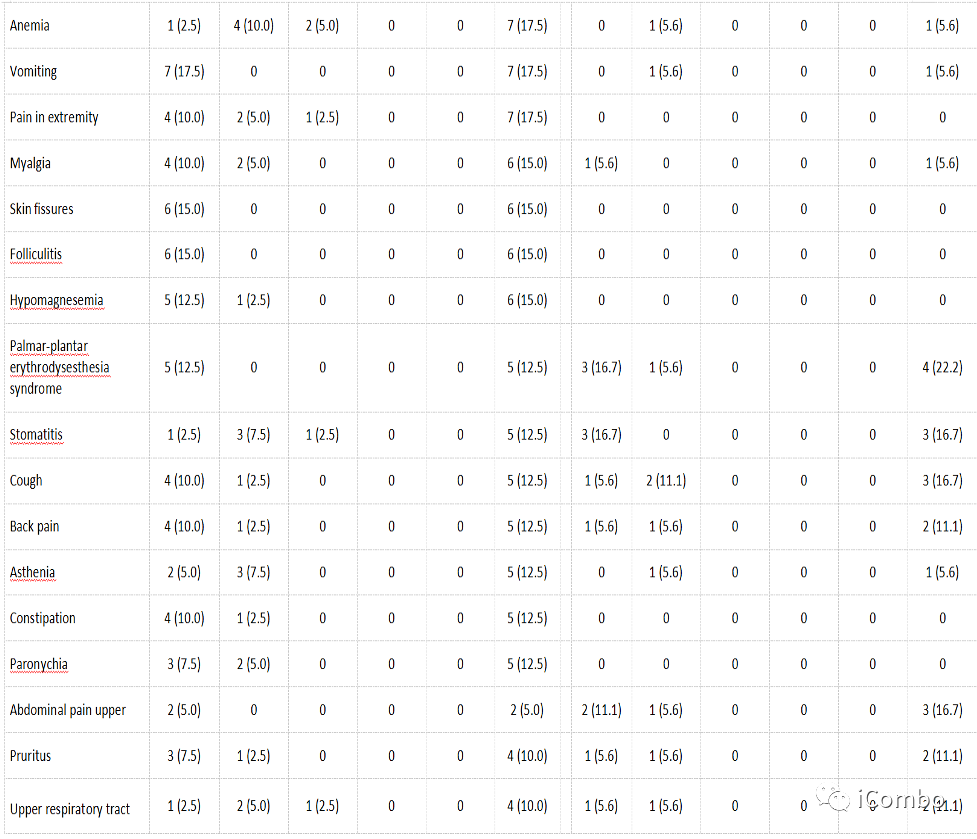
Cohort1探索性基因分析
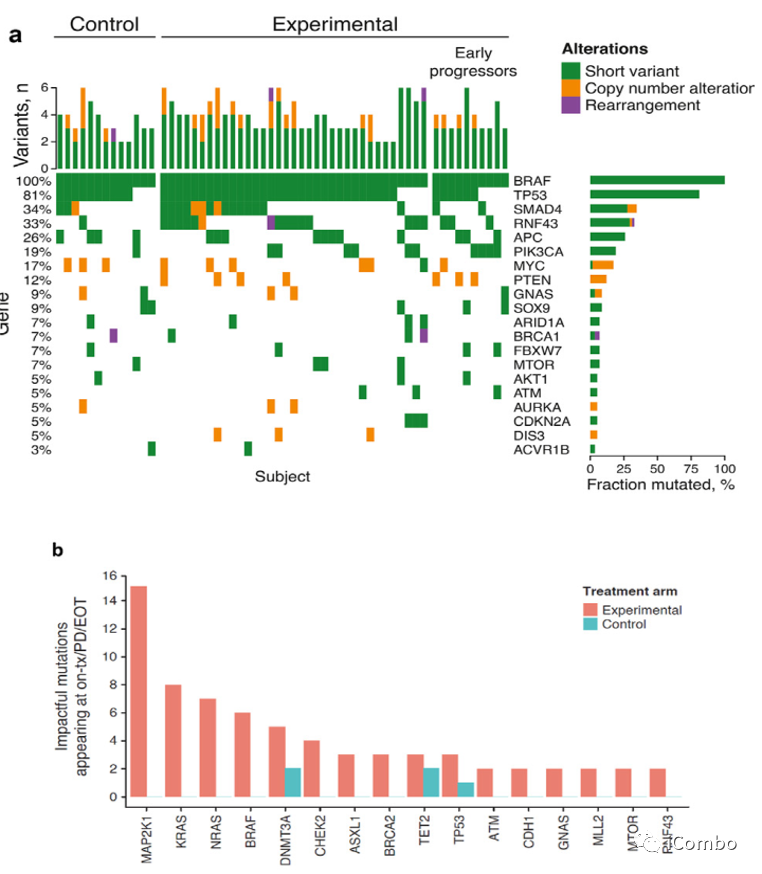
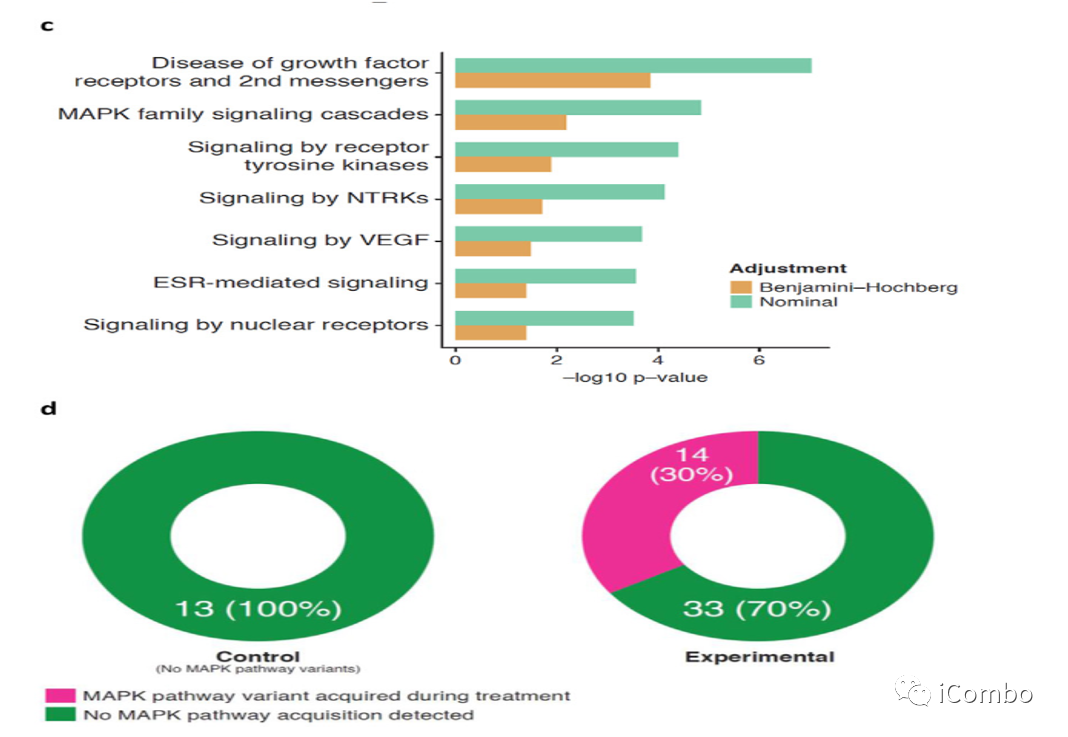
60例样本来源:50例维持治疗(维莫非尼+西妥昔+5-FU/LV,N=37;5-FU+贝伐单抗,N=13)+10例二线治疗。
基线时,所有患者都有BRAFV600E突变(血浆+组织),大多数患者有TP53突变。
在维莫非尼+西妥昔单抗+5-FU/LV维持治疗中,MAPK通路的突变有优先选择。
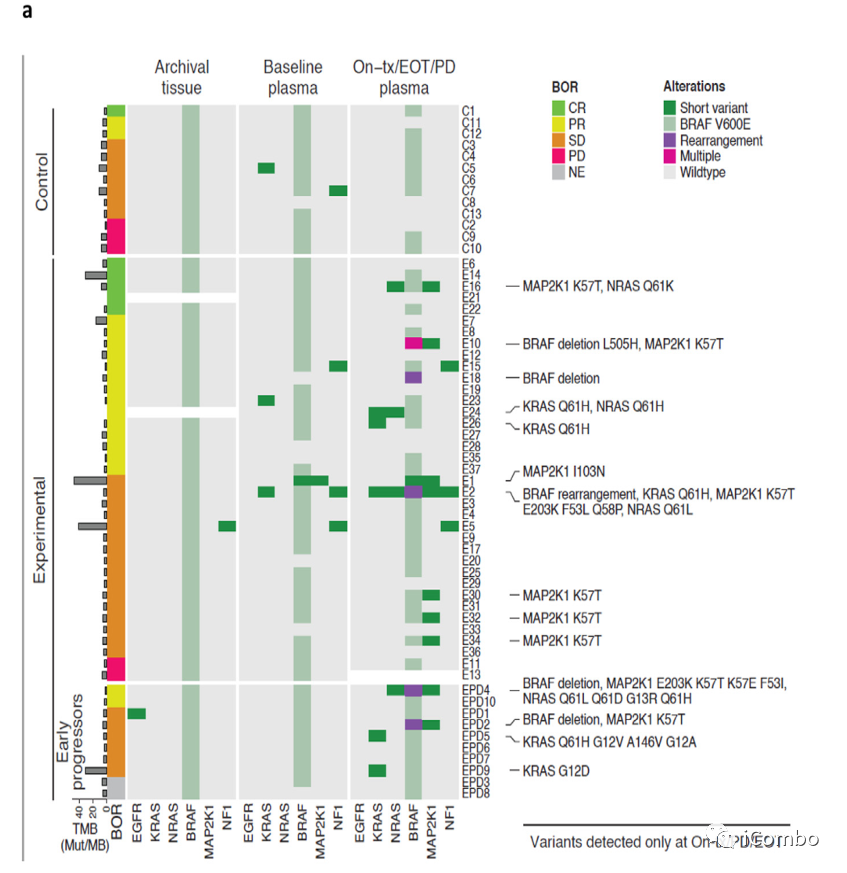
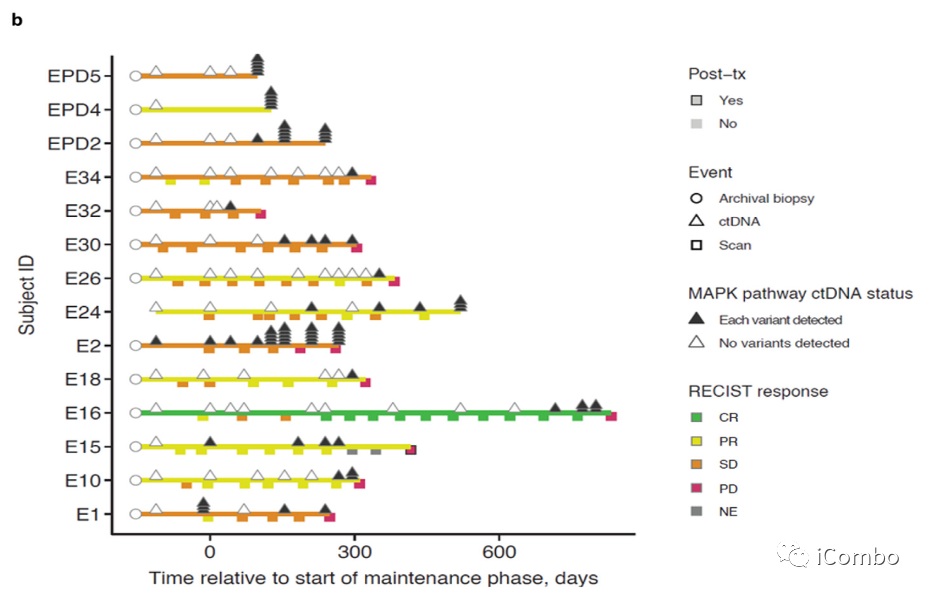
MAPK通路基因的改变在基于BRAF抑制剂的联合治疗而不是抗血管内皮生长因子的治疗。
如果在EGFR、KRAS、NRAS、BRAF、MAP2K1或NF1基因中没有检测到变异,则MAPK途径ctDNA状态为阴性(白色三角形),反之为阳性(黑色三角形)。堆叠的黑色三角形的数量表示在特定时间点检测到的变体数量。从MAPK通路变异检测到肿瘤进展(N=10)的中位时间为6个月。
Cohort3
5例患者完成诱导治疗,并随机接受维持治疗(卡培他滨+曲妥珠单抗+帕妥珠单抗,N=3;5-FU+贝伐单抗,N=2)。其中女性3例,男性2例,年龄37~56岁。
试验组(N=3)的PFS为3.6个月-14.7个月,而对照组为4.0及5.4个月,所有患者均PD。
没有患者经历SAE或不良事件导致停药。
Cohort4基线
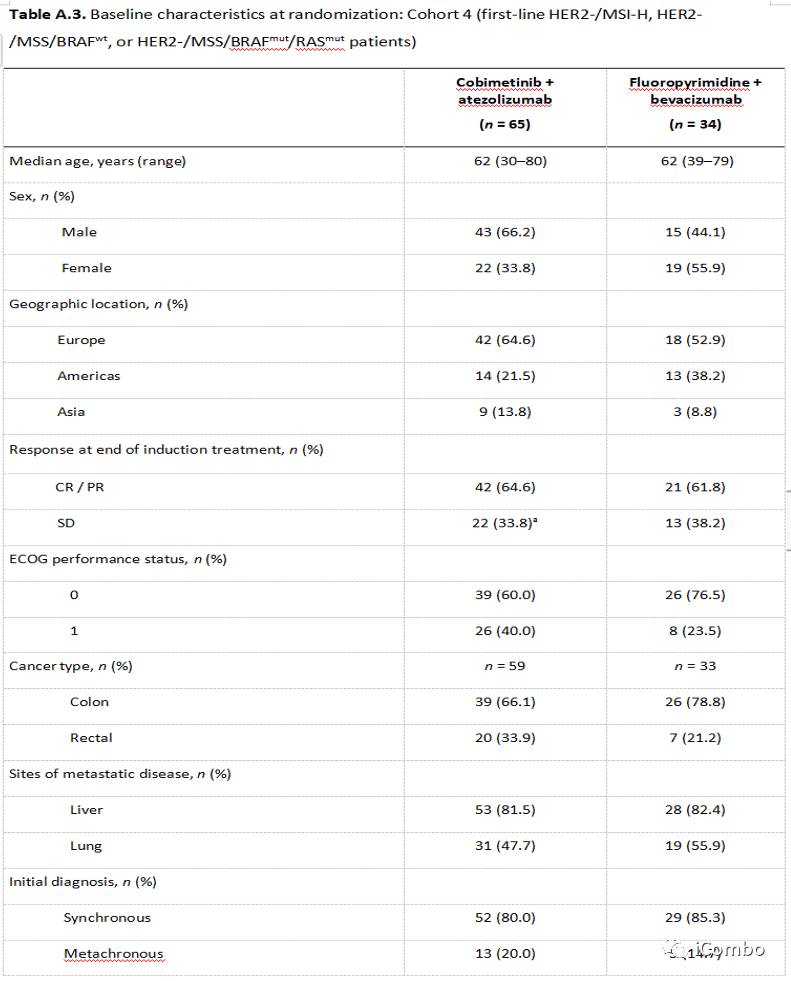
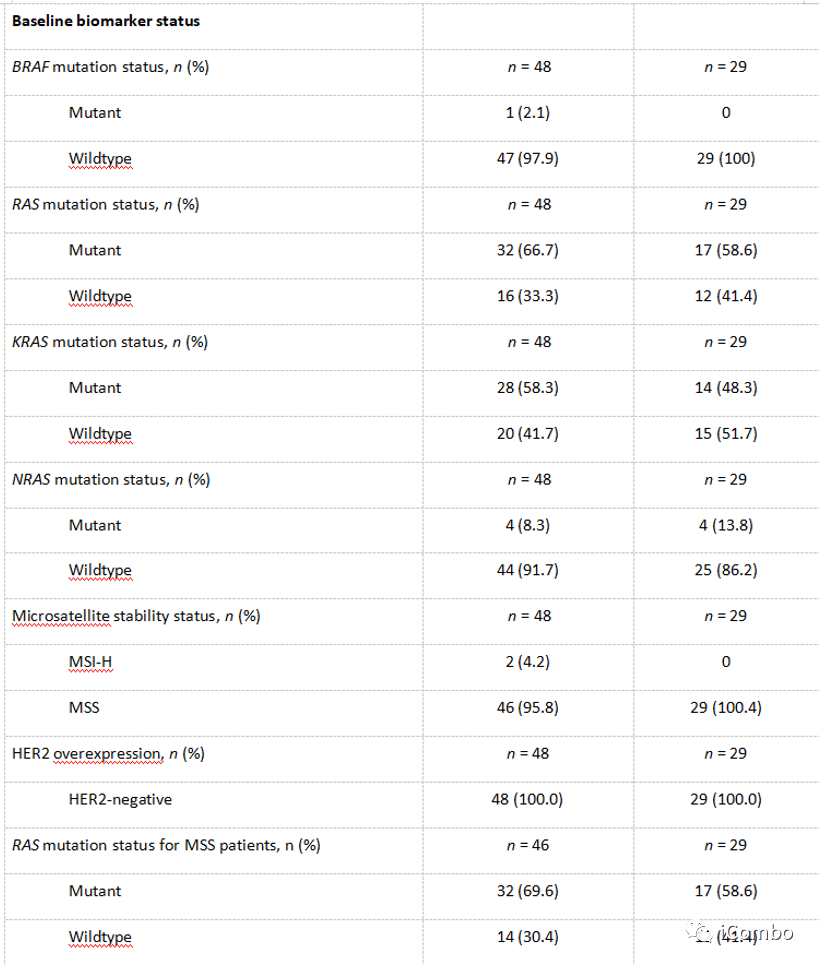
Cohort4疗效

试验组与对照组相比,PFS和OS更短。
Cohort4安全性
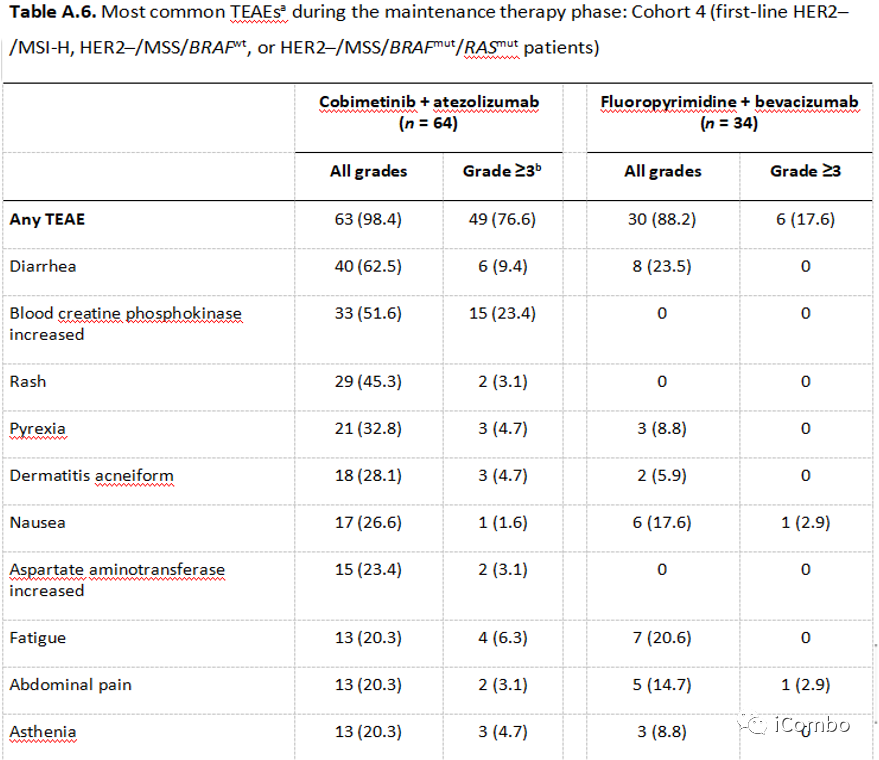
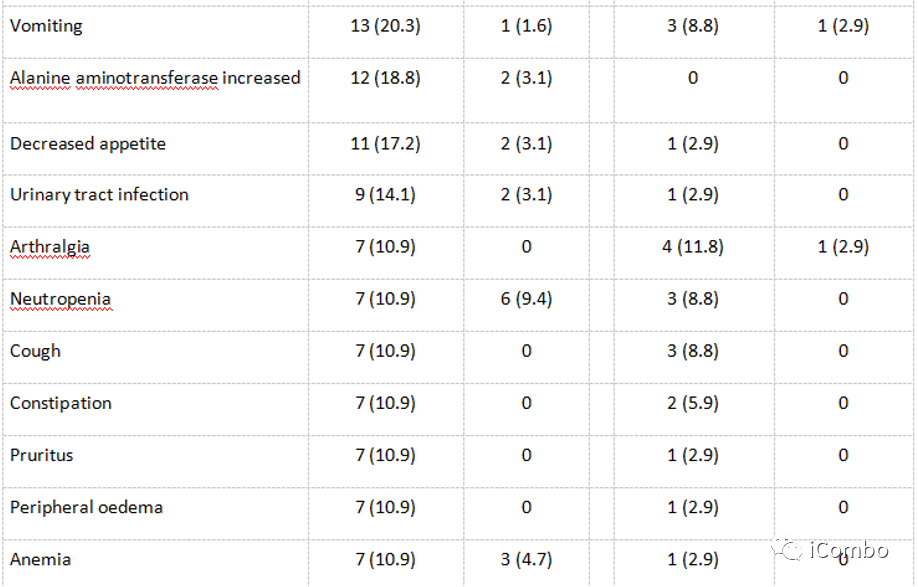
与对照组相比,试验组患者发生TEAE的比例更高(98.4% vs 88.2%),3级以上TEAE(76.6% vs 17.6%)。
讨论
在MODUL试验的队列1中,患有BRAF突变的原发结直肠肿瘤患者接受了BRAF-EGFR抑制剂+5-FU/LV的实验性维持治疗。
队列1的研究结果显示,尽管OS和ORR的评估对实验方案更有利,但PFS没有显著差异。但是中位数OS的差异表明了临床受益的可能性(实验:24.0个月,对照组:21.3个月;P=0.287)。队列1中两个治疗组的中位PFS(10个月)高于方案估计(实验:7个月;对照:4.9个月),略高于Beacon试验中的中位OS(9.3个月,原因可能是诱导治疗的效果。
Cohort 1的基因数据支持BRAF获得性耐药性涉及MAPK信号通路中新的激活突变,强调了在接受EGFR和BRAF抑制剂治疗后,MAPK重新激活位于EGFR下游。此外,仅在Cohort 1试验性治疗组中,MAPK途径基因的突变通常同时出现在疾病控制期之后和疾病进展之前,疾病进展的中位时间为6个月。
在队列1中,三联试验方案的不良事件发生率高于双联对照方案,但低于Enorafenib+西妥昔单抗+mFOLFOX6(13% vs 26%)。总体而言,维持治疗期间不良事件是可控的,未发现新的安全事件。由HER2-/MSS/BRAFwt患者组成的队列4中,cobimetinib+atezolizumab抑制MAPK通路并没有改善PFS,且增加了毒性。
结论
维莫非尼+西妥昔单抗+5-FU/LV可作为BRAFmut mCRC的一线维持治疗方案行进一步研究。MAPK途径出现的基因组改变可能为BRAFmut mCRC提供新的治疗机会。
针对HER2-/MSS/BRAFwt mCRC患者,Cobimetinib+atezolizumab未带来PFS获益,需要新的策略来增加MSS mCRC对免疫治疗的易感性。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











不错,学习了。
0