Eur. Urol:帕博利珠单抗伴或不伴仑伐替尼作为晚期尿路上皮癌的一线治疗(LEAP-011)
2023-10-06 daikun MedSci原创 发表于陕西省
该研究旨在评估帕博利珠单抗伴或不伴仑伐替尼作为晚期尿路上皮癌的一线治疗的疗效和安全性,研究结果显示在晚期UC患者中,一线仑伐替尼加帕博利珠单抗在晚期尿路上皮癌患者中并不比帕博利珠单抗加安慰剂更有效。
局部晚期、不可切除或转移性尿路上皮癌(UC)患者的一线标准治疗是基于顺铂的联合吉西他滨或甲氨蝶呤、长春碱和多柔比星的联合化疗。其中多达一半的UC患者不能耐受基于顺铂的方案,对于这些患者,治疗选择包括卡铂联合吉西他滨等。然而,部分患者可能因卡铂相关毒性而不适合任何铂类化。因此,迫切需要一种可耐受且有效的非铂类一线治疗方案。近期发表在《European Urology》上的一项名为LEAP-011的3期试验评估了帕博利珠单抗加仑伐替尼或帕博利珠单抗加安慰剂对既往未经治疗的晚期UC患者的疗效和安全性。
LEAP-011 (NCT03898180)是一项随机、双盲、多中心3期试验,招募了≥18岁且组织学或细胞学确诊为晚期UC的患者。根据 RECIST v1.1评估的患者至少有一个可测量的病变,并且既往未接受过晚期或转移性UC的全身化疗。符合条件的患者的东部肿瘤协作组体能状态(ECOG PS)评分为0-2,肿瘤PD-L1阳性状态(CPS ≥10),没有资格接受基于顺铂的化疗,或者ECOG PS评分为2,并且被认为没有资格接受任何铂类化疗,无论PD-L1状态如何。

患者被随机分配(1:1)接受帕博利珠单抗200mg每3周一次,加上仑伐替尼20mg或安慰剂每日一次。双主要终点是BICR根据RECIST v1.1评估的PFS和OS,次要终点为BICR根据RECIST v1.1评估的ORR,安全性和耐受性。
1 .人群和基线特征
487名患者被随机分配接受仑伐替尼加帕博利珠单抗(n = 245 [50%])或安慰剂加帕博利珠单抗(n = 242 [50%];。患者人口统计学和基线疾病特征在治疗组之间平衡良好。

2 .PFS分析
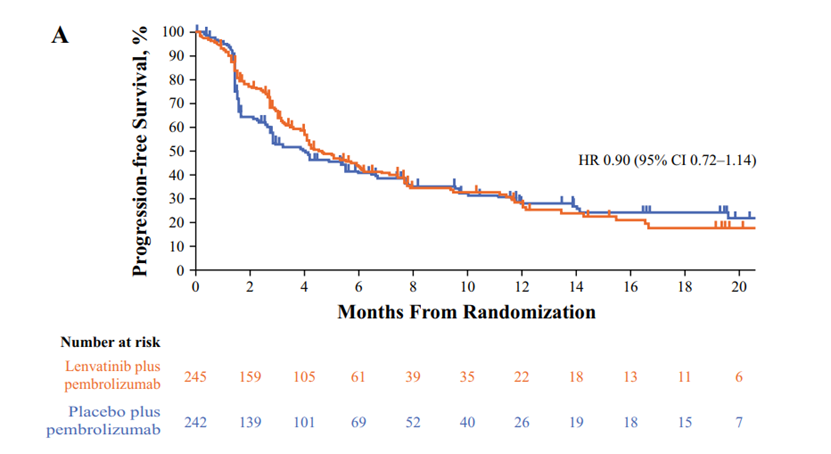
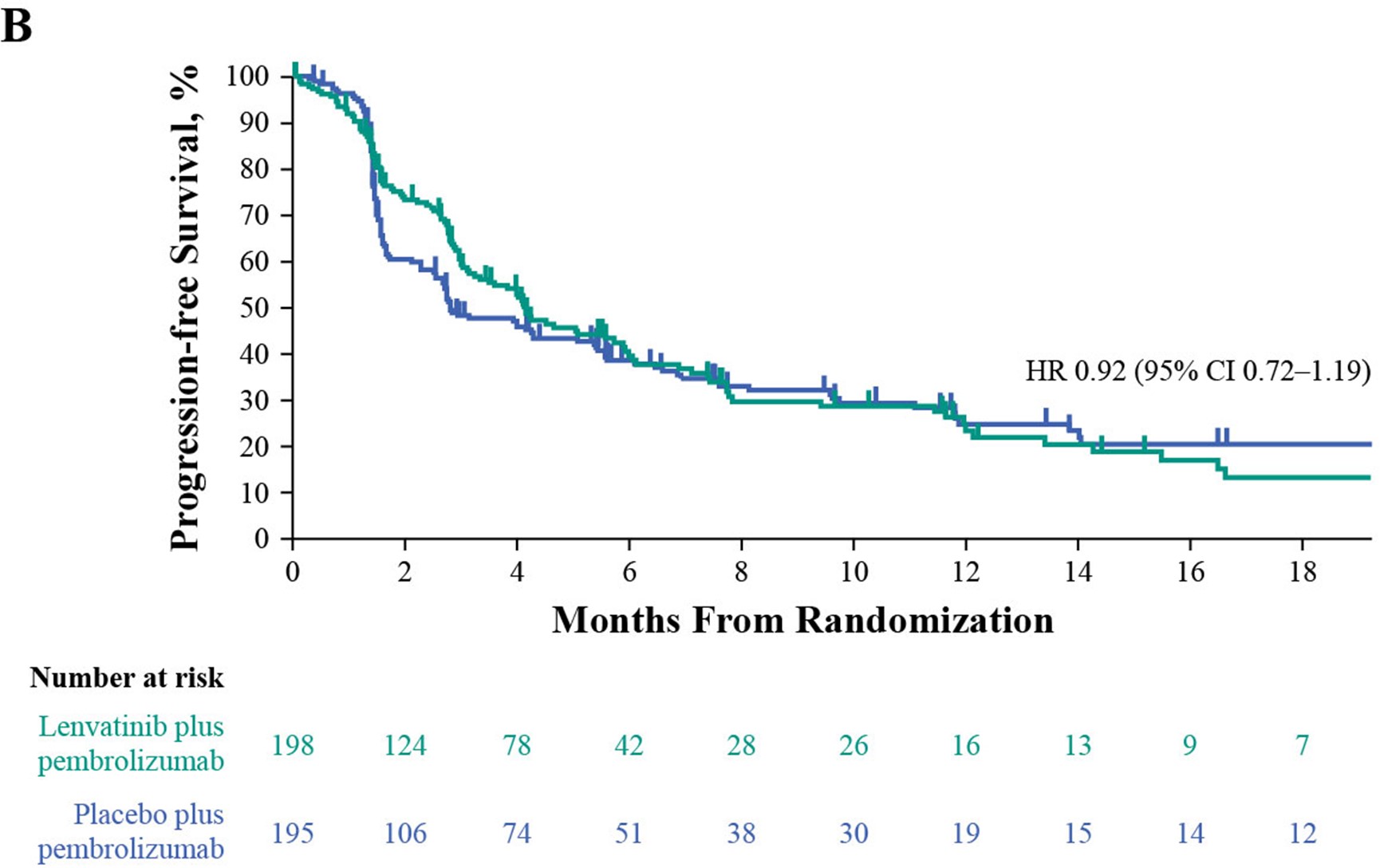
联合治疗组的中位PFS为4.5个月,而帕博利珠单抗组为4.0个月(HR 0.90 [95% CI 0.72–1.14]. 在不适合顺铂化疗的患者中,联合治疗组的中位PFS为9.5个月,帕博利珠单抗组的中位PFS为7.6个月(HR 0.82 [95% CI 0.45–1.49];在不适合任何铂类化疗的患者中,联合组的中位PFS为4.1个月,帕博利珠单抗组的中位PFS为2.8个月(HR 0.92 [95% CI 0.72–1.19]。

3 .OS分析
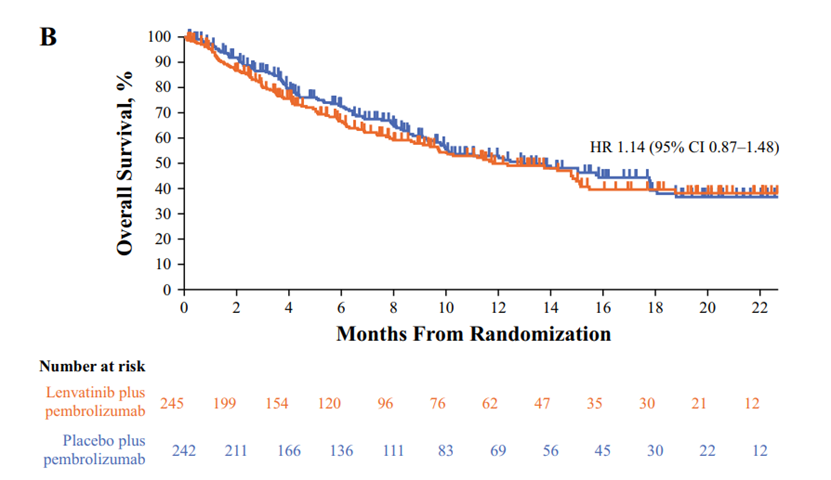
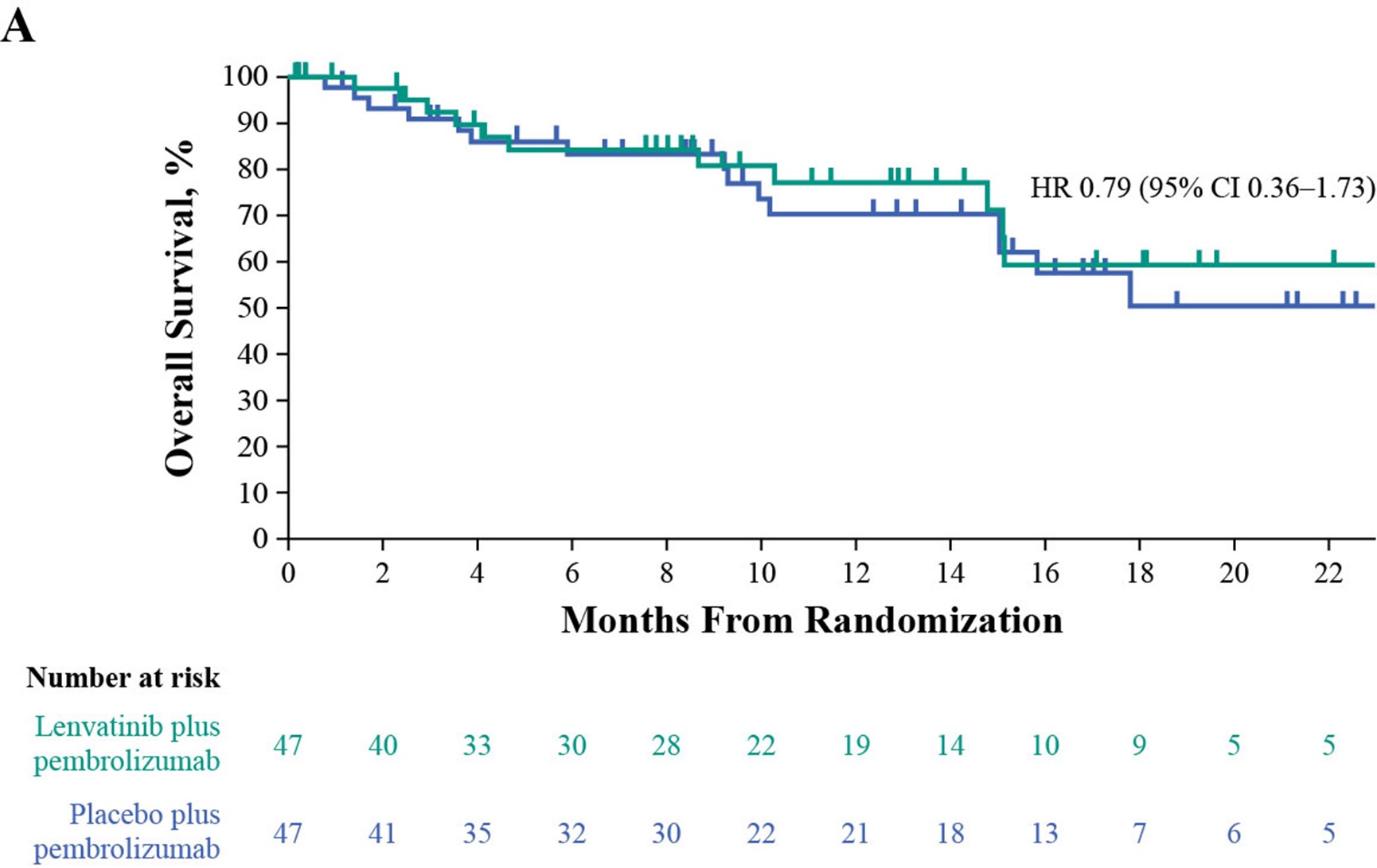
在数据截止时,已有217名患者死亡,包括联合组的109名患者和帕博利珠单抗组的108名患者。联合治疗组的中位OS为11.8个月,而帕博利珠单抗组为12.9个月(HR 1.14 [95% CI 0.87–1.48]. 在不适合顺铂化疗的患者中,联合用药组和帕博利珠单抗组均未达到中位OS(NR)(HR 0.79 [95% CI 0.36–1.73];在不适合任何铂类化疗的患者中,联合组的中位OS为9.7个月,帕博利珠单抗组的中位OS为10.1个月(HR 1.19 [95% CI 0.90–1.58]。

4. ORR分析
ORR在联合组中为33%,在帕博利珠单抗组中为29%;联合组有15例患者(6.1%),帕博利珠单抗组有18例(7.4%)有CR。联合组的中位DOR为12.8个月(95%CI 9.9–NR),帕博利珠单抗组的中位DOR为19.3个月(95%CI 11.1–NR)。在不适合顺铂化疗的患者中,联合组的ORR为43%(95%CI 28.3-57.8),帕博利珠单抗组为45%(95%CI 30.2-59.9)。联合组的中位DOR为NR(95%CI 6.9 mo–NR),帕博利珠单抗组的NR(95%CI 6.2 mo–NR)。在不适合任何铂类化疗的患者中,联合组的ORR为31%(95%CI 24.5-37.7),帕博利珠单抗组为25%(95%CI 19.2-31.8)。联合组的中位DOR为10.8个月(95%CI 6.2–15.2),帕博利珠单抗组的中位DOR为19.3个月(95%CI 11.1–NR)。

5.安全性分析
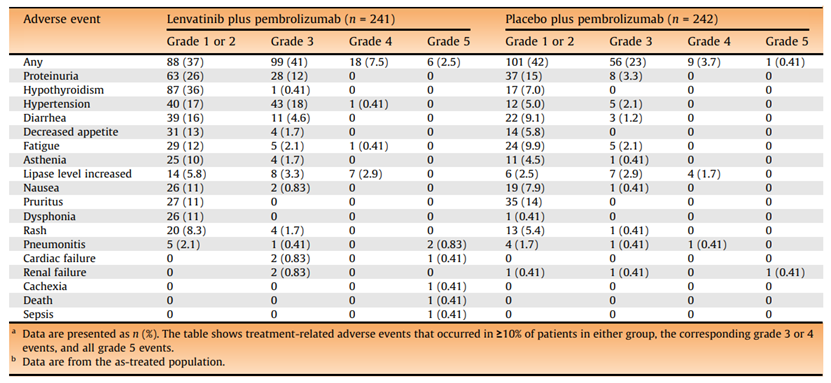
联合治疗组有211例患者(88%)报告了治疗相关不良事件,帕博利珠单抗组有167例患者(69%)报告了治疗相关不良事件。由于治疗相关的AE,联合组共有48名患者(20%)和帕博利珠单抗组的22名患者(9%)停止了任何治疗。联合治疗组共有54例患者(22%),帕博利珠单抗组共有24例患者(10%)发生严重的治疗相关AE。
结论:在晚期UC患者中,一线仑伐替尼加帕博利珠单抗在晚期尿路上皮癌患者中并不比帕博利珠单抗加安慰剂更有效。
原始出处:
Matsubara N, et al. 2023. Pembrolizumab with or Without Lenvatinib as First-line Therapy for Patients with Advanced Urothelial Carcinoma (LEAP-011): A Phase 3, Randomized, Double-Blind Trial. European Urology.DOI: 10.1016/j.annonc.2023.09.3110.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言