Cell:从氧化应激到癌症:BACH1如何平衡生与死?
2024-12-11 生物探索 生物探索 发表于陕西省
通过解析BACH1复杂的调控网络,该研究首次描绘了一个能够动态感知细胞状态并调控关键因子的分子机制。
引言
在我们的日常生活中,氧化应激(oxidative stress)作为细胞应对内外部刺激的一种状态,与衰老、慢性炎症及癌症等多种疾病密切相关。机体通过精密的调控机制,在抗氧化与氧化应激之间寻求平衡,其中一个核心参与者便是BACH1——一种兼具转录抑制和癌基因功能的关键因子。然而,BACH1如何在氧化应激环境中被调控,其作用机制背后隐藏的秘密长期以来并未被彻底揭示。
12月9日Cell最新的研究报道“Dual BACH1 regulation by complementary SCF-type E3 ligases”,发现BACH1的稳定性受到两种互补的E3泛素连接酶的共同调控,即SCFFBXO22和SCFFBXL17。这一调控机制就如同一个开关,能够精确感知细胞内的变化,并决定BACH1是被降解还是保持活性。这一过程中的核心在于BACH1的BTB结构域(Broad-complex, Tramtrack, and Bric-à-brac domain),该结构域形成一种四级“降解信号”(quaternary degron),这一独特的分子特征使得BACH1在不同条件下被不同的酶所识别。
更令人惊讶的是,该研究还揭示了癌症相关的基因突变如何改变这种调控机制,使得BACH1在某些肿瘤中被稳定化并促进癌细胞的侵袭能力。同时,氧化应激下的半胱氨酸修饰也能够作为“分子开关”,使BACH1从一种E3连接酶的控制切换到另一种连接酶的控制。这些发现不仅深化了我们对抗氧化应激反应机制的理解,也为开发针对BACH1的新型抗癌疗法提供了可能的方向。
通过解析BACH1复杂的调控网络,该研究首次描绘了一个能够动态感知细胞状态并调控关键因子的分子机制。这些发现对癌症研究及氧化应激相关疾病的治疗具有重要意义,也为未来的基础和应用研究指明了新方向。

解码氧化应激:细胞的生存之战
在微观世界中,细胞每天都面临着由自由基(free radicals)和活性氧(reactive oxygen species, ROS)带来的威胁。这些分子犹如一把双刃剑:在正常水平下,它们参与信号传导和免疫防御;然而,当它们积累到危险水平时,会破坏细胞内的DNA、蛋白质和脂质,最终导致细胞损伤甚至死亡,这种状态被称为氧化应激(oxidative stress)。氧化应激不仅与衰老过程密切相关,还与癌症、心血管疾病和神经退行性疾病等多种病理状态息息相关。
为了应对这种潜在威胁,细胞进化出了一套精密的防御机制,通过抗氧化应激反应维持氧化还原平衡(redox balance)。在这一过程中,NRF2和BACH1是两大关键角色。NRF2(Nuclear factor erythroid 2-related factor 2)是抗氧化基因的激活者,而BACH1(Broad-complex, Tramtrack, and Bric-à-brac domain and CNC homolog 1)则是一个强有力的抑制者,它们共同争夺抗氧化应答元件(antioxidant responsive elements, AREs),以调节下游基因的表达。
在正常条件下,BACH1占据主导地位,通过抑制与氧化还原平衡相关基因的表达来维持静息状态。然而,当氧化应激发生时,NRF2被释放并转移到细胞核中,迅速启动抗氧化基因的表达,如血红素加氧酶-1(heme oxygenase-1, HO-1),以降解血红素(heme)并减少ROS水平。同时,BACH1则被血红素结合后从细胞核移出,并通过泛素-蛋白酶体途径(ubiquitin-proteasome pathway)快速降解。这种复杂的反馈回路既保护了细胞免受氧化应激的损害,又避免了抗氧化机制的过度激活。
BACH1的双面角色:守护者还是煽动者?
BACH1,作为一种在细胞中具有多重功能的转录因子,其角色复杂多样,犹如一位亦正亦邪的“双面间谍”。在正常生理条件下,BACH1充当着细胞抗氧化防御的守护者,维持氧化还原平衡,避免细胞因过度活跃的抗氧化机制而受损。然而,在某些癌症中,它却蜕变为助纣为虐的“煽动者”,推动癌细胞的存活与扩散。
作为抗氧化基因的调控者,BACH1主要通过与抗氧化应答元件(AREs)结合,抑制下游基因如血红素加氧酶-1(heme oxygenase-1, HO-1)的表达。在正常状态下,这种抑制机制维持了细胞的氧化应激响应在低水平上的静息状态。然而,当氧化应激发生时,BACH1受到血红素(heme)结合的影响,被迅速移出细胞核,并通过SCFFBXO22和SCFFBXL17等E3连接酶的介导降解。这种快速的动态调控为NRF2提供了机会,接管AREs,激活一系列抗氧化基因,以保护细胞免受ROS的攻击。
然而,在癌症中,BACH1的“剧本”发生了变化。研究发现,某些癌症相关突变会干扰BACH1的降解机制,使其在细胞中积累。被稳定化的BACH1不再充当抗氧化反应的抑制器,而是利用其转录调控能力,激活与细胞增殖、侵袭相关的基因表达。例如,稳定化的BACH1通过调节细胞外基质降解相关基因,为癌细胞的转移提供了便利。此外,它还能通过限制氧化应激水平,为癌细胞创造一个适宜的生存环境。
值得注意的是,BACH1的这种角色转变并非孤立的事件,而是与肿瘤的微环境密切相关。氧化应激水平升高与癌症进展之间的关系日益清晰,BACH1在其中扮演了至关重要的中介角色。因此,理解BACH1这一“守护者”如何被转变为“煽动者”的分子机制,不仅可以帮助我们揭示癌症的发生机制,还可能为靶向治疗提供新的突破口。
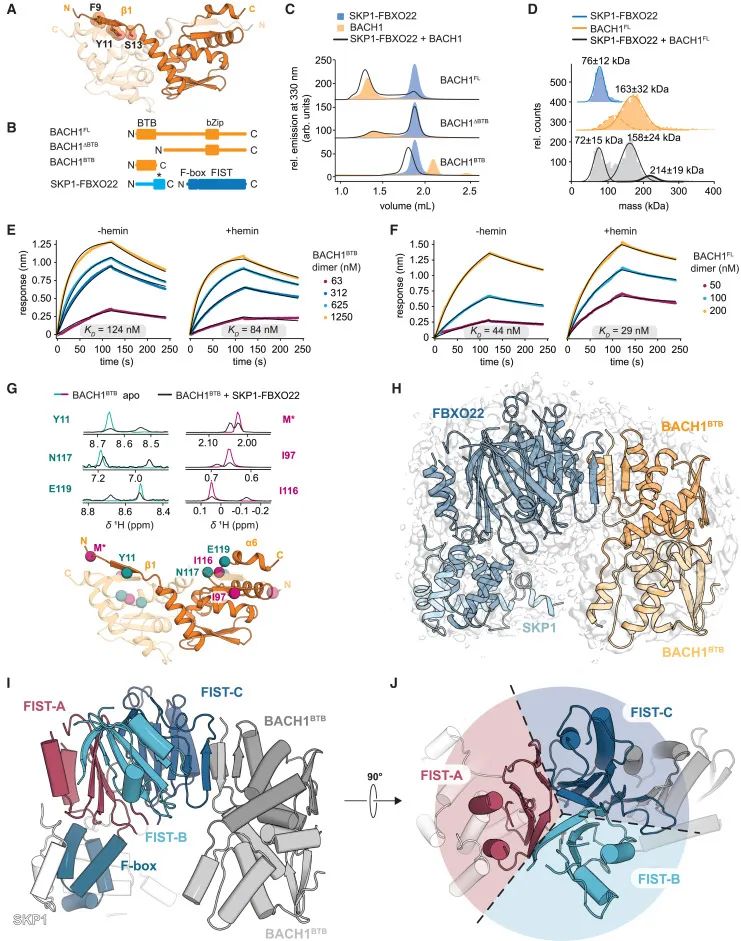
通过多种技术手段解析SKP1-FBXO22/BACH1BTB复合物的结构特性和相互作用机制(Credit: Cell)
BACH1 BTB结构域的模型构建:图(A)展示了利用AlphaFold2预测的BACH1 BTB结构域模型,并突出显示了之前识别出的与FBXO22结合的关键降解信号(degron)。
蛋白质构建和纯化:图(B)概述了SKP1-FBXO22和BACH1构建体的纯化结果,标注了其结构域特性,包括FIST结构域(F-box and intracellular signal transduction)、BTB结构域以及bZip结构域。
复合物的形成分析:图(C)通过荧光检测排阻层析(fSEC)验证了SKP1-FBXO22与BACH1构建体之间的复合物形成情况。
复合物化学计量分析:图(D)通过质量光度分析(MP)进一步明确了SKP1-FBXO22和BACH1全长蛋白(BACH1FL)之间的复合物化学计量比,发现其可能的组成为(SKP1)1(FBXO22)1(BACH1FL)2。
血红素对结合的影响:图(E)和(F)通过生物层干涉(BLI)分析了血红素(hemin)对FBXO22-BACH1相互作用的影响,结果表明血红素对二者的结合具有一定影响。
分子间相互作用的核磁共振分析:图(G)通过核磁共振(NMR)分析BACH1BTB和SKP1-FBXO22的相互作用,展示了2D NMR谱图的1D投影,明确了与结合相关的关键残基位置,并在AlphaFold2模型中进行了标注。
冷冻电镜结构解析:图(H)显示了SKP1-FBXO22/BACH1BTB复合物的冷冻电镜(Cryo-EM)密度图,与结构模型进行叠加以验证其准确性。
FBXO22的结构域特征:图(I)和(J)展示了FBXO22的域架构,强调其FIST结构域的三重伪对称性,为FBXO22的功能提供了结构基础。
分子开关:BACH1如何被两种E3连接酶调控
在细胞的精密调控网络中,BACH1的命运掌握在两种E3连接酶的“手中”:SCFFBXO22和SCFFBXL17。这两种酶如同一对默契的伙伴,通过不同的机制感知BACH1的状态,并决定其降解的时机与方式。这种“双重调控”机制不仅体现了细胞调控的复杂性,也揭示了BACH1稳定性背后的分子开关。
SCFFBXO22的作用机制可以被视为“精准锁定”。研究表明,它识别并结合BACH1 BTB结构域(Broad-complex, Tramtrack, and Bric-à-brac domain)中的一种“降解信号”(quaternary degron)。这个降解信号是由BACH1的二聚体化形成的域交换β片层(domain-swapped β-sheet)构成,其稳定性直接影响SCFFBXO22的结合能力。在正常条件下,SCFFBXO22会高效识别这种信号,将BACH1标记为降解对象。然而,当发生癌症相关突变或氧化应激导致半胱氨酸(cysteine)修饰时,这种降解信号的稳定性可能受损,从而影响SCFFBXO22对BACH1的调控。
另一方面,SCFFBXL17的作用机制被描述为“质量监控”(dimerization quality control)。当BACH1的BTB结构域因突变或氧化应激而变得不稳定时,SCFFBXL17将接管调控任务。此时,BACH1的二聚体结构会部分解体,暴露出一个隐藏在二聚界面的降解信号。这一信号被SCFFBXL17识别,使其能够高效结合并促进BACH1的降解。可以说,SCFFBXL17是一种补偿机制,在BACH1 BTB结构域失稳的情况下,确保其仍能被细胞及时清除。
值得注意的是,这种“双管齐下”的调控机制使BACH1的稳定性能够动态响应细胞内外环境的变化。例如,在氧化应激中,SCFFBXO22会首先通过血红素(heme)结合触发BACH1的降解,而当血红素水平下降或BTB结构域失稳时,SCFFBXL17则能够接棒继续完成降解任务。这种巧妙的调控方式确保了BACH1无论在稳定状态还是失稳状态下,都能被细胞精确控制,为抗氧化应激反应和细胞稳态的维持提供了双重保障。
四级“降解信号”:BACH1调控的密码
在BACH1的调控网络中,其BTB结构域犹如一个精密的分子“密码锁”,通过其独特的构造决定着BACH1的稳定性与命运。这个结构域的核心特征是一种被称为“四级降解信号”(quaternary degron)的特殊分子标记,它既是BACH1功能的关键,也是一切调控的起点。
BTB结构域的特殊性在于它由两个BACH1分子通过域交换β片层(domain-swapped β-sheet)形成稳定的二聚体。这种构造不仅赋予了BACH1独特的三维形态,还在分子表面呈现出一个高度特异的结合位点——这正是SCFFBXO22所识别的“四级降解信号”。该信号的稳定性依赖于多个关键氨基酸残基的相互作用,比如β片层中的Phe9、Tyr11和Ser13,它们共同构成了一个精确适配SCFFBXO22的三维结合界面。研究发现,任何扰动这些关键残基的突变或修饰,都可能导致“四级降解信号”的失效,使BACH1逃脱SCFFBXO22的降解。
然而,这个信号并非总是稳定存在。在特定条件下,如氧化应激或癌症相关突变时,BTB结构域的稳定性可能被破坏,导致二聚体部分解体,并暴露出原本隐藏在界面中的另一种降解信号。这一信号则被SCFFBXL17所识别,触发BACH1的另一种降解途径。换句话说,BTB结构域就像一个分子开关,能够在不同状态下切换降解信号,为BACH1提供动态而精准的调控。
有趣的是,BTB结构域的功能并不仅限于结合E3连接酶。它还通过调控BACH1与其他蛋白的相互作用,间接影响其在细胞中的功能。例如,当SCFFBXO22结合BACH1时,其降解信号的特异性被增强,这种机制不仅避免了BACH1的无序降解,还确保了抗氧化应激反应的高效性。
通过解读BACH1的BTB结构域及其“四级降解信号”,研究人员首次揭示了BACH1调控的密码。这一密码的破译为我们理解细胞如何在动态环境中精准控制关键分子提供了新视角,同时也为开发针对BACH1的靶向治疗策略奠定了基础。
癌症突变如何让BACH1失控?
在健康细胞中,BACH1的动态调控确保了氧化还原平衡的维持与细胞环境的稳定。然而,在某些癌症中,BACH1这一“调控者”却被癌症相关突变“劫持”,导致其调控机制失效,成为癌细胞的“帮凶”。这些突变对BACH1的稳定性和功能产生深远影响,为癌细胞的生长和扩散开辟了“绿色通道”。
研究发现,与BACH1相关的癌症突变多集中于BTB结构域中的关键残基区域,这些突变破坏了“四级降解信号”的稳定性,从而干扰SCFFBXO22对BACH1的识别。例如,Y11H突变使BACH1的β片层结构不稳定,导致BACH1无法被SCFFBXO22结合和降解。这一改变直接使BACH1在细胞中异常稳定化,并通过激活与肿瘤相关的基因表达,推动癌症的发展。类似的A53V突变则改变了BTB二聚界面的特性,进一步削弱了SCFFBXO22的调控能力。
不仅如此,FBXO22本身也可能发生癌症相关突变,从而间接影响BACH1的降解。例如,FBXO22中的R367W和Q307R突变会干扰其与BACH1的结合,使得BACH1在细胞中异常积累。这种积累现象被认为与肿瘤细胞的侵袭性增强有关,因为稳定化的BACH1能够激活与细胞迁移和血管生成相关的基因网络,为癌细胞提供更有利的生存和扩散条件。
BACH1的异常稳定化不仅增强了癌细胞的适应能力,还降低了其对治疗的敏感性。例如,在氧化应激环境中,癌细胞通过稳定的BACH1降低ROS水平,从而减弱了放疗和化疗的杀伤作用。这种双重作用使BACH1成为癌症中的重要目标分子。
从基础研究到治疗新视角
这一研究的突破性发现,不仅揭示了BACH1如何在氧化应激中被精确调控,也为癌症和氧化应激相关疾病的治疗提供了全新的视角。
首先,该研究深入解析了BACH1 BTB结构域的核心作用,揭示了“四级降解信号”如何作为分子标签,决定BACH1的命运。这一发现填补了科学界长期以来关于BACH1调控机制的空白,并揭示了癌症相关突变如何干扰这种降解信号,使BACH1在癌细胞中异常稳定化。通过理解这一机制,我们可以设计出针对BACH1降解信号的特异性调节剂,从而抑制其在肿瘤中的致病作用。
其次,研究还揭示了氧化应激条件下BACH1的切换机制,这一发现对治疗氧化应激相关疾病具有重要意义。在氧化应激中,BACH1通过SCFFBXL17的补偿性调控机制被高效清除,为抗氧化应激反应的平衡提供了保障。这一机制表明,开发针对SCFFBXL17功能的增强剂或其相关通路的药物,可能在缓解氧化应激引发的慢性疾病(如神经退行性疾病和心血管疾病)中发挥潜在作用。
更为重要的是,研究中发现的BACH1半胱氨酸修饰调控机制,为开发靶向氧化应激的药物提供了新方向。这些修饰作为“分子开关”,可以通过调节BACH1的稳定性和降解途径,精确调控细胞对氧化应激的反应。基于这些修饰的药物可能成为治疗癌症及其他ROS相关疾病的新工具。
破解BACH1的更多奥秘
在未来的研究中,有几个关键方向值得深入探讨,并具有广泛的应用潜力。
首先,需要更全面地理解BACH1调控的动态网络。现有研究集中在BTB结构域的降解信号,但BACH1在全长蛋白的其他区域,尤其是其C端区域和其他功能域中,是否还存在新的调控信号值得进一步研究。这些区域可能与其他调控因子互作,从而影响其在癌症和抗氧化应激中的角色。通过进一步的分子结构研究,我们有望揭示这些未知信号,并开发针对这些新靶点的治疗方法。
其次,BACH1与代谢和微环境的关系也可能是未来的重点方向。研究表明,BACH1通过调控细胞外基质降解和氧化还原平衡,对癌细胞的适应性生长和转移起到了关键作用。未来的研究可以进一步探索BACH1在肿瘤微环境中的作用机制,以及如何通过调控其活性来抑制肿瘤的扩散和耐药性。
此外,BACH1的半胱氨酸修饰作为氧化应激中的重要“分子开关”,为研究氧化还原信号的精细调控提供了新思路。这些修饰如何被精确触发?它们在不同组织和细胞类型中的作用是否存在差异?这些问题的解答将有助于开发基于BACH1的精准医疗手段,特别是在神经退行性疾病和心血管疾病等领域。
最后,研究结果还表明,BACH1可能在其他应激反应中发挥类似的作用,例如内质网应激或炎症反应。探索BACH1是否通过不同的降解途径或新的调控因子参与这些应激反应,将为我们理解细胞应激调控的整体网络提供更全面的视角。
未来,随着技术的进步,靶向BACH1的药物设计和基因编辑技术的应用,将为癌症及氧化应激相关疾病的治疗提供更多可能。
参考文献
https://www.cell.com/cell/fulltext/S0092-8674(24)01322-9
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#氧化应激# #BACH1#
10