Cell | 革新细胞生物学:真核细胞蛋白质组在细胞周期中的时空动态研究(长文)
2024-03-14 生物探索 生物探索 发表于上海
采用先进的生物信息学方法和高通量蛋白质组学技术,构建了酵母细胞周期过程中的蛋白质组动态变化图谱。
引言
细胞周期作为生命活动的基本过程,对于维持生物体的健康和稳定至关重要。它涉及一系列精确控制的事件,这些事件确保了DNA的正确复制和分配给子细胞。因此,对细胞周期的深入了解不仅是基础生物学研究的核心内容,也对癌症等疾病的预防和治疗具有重要意义。
细胞周期的进程受到多种蛋白质的调控,这些蛋白质的表达、定位及功能在细胞周期各阶段间发生动态变化。通过研究蛋白质在细胞周期中的行为,我们可以揭示其对细胞分裂、DNA复制和细胞死亡等关键生命过程的影响。此外,蛋白质组的动态变化还反映了细胞对内外环境变化的响应,为我们理解细胞生物学提供了新的视角。
3月6日Cell杂志报道的研究“Proteome-scale movements and compartment connectivity during the eukaryotic cell cycle”,采用先进的生物信息学方法和高通量蛋白质组学技术,构建了酵母细胞周期过程中的蛋白质组动态变化图谱。研究人员利用卷积神经网络(CNN)对成千上万的活细胞图像进行空间和时间上的解析,揭示了大约20种亚细胞定位类别中蛋白质的周期性变化。此外,还开发了一个基于Web的数据访问工具,能够通过酵母基因或其人类同源基因的名称搜索相关数据,以探索细胞周期中全局蛋白质动态。

Highlights
该研究通过应用两种独特的卷积神经网络(Convolutional Neural Networks, CNNs)于成百万活酵母细胞的图像,解析了真核细胞周期(Eukaryotic cell cycle)期间蛋白质组(Proteome)在浓度和定位上的动态变化。
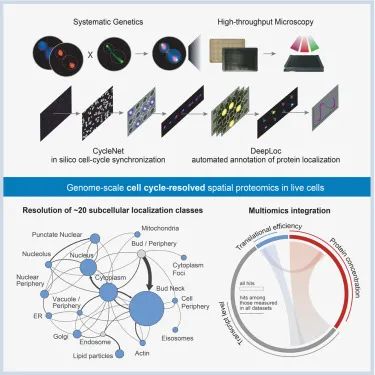
研究模式图(Credit: Cell)
创造了一个基因组规模、高时空分辨率的酵母细胞周期蛋白质组图谱(Genome-scale high-resolution spatiotemporal map of the yeast cell cycle proteome),为理解细胞周期的基本生物过程提供了系统级的视角。
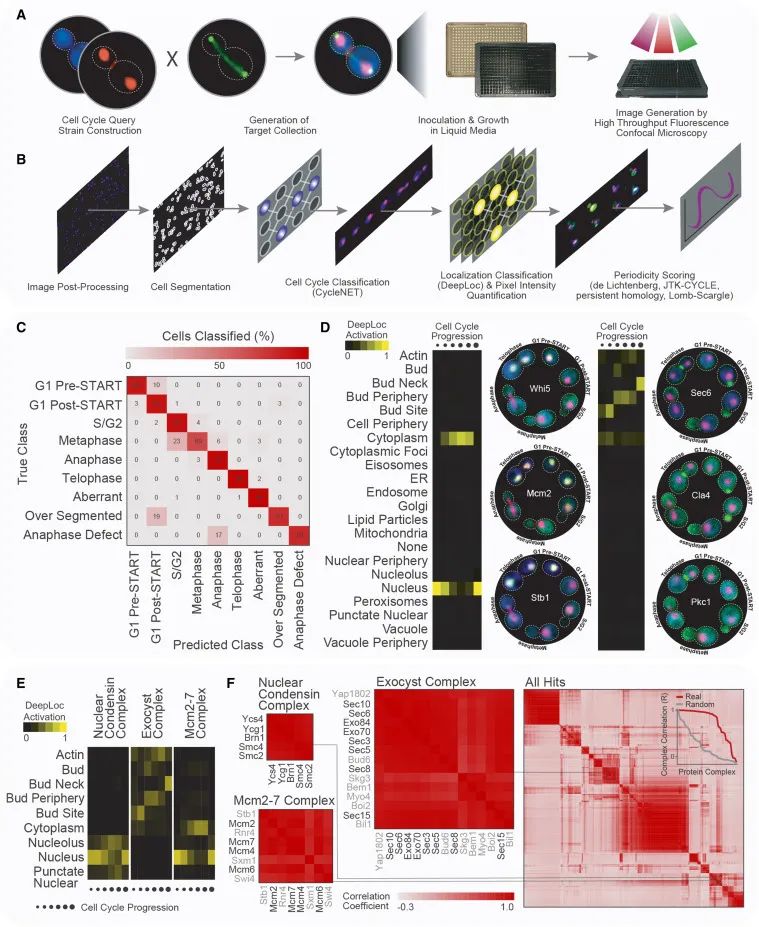
一个用于定量分析活细胞中蛋白质的时空动态的管线。这个管线结合了多种技术和方法,包括荧光显微镜成像、基因工程、计算机辅助的图像分析和机器学习。具体来说,该流程可能涉及以下步骤:使用荧光蛋白(如GFP)标记特定的蛋白质,以便在活细胞中可视化这些蛋白质;利用高通量显微镜成像技术捕捉大量细胞的图像,其中细胞表达不同的荧光蛋白融合体;使用图像处理和分析软件,自动化地分割和识别单个细胞及其相关的荧光信号,以评估蛋白质在细胞中的位置和表达量;通过应用机器学习算法和神经网络来分类和解析图像数据,比如识别不同的细胞周期阶段或蛋白质在细胞内的特定定位。(Credit: Cell)
利用CNNs分析静态活细胞图像,实现了蛋白质定位和浓度的时空剖析(Temporal and spatial disp)。
发展了基于Web的工具(Web-based tool),通过酵母基因或人类直系同源基因(Human orthologs)的名称进行数据访问,增强了数据的可用性和互动性。
通过单细胞蛋白质组测量与细胞周期解析的转录组(Transcriptome)和核糖体印记(Ribosome profiling)数据的结合,揭示了翻译后调控(Post-translational regulation)在决定细胞周期特异性蛋白质浓度中的重要作用。
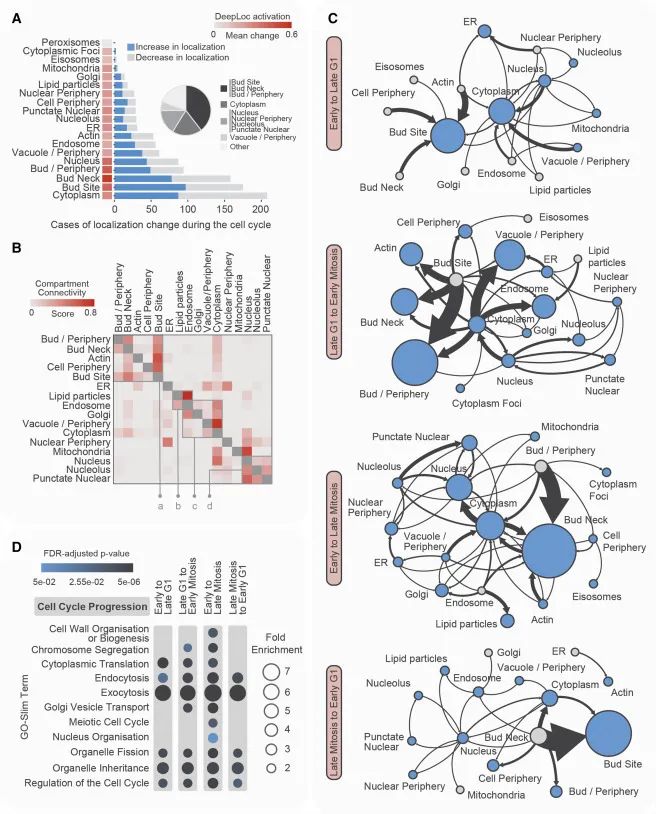
细胞周期中蛋白质运动及其与细胞器互连性的概览。(A) 展示了细胞周期中不同定位类别的蛋白质定位变化的数量及其平均幅度(以DeepLoc激活的平均变化表示;红色条)。插图显示了所有蛋白质运动案例中涉及指定定位类别的比例。(B) 描述了不同定位类别之间在蛋白质运动方面的互连性。标有a、b、c、d的四个方框区域在图S2D中进一步分析。(C) 描述了每个主要细胞周期过渡期间的蛋白质运动图。每个节点代表一个不同的定位类别。蓝色节点的大小反映了在特定类别中定位增加的蛋白质的总数。灰色节点代表没有增加蛋白质定位的类别。箭头的粗细反映了从一个定位类别移动到另一个定位类别的独特蛋白质的数量。(D) 展示了每个细胞周期过渡期间运动蛋白质的功能富集情况(Credit: Cell)
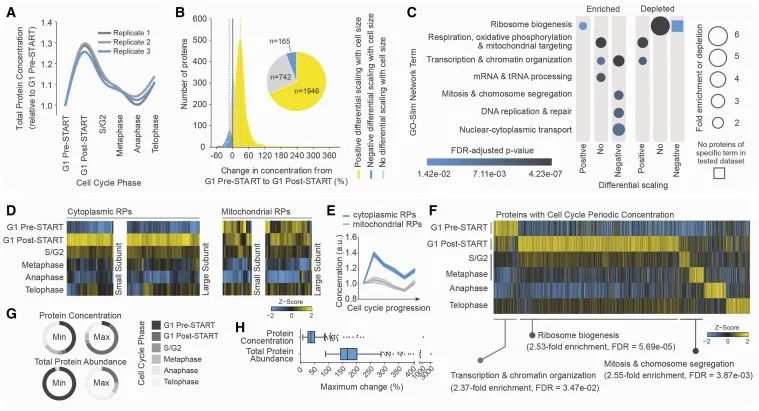
细胞周期中蛋白质浓度动态。(A) 显示了所有蛋白质(共3,806种,约占总蛋白质含量的70%)相对于G1 Pre-START的总浓度变化(以校正后的平均自发荧光GFP表示)。每个重复测量的平滑曲线分别绘制。(B) 从G1 Pre-START到G1 Post-START,2,853种GFP荧光强度至少高于背景5%的蛋白质浓度的百分比变化。根据蛋白质丰度与细胞大小的缩放关系对蛋白质进行分组。垂直虚线表示每组中的中位数变化。插图显示了在G1阶段显示正、负及无差异性缩放的蛋白质比例。(C) 图3B中蛋白质组的功能富集或削减情况。(D) 热图展示了细胞周期中细胞质(共85种)和线粒体(共58种)核糖体蛋白(RPs)的浓度动态。(E) 相对于G1 PreSTART,图(D)中蛋白质浓度的变化(平均值±标准误 [线和阴影,分别],单位如A所示)。(F) 热图显示了被识别为周期性的蛋白质的浓度动态,按照在每个细胞周期阶段之前浓度递减的顺序排列。展示了在所有指定细胞周期阶段中水平高于细胞自发荧光的蛋白质(共731种)。为G1 Pre-START、G1 Post-START和S/G2-有丝分裂期达到峰值的蛋白质提供功能富集分析。(G) 显示周期性浓度蛋白质在每个细胞周期阶段表现出的最大或最小浓度或丰度的相对比例。(H) 展示了周期性蛋白质(共545种)在细胞周期中蛋白质浓度和总蛋白质含量的最大变化(三次重复中的平均值),这些蛋白质具有允许对这些参数进行可信定量评估的特征。(Credit: Cell)
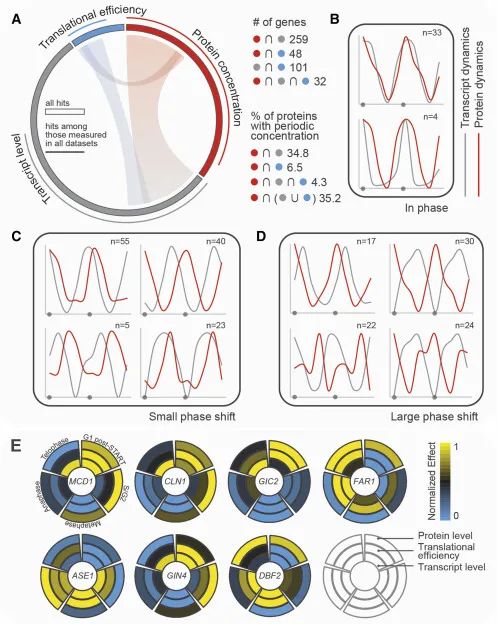
细胞周期特异性蛋白浓度动态的多层次调控,展示了细胞周期中蛋白浓度、转录水平和翻译效率三个方面的动态变化及其相互关系。(A) 部分展示了一个Circos图,这是一种用于展示数据间关系的可视化工具。图中以不同颜色表示蛋白浓度(红色)、转录水平(灰色)和翻译效率(蓝色)的数据集。每个数据集的图标大小反映了该数据集中的命中数(即检测到的特定变化的蛋白数量)。例如,蛋白浓度数据集有810个命中,而翻译效率数据集有213个命中,因此红色的图标大约是蓝色的3.8倍。图中还总结了不同数据集之间的共有命中数及蛋白浓度命中在其他数据集中的百分比。(B-D) 这些折线图展示了在不同细胞周期阶段,平均归一化的转录水平和蛋白浓度的变化。x轴表示细胞周期的进展,灰色圆圈表示G1期。为了更好地展示连续两个细胞周期的动态变化,每个分组的平均信号都呈现了两次(从G1期后期开始,一直到有丝分裂后期)。(E) 部分展示了一些特定基因的细胞周期特异性剖面,这些基因在蛋白浓度、转录水平和翻译效率上都表现出周期性变化。这包括归一化的转录水平、翻译效率和蛋白浓度数据,从而提供了对这些基因在细胞周期中如何被调控的深入了解。(Credit: Cell)
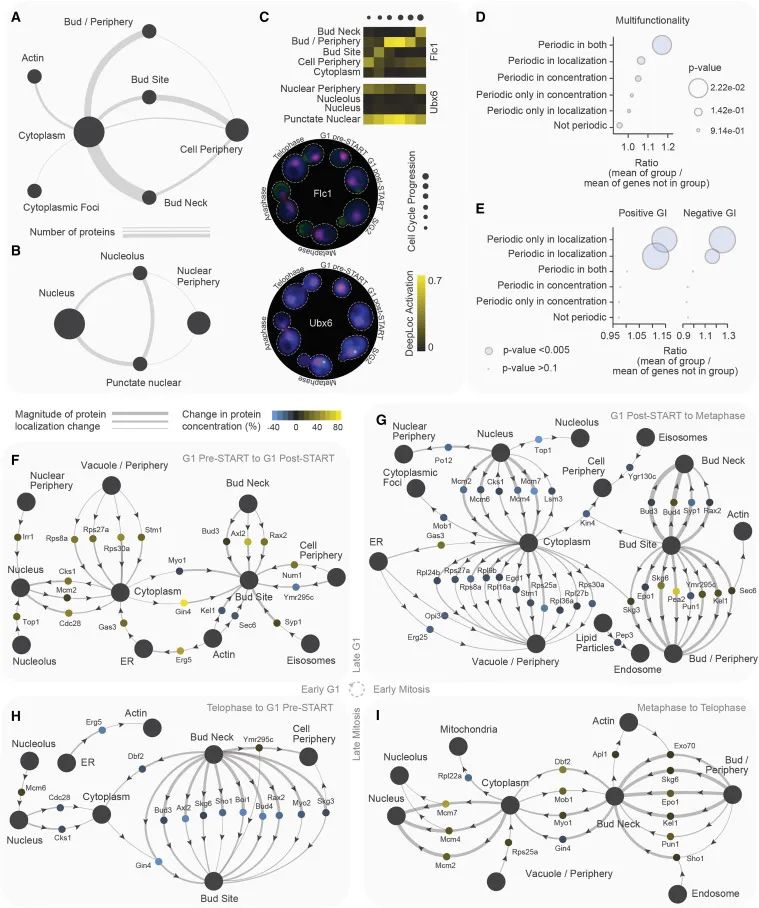
细胞周期周期性蛋白质组的时空分析,通过图示和数据呈现了细胞周期中蛋白质在空间位置和浓度上的变化。(A和B) 这两个网络图总结了蛋白质在细胞周期的任何阶段从较大区域(如细胞质或细胞核)向更局限的区域(如细胞质或核的边缘,或更狭窄的区域如细胞质或核的聚焦/小点)的移动。图中的连线粗细代表在指定的细胞器间移动的蛋白质数量。大的黑色节点代表定位类别,其大小反映了相应细胞器的物理大小。例如,大节点代表细胞质和细胞核;较小的节点代表它们的边缘;最小的节点代表其中的更局限区域,如细胞质或核的焦点/小点。(C) 展示了两个示例蛋白质(Flc1和Ubx6)的簇图横截面和显微照片,这两个蛋白质显示了细胞器内部的移动。(D和E) (D) 部分显示了具有指示的周期性模式的基因的多功能性程度;(E) 部分显示了这些基因在遗传交互中的参与程度。(F-I) 这些通量网络总结了细胞周期周期性蛋白质组。定位类别被表示为大的灰色节点。每个蛋白质由一个小节点表示,其颜色显示在特定细胞周期转换中的浓度变化。连线将每个蛋白质节点与发生变化的两个定位类别连接起来。线的粗细表示定位变化的幅度,箭头指示方向。例如,Gin4的浓度从G1前期到G1后期增加,它在细胞质的定位减少而在芽点的定位增加。这种动态分别为G1前期到G1后期(F)、G1后期到中期(G)、中期到末期(I)以及末期到G1前期(H)所展示。(Credit: Cell)
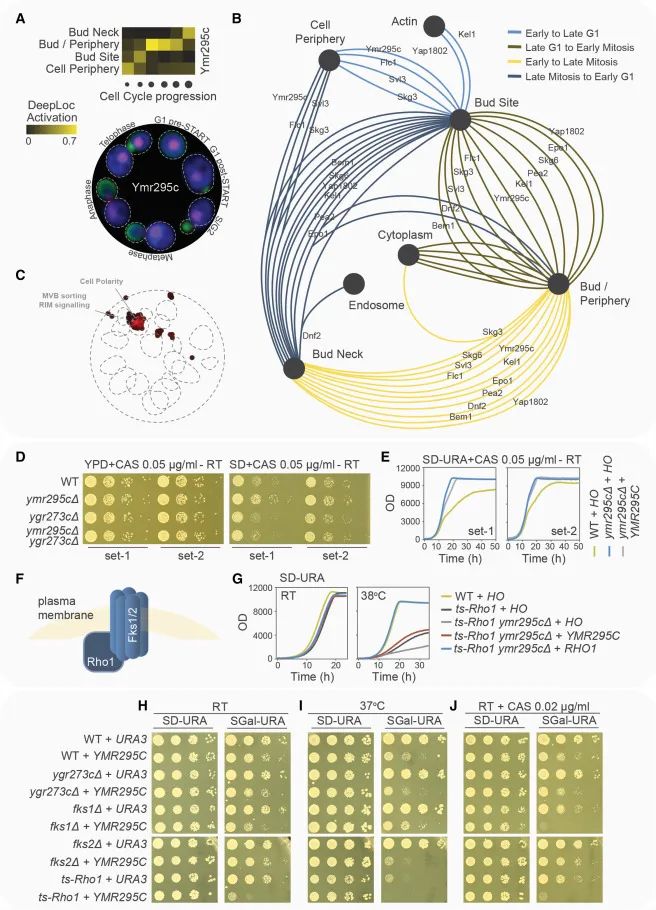
细胞周期解析的表型组学用于功能分析和探索,通过数据和图像展示了特定蛋白质在细胞周期中的行为及其功能意义。(A) 展示了Ymr295c蛋白的簇图横截面和显微照片。这部分描绘了Ymr295c在不同细胞周期阶段的空间定位变化。(B) 该地图展示了与Ymr295c有最高定位相似性的十种蛋白质在细胞周期中的特定移动。这揭示了Ymr295c可能与这些蛋白在功能或定位上有相关性。(C) 空间分析的功能富集(SAFE)分析用于探究具有与Ymr295c类似(皮尔逊相关系数≥0.5)的细胞周期特定定位轮廓的蛋白质(n = 40)。图上的虚线形状表示在酵母遗传交互(GI)全球相似性网络上富集的生物过程。(D) 在YPD和SD培养基上对指定菌株进行斑点稀释实验,考察了在卡泊芬净(CAS)存在下的生长情况。Set-1和Set-2表示起始于不同预培养的斑点(RT,室温)。(E) 在CAS存在下,采用液体培养基对野生型(WT)和ymr295cΔ细胞株进行生长实验,其中细胞表达的是HO或YMR295C,通过MoBY质粒实现。(F) 示意图展示了1,3-β-葡聚糖合成酶复合体的结构。(G) 液体培养中指定菌株的互补实验,菌株通过MoBY质粒表达HO、YMR295C或RHO1,在RT或38°C下培养。(H–J) 在RT、37°C和CAS存在下的室温,采用斑点稀释实验测试野生型和特定突变菌株,这些菌株携带了诱导型URA3或YMR295C的Gal质粒。(Credit: Cell)
Strategies
高通量活细胞成像(High-content live-cell imaging): 研究团队使用高通量活细胞成像技术收集了成百万活酵母细胞的图像,这些细胞表达了与绿色荧光蛋白(GFP)融合的蛋白质,以直观地监测蛋白质在细胞中的位置和数量。
应用卷积神经网络(Convolutional Neural Networks, CNNs): 研究人员开发了两种不同的卷积神经网络,专门用于处理大量的活细胞图像。这些网络能够自动地、准确地识别细胞周期的各个阶段,并对蛋白质的定位和浓度进行分类和量化。
-第一个网络用于细胞周期阶段的自动分类(Automated cell cycle-stage classification),基于细胞的形态特征(如细胞大小、芽孢出现的时机和大小)来确定细胞处于细胞周期的哪个阶段。
-第二个网络(DeepLoc)用于自动识别细胞内蛋白质的亚细胞定位(Subcellular localization)。
数据整合与分析(Data integration and analysis): 将单细胞成像数据与转录组(Transcriptomics)和核糖体印记(Ribosome profiling)数据结合起来,以深入理解蛋白质表达和调控的多层面机制。这种多维数据整合为揭示翻译后调控(Post-translational regulation)在细胞周期中的作用提供了宝贵的见解。
周期性评分(Periodicity scoring): 采用了多种算法来评估蛋白质在细胞周期中的周期性变化,包括de Lichtenberg方法、JTK_CYCLE、持续同源性(Persistent homology)和Lomb-Scargle方法。这些方法有助于识别具有细胞周期依赖性周期变化的蛋白质,无论是在表达量还是在亚细胞定位上。
基于Web工具的开发(Web-based tool development): 创建了一个用户友好的网络工具,允许通过酵母基因名称或它们的人类同源基因名访问和探索蛋白质的细胞周期动态数据。提高了数据的可访问性和互动性,将进一步促进了生物学发现。
Behind the Scenes
细胞周期进程中的蛋白质组动态
细胞周期对蛋白质定位与浓度的影响
细胞周期的各个阶段对蛋白质的定位与浓度有着显著的影响,这些变化对于细胞的正常功能和生命周期至关重要。蛋白质的空间分布和数量调节,不仅影响细胞分裂、DNA复制和修复等基本生命活动,还涉及到细胞对环境变化的响应和信号转导过程。
蛋白质定位的周期性变化
G1阶段:在细胞周期的G1阶段,某些蛋白质会从细胞质迁移到核内,参与DNA损伤修复和复制准备过程。例如,细胞周期抑制蛋白p53在受损DNA存在时累积于核内,激活DNA修复机制。
S阶段:在DNA复制期间,复制叉稳定性蛋白和染色体复制相关蛋白的定位发生显著变化,它们集中于复制起点,确保DNA复制的准确性和完整性。
有丝分裂期:分裂期特定的蛋白质,如纺锤体检查点蛋白,会在染色体分离前后定位于纺锤体,监控染色体的正确分配到子细胞中。
蛋白质浓度的周期性变化
周期性表达蛋白质:某些蛋白质的表达呈现明显的周期性变化,如周期蛋白和细胞周期依赖性激酶(CDKs)。这些蛋白质的浓度在细胞周期的特定阶段急剧上升,推动细胞进入下一周期阶段。
蛋白质稳定性与降解:蛋白质的稳定性和降解也受细胞周期调控。例如,周期蛋白的快速降解是有丝分裂结束和G1阶段开始的关键事件。
蛋白质修饰:磷酸化、泛素化等后翻译修饰在细胞周期中起到重要作用,通过改变蛋白质的活性、定位或稳定性,影响其浓度和功能。
综合调控机制
细胞通过复杂的调控网络,精确控制蛋白质的定位和浓度,以适应细胞周期的需要。这包括转录后调控、蛋白质降解机制以及蛋白质间的相互作用。此外,多种信号传导路径参与到细胞周期蛋白质的调控中,如p53信号通路、Wnt/β-catenin通路等,它们通过调节特定蛋白质的表达和活性,共同促进细胞周期的有序进行。
蛋白质周期性变化的全景图
在细胞周期的不同阶段,蛋白质的表达模式和活性状态呈现出显著的周期性变化。这种变化不仅是细胞周期顺利进行的基础,也是细胞适应环境变化、响应内部信号的关键机制。通过系统性地分析这些周期性变化,我们能够深入理解细胞生命活动的内在逻辑和调控网络。
蛋白质周期性变化的机制
转录调控:细胞周期特定阶段的启动因子和抑制因子,通过调控下游目标基因的转录,实现蛋白质表达的周期性变化。
翻译后修饰:包括磷酸化、泛素化等修饰方式,这些修饰不仅调节蛋白质的活性,还影响其稳定性和亚细胞定位,从而在细胞周期中发挥重要作用。
蛋白质降解:通过泛素-蛋白酶体途径或溶酶体途径,特定蛋白质在细胞周期的某一阶段被降解,以确保细胞周期的有序进行。
细胞周期各阶段蛋白质的特征变化
G1期:细胞增长相关蛋白质的表达增加,为DNA复制准备必需的物质基础。同时,细胞周期抑制蛋白如p21和p27的浓度上升,监控细胞是否准备好进入S期。
S期:DNA复制相关蛋白质,如DNA聚合酶、复制因子C和MCM复合体的表达达到高峰,确保DNA能够准确复制。
G2期:细胞检查点蛋白质的表达增加,检测DNA复制是否完整,确保细胞在进入有丝分裂前,DNA无损伤或复制错误。
M期:有丝分裂相关蛋白质,如纺锤体组装因子、染色质凝聚蛋白等表达上升,推动染色体分离和细胞分裂。
蛋白质周期性变化的功能意义
确保细胞周期的有序进行:通过精确调控蛋白质的表达和活性,保证细胞周期各阶段顺利完成,维持细胞生长和分裂的正常秩序。
响应细胞内外环境变化:细胞通过调节特定蛋白质的周期性表达,快速适应内外部环境的变化,如应对DNA损伤、营养物质的变化等。
调节细胞命运决定:细胞周期蛋白质的变化不仅影响细胞分裂,还涉及细胞分化、凋亡等生命过程,是细胞命运决定的重要因素。
蛋白质定位周期性变化举例
周期蛋白Cyclin B的定位变化
周期蛋白Cyclin B与细胞周期依赖性激酶CDK1结合,形成活性复合物,控制细胞进入有丝分裂期。在有丝分裂早期,Cyclin B主要定位在细胞核内,随着细胞周期的推进,Cyclin B逐渐累积在细胞质中。此定位的周期性变化,是通过磷酸化和去磷酸化调控实现的,关键在于确保细胞在正确的时间触发有丝分裂。
DNA修复蛋白Rad51的周期性定位
Rad51参与同源重组修复(HR),在DNA复制和修复中起着重要作用。在S期,Rad51主要在核内形成焦点,参与修复复制过程中产生的DNA双链断裂。细胞周期的其他阶段,Rad51的焦点数量显著减少,反映了其在DNA复制和修复过程中的周期性作用。
纺锤体组装检查点蛋白Mad2的动态定位
Mad2是细胞周期检查点蛋白,监控纺锤体组装和染色体附着状态,防止染色体分配不均。在有丝分裂期间,Mad2在未连接的着丝粒上累积,阻止细胞进入下一阶段,直至所有染色体正确连接至纺锤体。细胞进入有丝分裂晚期,Mad2的定位发生变化,从着丝粒移动至细胞质,参与调控细胞周期的正常进展。
细胞周期控制中的蛋白质调控机制
细胞周期的顺利进行是生命活动中最基础也是最关键的过程之一。这一过程涉及到众多蛋白质的精确调控,其中不同蛋白质的表达、降解、定位以及活性变化,共同保证了细胞周期的有序进行。
蛋白质的周期性表达与降解
细胞周期的各个阶段都伴随着特定蛋白质的周期性表达。例如,周期蛋白(Cyclins)及其依赖的激酶(CDKs)是细胞周期进程中最核心的调控因子。它们的活性通过蛋白质的合成与降解来精确调控,从而触发细胞周期的各个阶段。在G1期,Cyclin D的累积触发细胞准备进入S期;而到了有丝分裂期,Cyclin B的降解标志着周期的完成,为新的周期做好准备。
蛋白质的定位变化
除了蛋白质的表达量外,其在细胞内的定位变化也是调控细胞周期的重要机制。例如,核糖体蛋白质的定位变化对于细胞从G2期过渡到有丝分裂期至关重要。通过精确控制蛋白质在细胞内的位置,细胞能够确保正确的蛋白质在适当的时间和地点发挥作用。
蛋白质活性的调节
蛋白质的活性调节是细胞周期控制中另一个关键层面。通过磷酸化、去磷酸化等后翻译修饰,细胞能够快速调整蛋白质的活性。例如,CDKs的激酶活性受到周期蛋白结合以及磷酸化状态的调节,这种调节机制确保了细胞周期的正确进展。
蛋白质间的相互作用
蛋白质间的相互作用是细胞周期调控网络中不可或缺的一环。通过蛋白质复合体的形成,细胞实现了对周期事件的精确控制。例如,E3泛素连接酶的活性依赖于其与特定底物的结合,这一过程关键于调控蛋白质的降解,影响细胞周期的进程。
高分辨率空间-时间蛋白质组图谱的构建
利用卷积神经网络分析静态活细胞图像
随着生物信息学和计算生物学的迅速发展,尤其是深度学习技术在生物医学图像分析领域的广泛应用,卷积神经网络(CNN)已成为分析静态活细胞图像的强大工具。通过这一技术,研究人员能够更精确地理解蛋白质在细胞周期进程中的动态变化及其定位信息,为细胞生物学的研究提供了前所未有的视角。
CNN在细胞图像分析中的应用
卷积神经网络通过学习大量细胞图像数据,能够自动识别并分析蛋白质在不同细胞周期阶段中的定位模式。这种方法不仅提高了分析的效率和准确性,也能够揭示微妙的、肉眼难以察觉的细胞状态变化。
蛋白质定位的自动识别与分类
利用CNN,研究人员可以自动识别蛋白质在细胞内的特定定位,并将其分类。这一过程通过训练网络识别不同的亚细胞结构(如细胞核、线粒体、内质网等)中的蛋白质累积来实现。该技术的应用极大地促进了对蛋白质功能及其在细胞生理状态中作用的理解。
动态变化的捕捉
更进一步,CNN不仅能够识别静态图像中的蛋白质定位,还能分析时间序列图像,捕捉蛋白质在细胞周期进程中的动态变化。这种能力使研究人员能够观察到蛋白质如何响应细胞周期的不同阶段,以及这些变化对细胞功能的影响。
尽管CNN在细胞图像分析中展现了巨大潜力,但仍面临一些挑战,如训练数据的质量和数量、网络结构的优化以及解释性问题。未来的研究将需要解决这些问题,进一步提高分析的准确性和效率。此外,随着技术的不断进步,将CNN与其他生物信息学工具和技术相结合,如单细胞测序和蛋白质组学分析,将为细胞周期研究开辟新的路径。
蛋白质亚细胞定位的分类与周期性变化
在细胞生物学的研究中,了解蛋白质在细胞内不同位置的分布及其变化是至关重要的。蛋白质的亚细胞定位不仅反映了其功能状态,还与细胞周期进程紧密相关。随着科技的进步,特别是高分辨率成像技术与生物信息学分析方法的结合,研究人员现在能够更精确地分类和监测蛋白质在细胞周期不同阶段的亚细胞定位及其周期性变化。
蛋白质亚细胞定位的重要性
蛋白质的功能依赖于其在细胞内的准确定位。例如,某些蛋白质仅在细胞核内活跃,而有的则在细胞膜附近发挥作用。这种分布特性不仅指示了蛋白质的功能,还涉及到蛋白质如何响应或调控细胞周期的变化。
分类方法的进展
随着深度学习等计算技术的发展,现在研究人员能够通过自动化的方法对蛋白质的亚细胞定位进行更为精细的分类。这些方法通常基于成像数据,通过识别蛋白质在细胞内不同结构上的分布模式来实现。这不仅提高了分类的精度,也为大规模的蛋白质定位研究提供了可能。
蛋白质定位的周期性变化
在细胞周期的不同阶段,蛋白质的定位可能会发生变化,反映出其功能的动态调整。通过监测这些变化,研究人员可以揭示蛋白质如何参与调控细胞周期进程,例如,某些蛋白质可能在细胞分裂时从细胞质迁移到细胞核,参与调控基因表达。
监测方法的发展
高通量成像技术结合自动化图像分析已成为监测蛋白质周期性定位变化的重要手段。这些技术能够连续跟踪单个细胞内蛋白质的定位,捕捉其在细胞周期中的动态变化。此外,结合单细胞测序等技术,研究人员能够从分子水平理解这些变化背后的调控机制。
蛋白质浓度变化与细胞周期的关系
细胞周期的精确调控是细胞生命活动的基石之一,蛋白质的浓度变化在这一过程中扮演着关键角色。随着细胞周期的进展,不同阶段对特定蛋白质的需求量会发生显著变化,这种动态的蛋白质浓度调整是细胞能够顺利完成生长、DNA复制、分裂等一系列复杂活动的前提。
蛋白质浓度的周期性调节机制
细胞周期中的蛋白质浓度调节涉及多个层面的机制,包括基因表达的调控、蛋白质的合成与降解以及分子间的相互作用等。这些机制共同作用,确保了蛋白质在细胞周期各个特定阶段以正确的浓度存在,从而促进细胞周期的有序进行。
基因表达调控:通过转录因子和增强子等元件,细胞能够在不同周期阶段精准调控特定蛋白质基因的表达。
蛋白质合成与降解:蛋白质的生物合成及其通过泛素-蛋白酶体系统的降解在维持蛋白质浓度方面起着关键作用。
分子间相互作用:蛋白质之间的相互作用,如形成复合体或通过信号传导途径互作,也会影响蛋白质的稳态浓度。
蛋白质浓度与细胞周期控制的关系
在细胞周期的控制中,某些关键蛋白质的浓度变化尤为重要。例如,周期蛋白(Cyclins)和周期蛋白依赖性激酶(CDKs)的浓度变化直接影响细胞周期的推进。周期蛋白的浓度在细胞周期的不同阶段呈周期性变化,其与CDKs结合,激活或抑制CDKs的活性,从而推动细胞周期的前进或停滞。
G1阶段:在此阶段,细胞对环境进行评估,决定是否进入S阶段。相关蛋白质的浓度调整为细胞提供了必要的信号。
S阶段:DNA复制发生在此阶段,对DNA复制和修复蛋白质的需求量显著增加。
有丝分裂阶段:此阶段需要大量的细胞骨架蛋白和动力蛋白以支持染色体的分离和细胞的分裂。
随着技术的发展,特别是质谱、流式细胞术、高通量测序等方法的应用,研究人员现在能够更精确地测定细胞内蛋白质的浓度,以及在细胞周期不同阶段蛋白质浓度的变化。这些技术的进步不仅加深了我们对细胞周期调控机制的理解,也为发现新的药物靶点提供了可能。
基于Web的蛋白质组数据访问工具
在现代生物医学研究中,蛋白质组学数据的获取与分析是理解细胞生理状态变化的关键步骤。特别是在细胞周期研究领域,准确地追踪和分析蛋白质的动态变化对揭示其生物学功能至关重要。随着科技的进步,基于Web的蛋白质组数据访问工具为科研人员提供了强大的数据处理能力,大大提高了研究的效率和深度。
蛋白质组数据库与分析平台
蛋白质组数据库:多个公共和私有数据库为研究者提供了丰富的蛋白质组学数据,包括但不限于UniProt、ProteomeXchange和PeptideAtlas。这些数据库收录了从不同细胞类型、不同生物种和不同细胞周期阶段收集的蛋白质组数据。
分析平台:基于Web的蛋白质组分析平台,如MaxQuant、Skyline以及Proteome Discoverer等,提供了强大的数据分析工具,支持蛋白质鉴定、定量分析和数据可视化等功能。
功能特点与应用
这些工具的功能特点包括:
用户友好的界面:即使是非程序员的生物学家也可以轻松地上传数据、进行分析和获取结果。
高度可定制的分析流程:用户可以根据自己的研究需要选择不同的算法和分析路径。
云存储与计算:基于Web的工具允许用户访问海量的存储空间和计算资源,无需在本地计算机上安装复杂的软件。
数据共享与合作:研究人员可以轻松地与全球的同行分享数据和分析结果,促进科研合作。
对细胞周期研究的影响
在细胞周期研究中,基于Web的蛋白质组数据访问工具使得研究者能够:
追踪细胞周期特定阶段的蛋白质表达变化:这对于理解蛋白质如何调控细胞周期进程至关重要。
识别与细胞周期调控相关的关键蛋白质:通过比较不同细胞周期阶段的蛋白质组数据,研究者可以发现潜在的调控因子。
探究蛋白质功能:结合其他生物信息学工具,研究者可以深入理解这些蛋白质在细胞周期调控中的具体作用。
蛋白质定位与浓度调控的细胞周期阶段特异性
G1阶段的蛋白质组特征
在细胞周期的G1阶段,细胞准备进行DNA复制之前的一系列准备活动。这一阶段的蛋白质组特征尤其重要,因为它们调节细胞是否进入S阶段(DNA合成阶段),并影响细胞生长、分化及其后续的细胞周期过程。基于细胞周期对蛋白质功能的严格需求,G1阶段的蛋白质组表现出独特的动态变化和调控机制。
G1阶段蛋白质的关键功能
细胞周期调控因子:周期蛋白D和E型以及它们的激酶伙伴CDK4和CDK6在G1阶段起到关键作用,它们的活性变化直接决定了细胞是否继续向S阶段推进。
生长因子信号传导:细胞在G1阶段响应外界生长因子的信号,通过MAPK和PI3K等信号通路,调节蛋白质合成和细胞生长。
细胞应激反应:在G1阶段,细胞通过p53和其他应激响应蛋白监控DNA损伤和营养状态,确保细胞在合适的条件下进行分裂。
G1阶段蛋白质表达的周期性变化
G1阶段蛋白质组的周期性变化是通过精细调控的转录和翻译机制实现的。例如,周期蛋白D的表达受到生长因子刺激和营养状态的影响,而其降解则是通过泛素-蛋白酶体途径调控的。这种动态平衡确保了细胞在适当的时间准备进入S阶段。
DNA复制过程中的蛋白质动态
DNA复制是细胞周期中至关重要的一环,确保遗传信息的准确复制和传递。在这一过程中,蛋白质的动态调控起到核心作用,包括复制起始点的识别、复制叉的形成、以及DNA链的延伸。
复制起始点的蛋白质调控
起始复合物的形成:复制的第一步是在DNA上识别起始点并形成起始复合物。此过程涉及多种蛋白质,如ORC(起始识别复合物)、Cdc6、Cdt1以及MCM复合物。
蛋白质的活性调控:Cdk和Ddk激酶对MCM复合物进行磷酸化,促进复制叉的形成和启动。这一步骤在细胞周期中受到严格的时间控制,确保DNA复制只在S阶段发生。
复制叉的动态蛋白质网络
复制叉的稳定性和延伸:DNA聚合酶、滑动夹子PCNA以及RFC复合物在复制叉的稳定性和连续延伸中起核心作用。同时,解旋酶如MCM2-7复合物负责解开DNA双螺旋,为复制提供单链模板。
应对复制压力:当DNA复制遇到障碍时,Rad17、ATR、Chk1等蛋白质介导的应激响应被激活,以保护复制叉并修复损伤。
复制完成后的蛋白质变化
终止复制的机制:一旦DNA复制完成,需要去除与DNA复制相关的蛋白质,以及重置复制起始点。此过程涉及到多种蛋白酶和泛素化反应,如Cdc20和APC/C的活化。
确保复制完整性的机制:复制完成后,细胞利用Mismatch Repair(MMR)和Homologous Recombination(HR)等机制,检查和修复可能出现的复制错误,确保DNA复制的准确性和完整性。
有丝分裂阶段的蛋白质组变化
有丝分裂是细胞周期中至关重要的一个阶段,涉及到一系列精密调控的蛋白质动态变化,以确保染色体正确分离并平等地分配给两个子细胞。
有丝分裂的启动
促进有丝分裂复合物(CPC)的激活:有丝分裂的启动首先需要CPC的激活,其中包括Aurora B激酶和其伴侣蛋白,它们对细胞骨架和染色体凝聚蛋白进行磷酸化,为染色体准备进行正确分离打下基础。
SPB和动态微管的重组:细胞极体(SPB)的复制和分离,以及动态微管的快速重组,为染色体分离和细胞质分裂提供物理基础。
染色体的准确分离
凝聚素复合体的解除:有丝分裂进入中期,凝聚素复合体被逐步降解,使得姐妹染色体能够分离。
分离酶的作用:分离酶Securin的降解释放活化的分离酶Separase,后者切割凝聚素,触发染色体的分离。
细胞质分裂与蛋白质变化
收缩环的形成与作用:在细胞中部形成的肌动蛋白和肌球蛋白构成的收缩环,在有丝分裂末期通过收缩作用导致细胞质分裂。
蛋白质降解与重塑:随着细胞进入下一个周期,需要对有丝分裂相关蛋白进行降解和重塑,以保证细胞周期的正确进行。这一过程涉及泛素-蛋白酶体系统的广泛参与。
细胞周期退出与复位的蛋白质组特性
细胞周期的退出与复位是生物细胞精确控制生长、分裂和死亡的关键环节。在这一过程中,蛋白质组的动态变化起着至关重要的作用。
细胞周期退出的调控机制
周期依赖性激酶抑制因子的作用:细胞周期的退出通常伴随着周期依赖性激酶(CDK)活性的下降。CDK抑制因子(如p21、p27和p57)的表达增加,是导致CDK活性下降的主要机制之一,从而推动细胞退出分裂周期。
E3泛素连接酶的角色:特定的E3泛素连接酶如Skp2和Anaphase Promoting Complex/Cyclosome (APC/C)在蛋白质降解中发挥关键作用,它们标记特定的周期性蛋白质进行泛素化,促进其降解,进一步促进细胞周期的退出。
细胞复位与再次进入周期的准备
细胞复位机制的重要性:细胞在特定条件下可重新进入细胞周期。这需要蛋白质组复位,包括降解已经激活的蛋白质,重新积累周期进程初期所需的蛋白质。
转录调控因子的作用:如E2F家族,其活性在细胞周期退出与复位过程中经历动态变化,控制着与细胞周期进程相关的基因表达。
生物医学意义
疾病治疗:了解细胞周期退出与复位的蛋白质组特性,对于癌症治疗尤其重要。许多肿瘤抑制蛋白(如p53和Rb蛋白)通过调节细胞周期退出来抑制肿瘤生长。因此,针对这些蛋白质路径的靶向治疗策略具有潜在的临床价值。
组织再生与修复:细胞周期的有效控制是组织再生和修复的基础。通过调节细胞周期退出与复位的蛋白质组特性,可能促进受损组织的恢复,为再生医学提供新的研究方向。
细胞周期进程中的蛋白质组-亚细胞器连接性
蛋白质组动态揭示的细胞内通讯
在细胞生命活动中,蛋白质组的动态变化不仅反映了细胞自身状态的变化,更是细胞内外通讯的重要媒介。
蛋白质组与信号传递
信号传递途径:细胞内通讯依赖于信号传递途径,其中蛋白质如激酶、磷酸酶和转录因子等扮演着关键角色。这些蛋白质的活性和定位变化直接影响信号传递途径的激活或抑制,从而调控细胞行为。
蛋白质修饰:磷酸化、泛素化等蛋白质后修饰是细胞内通讯的重要机制。这些修饰影响蛋白质的稳定性、活性及亚细胞定位,进而影响细胞信号传递的效率和特异性。
细胞周期中的蛋白质组动态
周期性变化:在细胞周期的不同阶段,特定蛋白质的表达水平和活性发生周期性变化,如周期蛋白和CDK激酶。这些变化对于细胞周期的精确调控至关重要。
细胞应答:细胞对外界信号的响应,如生长因子、应激信号等,通过调节蛋白质组的组成来实现。这些响应确保细胞在适当的环境条件下进入下一细胞周期阶段。
蛋白质组在细胞内通讯中的作用
信息集成中心:蛋白质组不仅作为信号的发出者和接收者,还充当信息集成中心,将不同信号途径的信息汇聚,以产生协同或拮抗的效应,从而细致调控细胞行为。
调节细胞行为:通过调节细胞周期进程、细胞分化、细胞迁移等,蛋白质组动态变化在细胞内通讯中扮演着核心角色。例如,细胞周期进程中蛋白质的定时表达和降解是细胞能够按需增殖或暂停增殖的基础。
特定蛋白质在细胞周期不同阶段的局部化变化
细胞周期的精确调控依赖于蛋白质的周期性表达及其在细胞内的精确定位。
蛋白质局部化的周期性变化
G1阶段:在G1阶段,细胞大小和营养状况的监测依赖于位于细胞膜和细胞质的信号分子。例如,生长因子受体在细胞膜上的集聚是细胞进入下一周期的前提条件。
S阶段:DNA复制期间,复制叉附近特定的蛋白质如PCNA(增殖细胞核抗原)的集中,确保了DNA复制的精确性和效率。
G2阶段:在G2阶段,细胞检查DNA复制是否完整,此时DNA修复蛋白的定位变化对于维持基因组稳定性至关重要。
M阶段:有丝分裂期间,染色体凝聚蛋白、动态丝蛋白等的特定定位对于姐妹染色体的正确分离和细胞器的分配至关重要。
蛋白质定位变化的调控机制
蛋白质修饰:磷酸化、泛素化等后修饰影响蛋白质与其他分子的相互作用,进而改变其在细胞内的定位。
信号传递网络:细胞内多条信号传递途径参与调控蛋白质的定位,如MAPK信号通路在调节细胞应对环境压力时,会影响多种蛋白质的定位。
细胞骨架的动态变化:细胞骨架的重组也是调节蛋白质定位的重要机制,尤其是在细胞迁移和细胞分裂过程中。
局部化变化对细胞周期的影响
细胞周期的推进:特定蛋白质在细胞周期不同阶段的局部化变化是细胞周期推进的重要机制之一,如周期素依赖性激酶的激活和抑制。
细胞应答与调控:通过局部化变化,蛋白质能够在细胞内形成临时的信号复合体,快速响应外界信号,调节细胞生理状态。
蛋白质周期性局部化变化的功能意义
在细胞周期进程中,蛋白质周期性局部化变化不仅是一种普遍现象,也承担着重要的生物学功能。这些变化使得蛋白质能够在特定的时空环境中发挥作用,对细胞的生命活动和细胞周期的顺利进行至关重要。
确保细胞周期的有序进行:通过在特定阶段精确调控蛋白质的局部化,细胞能够保证各个周期事件发生的顺序性和准确性,避免不必要的错误。
调节细胞生理状态:蛋白质的局部化变化影响其活性和功能,从而调节细胞的生理状态,如细胞分化、增殖和程序性细胞死亡。
参与信号传递:蛋白质在特定细胞区域的集中,如细胞膜上的受体聚集,能够有效地传递外部信号,启动细胞内的应答机制。
维持细胞架构稳定性:结构蛋白在细胞骨架和细胞器定位的变化,对于维持细胞形态和内部架构的稳定性具有重要作用。
具体实例
核糖体蛋白的核质转运:在细胞周期的G1阶段,核糖体蛋白从核内向细胞质转运,参与蛋白质合成,为DNA复制提供物质基础。
周期蛋白及其激酶的核定位信号(NLS)的变化:周期蛋白依赖性激酶(CDK)在细胞周期的不同阶段通过NLS的掩盖或暴露,实现核内外的定位转变,精确调控细胞周期。
细胞分裂时期的染色体定位:在有丝分裂期间,染色体通过与纺锤体的动态相互作用确保等分到两个子细胞中,此过程依赖于蛋白质在特定时期的正确定位。
研究的主要发现与意义
主要发现
蛋白质周期性表达与调控: 该研究首次绘制了细胞周期中蛋白质表达的全面图谱,揭示了关键蛋白质如何在不同细胞周期阶段通过量的变化和定位的改变来实现精准调控。
细胞周期阶段间的蛋白质互动:研究突破性地揭示了细胞周期不同阶段间蛋白质的相互作用和转移路径,对理解细胞生命活动的内在机制提供了新视角。
高通量成像技术在蛋白质组学中的应用: 利用先进的成像技术,该研究实现了对细胞内蛋白质动态的高分辨率观察,为蛋白质组学研究提供了强有力的技术支持。
科学意义
对基础生物学的贡献: 该研究深化了我们对细胞周期调控机制的理解,为解答生命科学中的基本问题提供了关键线索。
疾病治疗的潜在应用:细胞周期的异常调控与多种疾病密切相关,特别是癌症。该研究中发现的关键蛋白质和调控路径可能成为未来治疗策略的新靶点。
激发未来研究:通过提供全面的数据集和新的分析方法,该研究为细胞周期的深入研究铺平了道路,同时也为相关领域的研究者提供了宝贵的资源。
对细胞周期蛋白质组学未来发展的展望
细胞周期蛋白质组学的未来发展蕴藏着巨大的潜力和挑战。随着技术的进步,我们预期将在以下几个方向实现重大突破:
深度集成分析:结合转录组学、蛋白质组学和代谢组学数据,实现细胞周期调控网络的更全面理解。
单细胞分析技术的应用:通过高精度单细胞分析,揭示细胞周期内部差异性和细胞间异质性,为个性化医疗提供依据。
动态蛋白质组学: 利用实时成像和动态标记技术,捕捉细胞周期中蛋白质的瞬时动态和互作关系。
数据处理和可视化:发展先进的数据处理算法和交互式可视化工具,以更直观地呈现复杂的蛋白质组数据。
Q&A
细胞周期中不同阶段的关键蛋白质有哪些?
细胞周期的每个阶段都由特定的关键蛋白质组合控制。在G1期,蛋白质如Cyclin D和CDK4/6起主导作用,负责细胞生长和准备DNA复制。进入S期,Cyclin E和CDK2则促进DNA复制的开始。G2期则由Cyclin A和CDK2控制,它们确保DNA复制的完整性。最后,在M期,Cyclin B和CDK1组合调控细胞的分裂过程。
如何利用高通量成像技术研究蛋白质定位的周期性变化?
高通量成像技术是研究蛋白质定位变化的强大工具。这一技术结合了荧光显微镜和自动化图像分析,能够实时监测和记录细胞内特定蛋白质的位置变化。通过使用具有荧光标记的蛋白质,可以精确观察这些蛋白质在细胞周期不同阶段的动态定位。此外,结合定量分析软件,研究人员能够对大量细胞进行定量测量,从而获得统计意义上的定位变化数据。
蛋白质组动态如何影响细胞周期的正常进行?
蛋白质组动态在维持细胞周期的正常进行中起着至关重要的作用。各种蛋白质的周期性表达、激活和降解是控制细胞周期阶段转换的关键因素。例如,在DNA复制的S期,需要特定蛋白质的集合来确保DNA复制的准确性;而在M期,不同的蛋白质组合则促进染色体的准确分配和细胞的分裂。因此,蛋白质组的动态调整对于细胞周期的每个阶段都是必不可少的。
细胞周期的调控在疾病治疗中的潜在应用是什么?
细胞周期的调控在疾病治疗中具有巨大的潜在应用价值。例如,在癌症治疗中,针对特定的细胞周期蛋白质(如CDK抑制剂)的药物可以抑制癌细胞的生长和增殖。此外,通过了解细胞周期蛋白质的动态变化,可以更好地理解疾病的发病机制,从而开发出更为精准的治疗策略。
酵母细胞周期的研究对理解人类细胞周期有哪些帮助?
酵母作为一种模型生物,在研究细胞周期方面提供了许多重要的见解。酵母细胞的基本细胞周期调控机制与人类细胞非常相似,因此通过研究酵母细胞周期中的关键蛋白质和调控途径,可以帮助我们更好地理解人类细胞周期的调控机制。这些研究为治疗相关疾病(如癌症)提供了宝贵的基础知识。
参考文献
https://doi.org/10.1016/j.cell.2024.02.014
Litsios A, Grys BT, Kraus OZ, et al. Proteome-scale movements and compartment connectivity during the eukaryotic cell cycle. Cell. Published online March 1, 2024. doi:10.1016/j.cell.2024.02.014
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#细胞周期# #细胞生物学# #酵母细胞# #蛋白质组动态变化图谱#
79