85.7%的PTEN胚系突变女性罹患乳腺癌,具有怎样的临床病理和分子特征?
刚刚 苏州绘真医学 苏州绘真医学 发表于陕西省
本研究的优势包括对这些女性乳腺癌患病情况独特的长期观察。遗憾的是,由于研究的时间跨度长,大多数病例的原始玻片和组织蜡块无法无法获取以供审查。本文提供的数据基于原始病理报告。
PTEN 错构瘤瘤综合征(PHTS)是一种常染色体显性遗传性癌症综合征,主要由 PTEN 胚系致病性变异引起。女性携带者一生中患乳腺癌的风险高达 80%。PHTS 相关乳腺癌的病理特征很少报道。通过我们州所有组织病理实验室与家族性癌症服务机构的合作,我们追踪了 12 例已知携带 PTEN 致病性或可能致病性(P/LP)变异的女性的乳腺活检(1990 年 1 月至 2018 年 1 月)。维多利亚州癌症遗传学部门又补充了2例病例。在14例病例中,有12例(85.7%)确诊乳腺癌,包括浸润性癌或导管原位癌(DCIS)。1 例有 PHTS 家族史,6 例有乳腺癌家族史。首次确诊乳腺癌的平均年龄为 41.6 岁(范围 27-63)。6 例发生不止一个乳腺癌。5 例(42%)发生对侧乳腺癌。12 个浸润性癌中有 10 个为非特殊类型,2 个为小叶癌,所有均非 1 级。报告时,所有癌症均为激素受体阳性和 HER2 阴性。所有均与 DCIS 相关。DCIS 涵盖所有级别。2 例无乳腺癌病例仍因大量良性改变(包括乳头状瘤、纤维腺瘤样改变、旺炽性导管上皮增生、腺病和基质纤维化)需要手术治疗。我们注意到,携带PTEN P/LP变异的个体所患乳腺癌的形态和受体特征并不独特。与普遍观点相反,这些癌症不符合当代大汗腺乳腺癌的定义。医疗专业人员更熟悉 PHTS 的整体临床和病理发现以及经过验证的克利夫兰诊所 PTEN 计算器将提高对 PHTS 相关乳腺癌女性个体的识别。及早识别其癌症易感综合征将使这些面临多种癌症高风险的患者及其家属受益。
研究背景
Cowden 综合征,现在称为 PTEN 错构瘤综合征(PHTS),是一种常染色体显性遗传性癌症综合征,导致女性罹患乳腺癌、甲状腺癌、肾透明细胞癌、子宫内膜癌和结直肠癌以及黑色素瘤的风险增加。
PHTS与10号染色体上缺失的磷酸酶和张力蛋白同源物(PTEN)基因的致病性或可能致病性(P/LP)变异有关。PTEN 编码一种具有肿瘤抑制功能的蛋白质,该蛋白质参与 PI3K/AKT/mTOR 通路。致病性变异会解除对该通路的抑制作用,导致细胞增殖和存活增加以及肿瘤发生。
具有 PTEN P/LP 变异的女性终生患乳腺癌的风险为 80%,但由于未知原因,男性患乳腺癌的风险并未持续增加。有研究报道了携带 PTEN 致病性变异的男性患乳腺癌,但克利夫兰诊所的研究小组在对PHTS的详细综述中指出,包括他们自己对3000多例患者的研究,并未确立男性乳腺癌总体风险增加。梅奥诊所的一项研究纳入了211例Cowden综合征患者,包括75例男性,发现70%的女性有癌症诊断,而这一比例在男性中只有45%,而且男性的恶性肿瘤大多不是通常与Cowden综合征相关的那些。女性乳腺癌是PHTS的主要诊断标准之一,然而PHTS相关乳腺癌的病理特征鲜有报道。
最近,我们与我们州成人遗传学部门(AGU)的家族癌症服务机构合作,对12例已知携带PTEN P/LP变异的女性进行了一项28年纵向临床病理研究(提交同行评审)。我们的12例南澳大利亚患者中有10例患上乳腺癌,包括浸润性癌和导管原位癌(DCIS)。再加上维多利亚遗传学服务机构提供的另外2例已知携带PTEN P/LP变异的病例,我们现在展示PHTS背景下乳腺癌的详细病理特征和受体谱。
研究结果
本研究队列包括 14 例携带 PTEN 胚系 P/LP 变异的女性。
基因检测
识别的具体 P/LP PTEN 变异如表 1 所示。
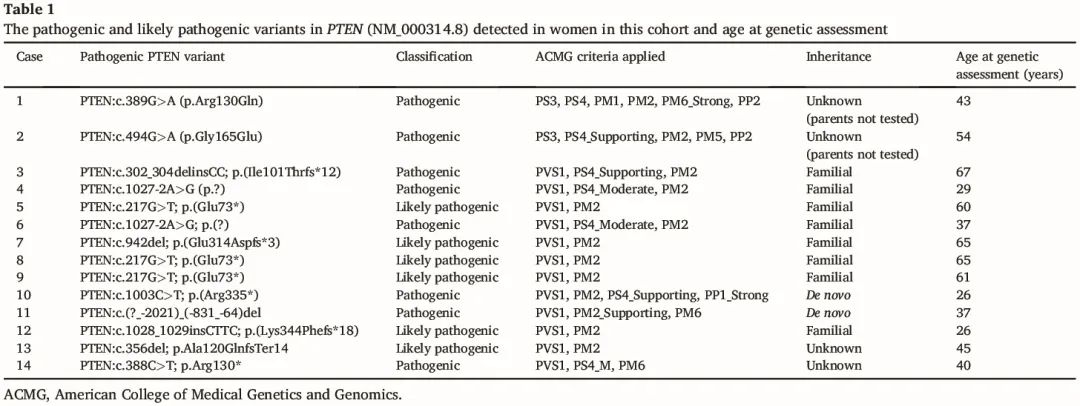
表1
乳腺活检病理结果
14 例女性中有 12 例确诊浸润性乳腺癌或 DCIS。其余 2 例需要手术治疗良性乳腺疾病。6 例有乳腺癌家族史,其中只有 1 例已知有 Cowden 综合征/PHTS 家族史。首次确诊乳腺癌(浸润性或 DCIS)的平均年龄为 41.6 岁(范围 27-63 岁)。只有一例在 20 多岁时首次确诊乳腺癌。总体而言,4 例在 40 岁之前,6 例在 40 多岁时,2 例在 ≥50 岁时首次确诊乳腺癌。
每个个体的乳腺癌时间线如图 1 所示。8 例女性发生不止一个乳腺癌,2 例为同时性,5 例在 3-11 年后再次发生。这 8 例女性中有 2 例发生双侧同时性恶性肿瘤,包括 1 例在 32 岁时发生双侧 DCIS,另一例在 34 岁时发生双侧浸润性癌。1 例女性在 27 岁时患上浸润性乳腺癌,在 30 岁时患上对侧 DCIS,伴有小浸润性成分。2 例先一个乳房发生 DCIS,9 年和 11 年后另一侧乳房发生两个浸润性癌。最后,2 例先发生浸润性癌,1 年和 11 年后另一侧乳房诊断为 DCIS。
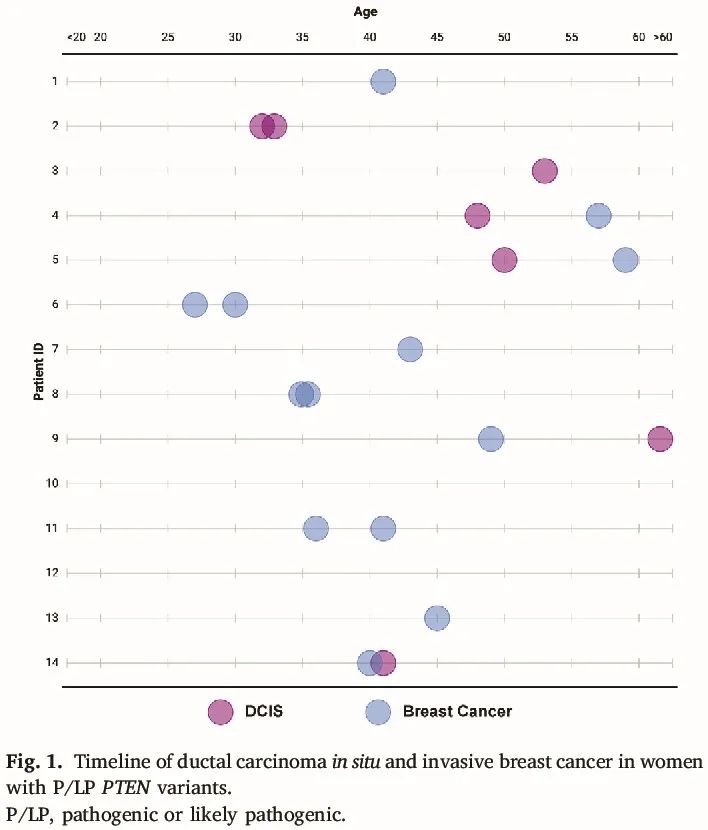
图1
所有 12 个浸润性癌的数据可及,这些浸润性癌发生于 9 例女性。浸润性乳腺癌的组织学发现总结在表 2 中,DCIS 诊断总结在表 3 中。浸润性肿瘤大小范围为 3-90 mm。10 个为浸润性乳腺癌,非特殊类型。2 个被归类为浸润性小叶癌,但我们注意到 1 个保留了 E-钙粘蛋白表达。4 个癌症为 3 级,6 个为 2 级,2 个分级未知。明确或可能的淋巴血管浸润见于 5 个病灶,未见于 7 个病灶。在一些病例中,透明化结节或致密的纤维化病灶与浸润性癌有关。图 2-5 展示了我们系列中浸润性乳腺癌和 DCIS 的形态。
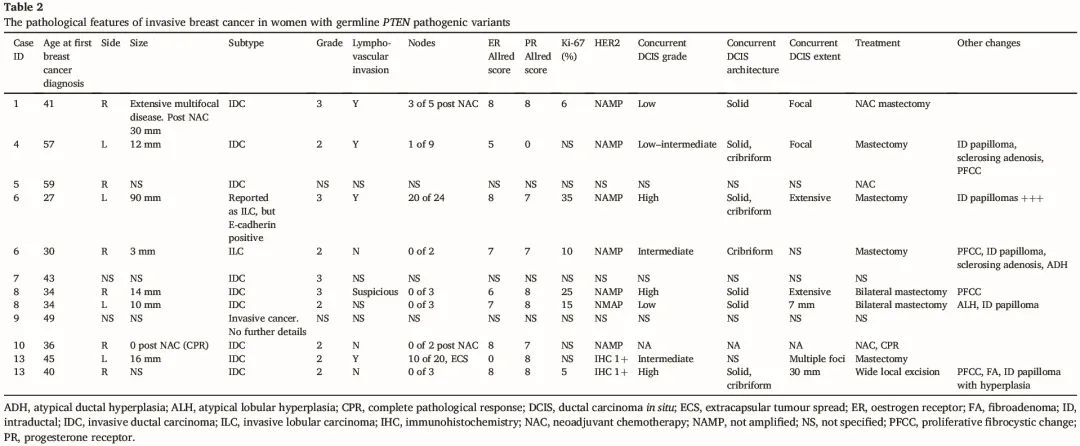
表2
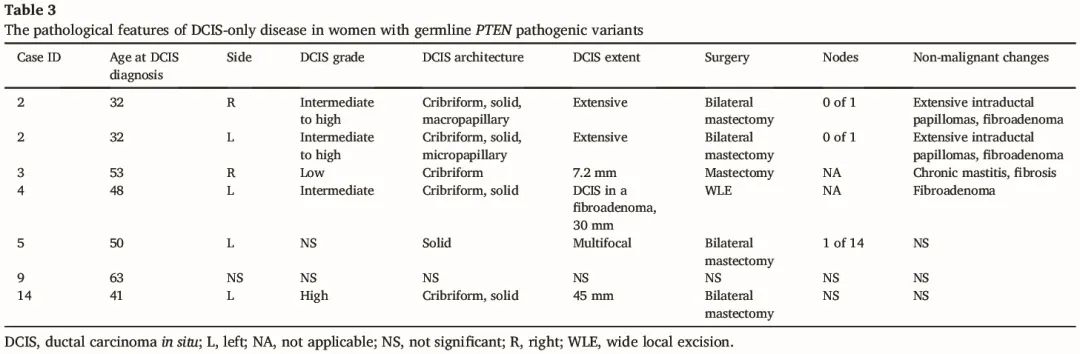
表3
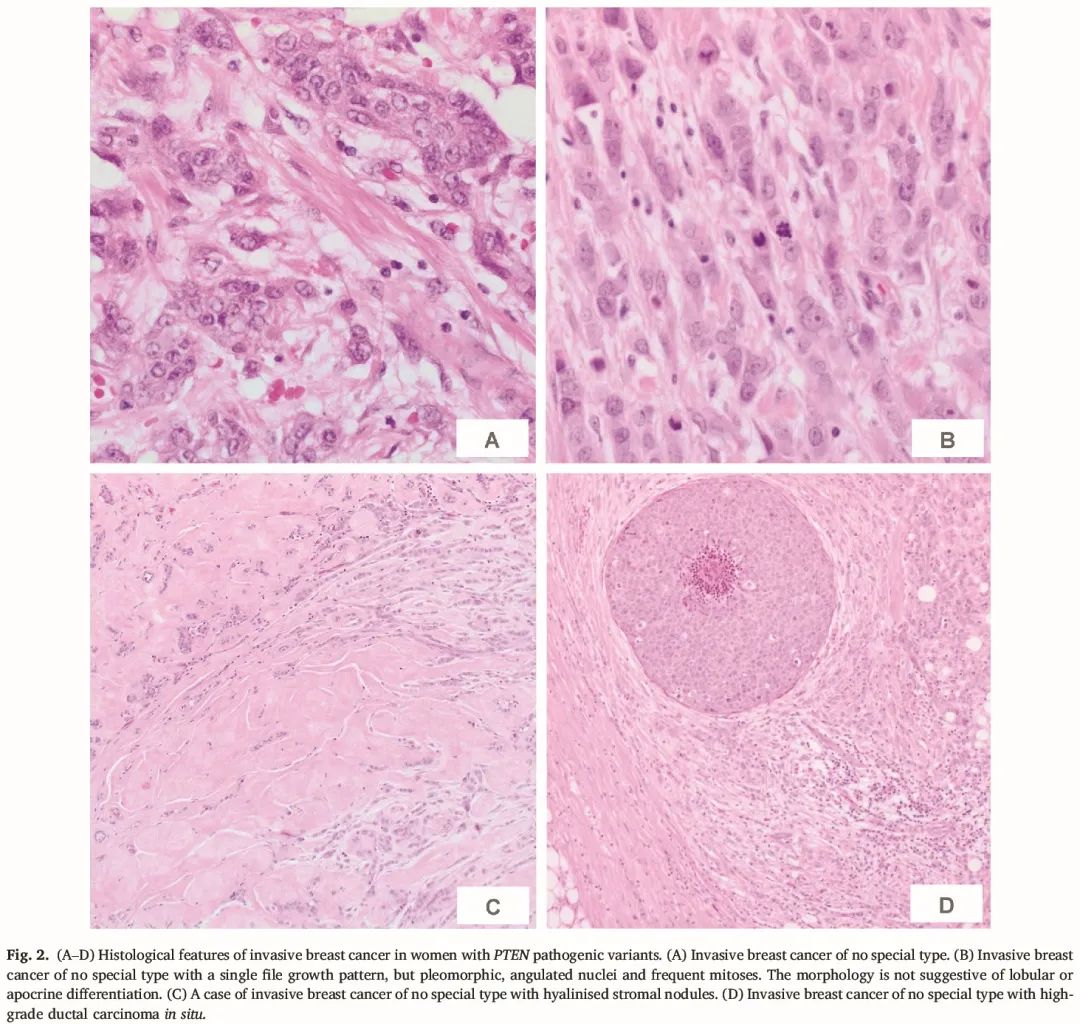
图2
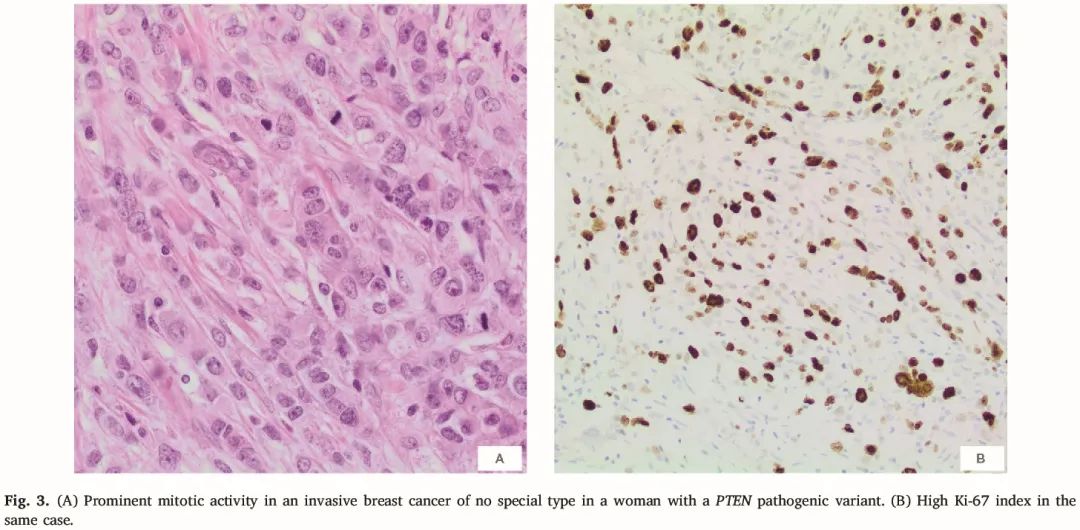
图3
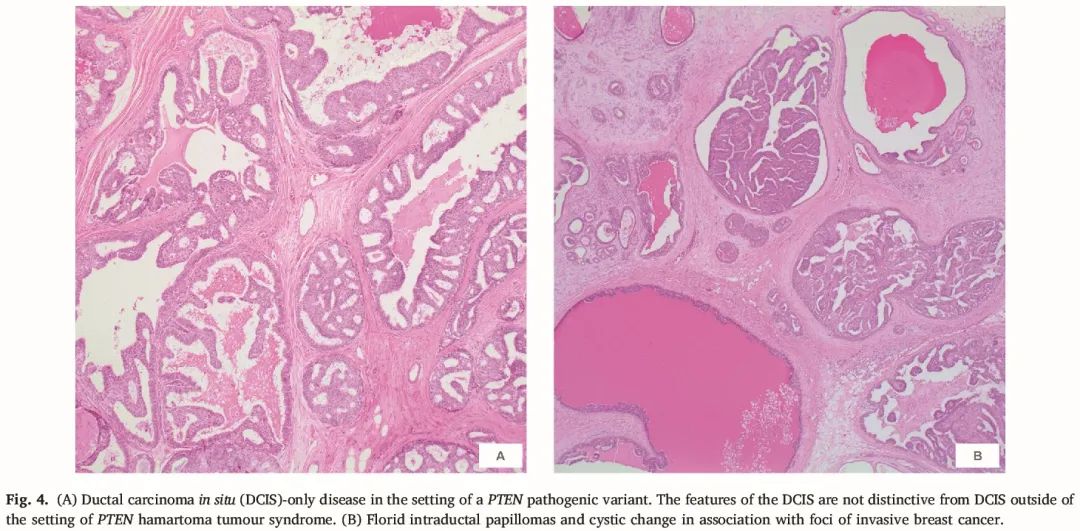
图4
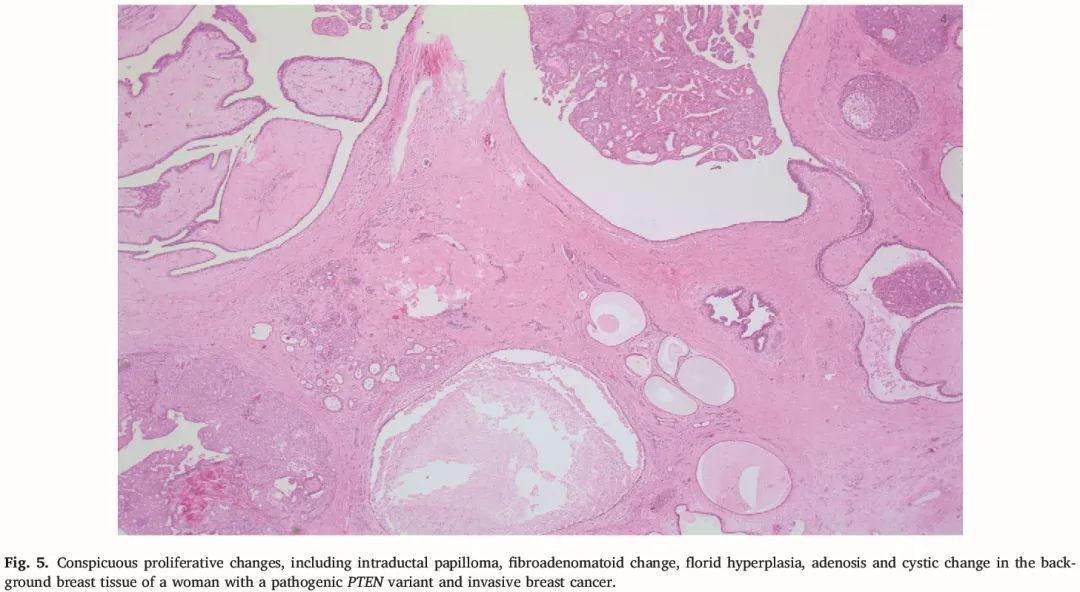
图5
在有相关数据的 9 例病例中,4 例为淋巴结阳性,5 例为淋巴结阴性。所有 9 例已知激素受体状态的病例均为雌激素受体(ER)阳性或孕激素受体(PR)阳性。这些癌症中有 7 例为 ER 阳性和 PR 阳性,通常为强阳性。在其余癌症中,1例 ER 为阴性而 PR 为弥漫强阳性。另一例癌症 ER 为阳性(Allred 评分 5)而 PR 表达阴性。在数据可及的 9 个癌症中,HER2 一致为阴性。根据可及信息,3 个癌症的 Ki-67 增殖指数为 <20%,其余3 个癌症为 >20%。所有浸润性癌症都与不同级别的 DCIS 相关。
3 例女性接受新辅助化疗;1 例获得病理完全缓解。
有 7 个 DCIS 疾病,涉及 6 例女性,其中 1 例患有同时性双侧疾病。DCIS 数据如表 3 所示。除了 2 例外,其余这些患者都在 DCIS 之前或之后还发生浸润性癌。确诊 DCIS 时的平均年龄为 45.6 岁。DCIS 的核级为:3 个中,1 个高,1 个低,其余两个 DCIS 没有详细信息。一例患者的 DCIS 涉及纤维腺瘤。在唯一一例评估激素受体的 DCIS 病例(病例 4)中,ER 和 PR 均呈弥漫性表达(Allred 评分 7)。
7 例病例有非恶性乳腺组织发现,包括乳头状瘤(通常是广泛的)、增殖性纤维囊性改变、硬化性腺病、纤维腺瘤和纤维化。非典型小叶增生见于一例同时性浸润性乳腺癌,非特殊类型患者。
总体而言,在 12 例病例中,10 例最终因恶性疾病需要乳房切除术。其余 2 例没有乳腺癌的病例也需要乳房手术。结果显示良性乳腺疾病,包括复杂的增生变化、乳头状瘤、纤维腺瘤和一例非典型导管增生。非恶性改变为旺炽性且复杂,但形态学特征并非一致具有能提示 PHTS 的独特性。
讨 论
遗传性乳腺癌占乳腺癌的 5-10%。识别有遗传性乳腺癌风险的个体,使这些患者及其亲属有可能获得降低风险的干预措施和癌症早筛。癌症易感综合征还为深入了解癌症的发病机制和新型靶向疗法提供独特的机会。
目前,向携带 BRCA1 和 BRCA2、TP53(Li-Fraumeni)、PTEN(PHTS)、STK11(Peutz-Jeghers)、NF1(神经纤维瘤病)和 CDH1(遗传性弥漫性胃癌)等基因胚系 P/LP 变异的个体提供降低风险的干预措施和协调的筛查计划。来自 Institut Bergonie 遗传实验室的数据估计,到 70.4 岁时,PHTS 女性患恶性肿瘤的累积风险为 85%,这主要是由女性乳腺癌风险造成的。甲状腺癌在女性的中标准化发病比(SIR)为 43.2,在男性中为 199.5。子宫内膜癌(SIR 48.7)和黑色素瘤(SIR 女性 28.3,男性 39.4)在 PHTS 患者中的风险也较高。梅奥诊所的经验反映了这些结果。
遗传性乳腺癌风险评估系统强调以下几点:(i)家族史,(ii)诊断年龄小,(iii)多个乳腺癌诊断,(iv)与其他癌症的关联,以及(v)某些组织学特征占比高和受体特征。例如,BRCA1 与髓样三阴性乳腺癌密切关联。本研究表明,遗传性乳腺癌的这些典型特征在 PHTS 的情况下并不可靠,因此,尽管其对健康有深远的影响,但 PTEN 携带者的识别仍然是一个挑战。首先,新发突变的高发生率(估计存在于 10-44% 的病例中)和嵌合体限制了家族史的价值。基因嵌合体是由于个体的合子后突变,导致存在两个或以上不同基因型的细胞谱系。PHTS 的罕见性、这种综合征广泛和多系统的临床特征以及其自然病程随时间的逐渐展开,限制了医学专家组对这种癌症易感综合征的揭露,阻碍了识别。
既往数据表明,在 PHTS 女性患者中,乳腺癌的外显率很高,高达 85% 在 80 岁前患上乳腺癌。这些报告还强调了早发性乳腺癌的可能性和第二乳腺恶性肿瘤的高风险。在我们的队列中,乳腺癌发病年龄早并非一个始终存在或显著的特征,无法作为潜在胚系致病性变异的可靠警示信号。我们的患者中只有 30% 在40岁之前发病,平均诊断年龄为 41.6 岁。类似地,Tan 等人报告,诊断时的中位年龄为 40 岁,并建议从 30 岁开始筛查。Schrager 的研究显示,乳腺癌通常在 40 多岁时确诊,平均诊断年龄为 46 岁。
多发性,包括双侧乳腺癌,是我们观察到的一个常见情况。在我们的队列中,2 人患有同时性原发性乳腺癌,6 人在首次确诊乳腺癌后,间隔1至15年又发生其他乳腺癌。在我们队列的 12 例癌症患者中,5 例(42%)发生对侧乳腺癌(CBC),这与BRCA1和BRCA2携带者大型研究报告的30%的CBC发生率相似。Ngeow 等人估计了携带 PTEN P/LP 变异的女性在确诊乳腺癌后,发生第二恶性肿瘤的风险,乳腺癌为8.9倍,甲状腺癌为5.82倍,子宫内膜癌为14.08倍。
我们的方法提供了一个前所未有的视角,展示了不同患者乳腺病变的不同表现模式、原位癌和浸润性癌的顺序以及一些患者疾病的长期范围。我们还详细介绍了 PHTS 患者乳腺癌的组织学和 IHC 特征。关于这个主题的数据很少。Schrager 等人 1998 年的研究描述了 14 例 PHTS 女性患者乳腺癌的形态。与我们的系列一致,绝大多数浸润性乳腺癌为非特殊类型,发生于 12 例女性,并在 11 个癌症伴有 DCIS。据我们所知,除了病例报告外,目前尚无系列研究描述过PHTS乳腺癌的全面临床、形态学及受体特征。我们研究的一个重要发现是,我们队列中的所有浸润性癌都是激素受体阳性和 HER2 阴性。在有关PHTS的讨论中,常提及与大汗腺亚型浸润性癌的相关性,包括现行版的WHO分类。这是基于Banneau等人的研究成果,他们报告了来自家族聚集性乳腺癌患者的74个乳腺癌的基因表达数据,其中仅有3个乳腺癌来自Cowden综合征患者。他们对基因表达数据进行了无监督聚类分析,发现这3个癌症以及另外2个被划分到了一个独特的分支上,该分支与经典的斯坦福分子乳腺癌亚型不对应。通过随后的监督聚类,他们认为这一小部分病例“让人联想到分子大汗腺肿瘤”。他们还增加了 12 个 PHTS 乳腺癌用于 IHC 检测,尽管临床数据不可及。他们的 IHC 数据与我们的相似,显示 15 例病例中有 11 例为 ER 阳性,所有均为雄激素受体(AR)阳性,无一例显示 HER2 扩增。尽管他们表明他们的一些病例具有大汗腺形态并且为 GCDFP-15 阳性,但这些癌症不符合我们目前对大汗腺癌的了解。WHO 对大汗腺分化癌的描述要求 ≥90% 的大汗腺形态、ER 和 PR 阴性以及 AR 表达。最近,Schwartz 等人对 42 例具有特征性大汗腺形态的癌进行了详细研究。他们报告,所有这些癌均为三阴性,Ki-67 增殖指数低(平均值为 10%)。这些女性预后良好,97% 的患者在平均随访 62 个月时无病。肿瘤基因检测显示,磷脂酰肌醇 3-激酶通路基因 PIK3CA(53%)和/或 PIK3R1(53%)体细胞致病性变异见于所有进行检测的三阴性大汗腺癌,其中 4 例(24%)存在 PTEN 共突变。他们没有进行胚系检测,也没有提到与 PHTS 的关联。大汗腺形态在本研究的任何癌症中都不是显著特征,所有这些癌症均为激素受体阳性和 HER2 阴性。我们的患者没有基因检测数据,但这些肿瘤的免疫特征与luminal型癌症一致,包括 Ki-67 指数高的 3 级 luminal B 癌。似乎 Banneau 和我们患者的肿瘤都不符合当代对大汗腺癌的了解。鉴于这些发现,对 PHTS 患者乳腺癌进行进一步分子检测是有意义的。
最近,有研究对少数 PHTS 患者和对照病例的肿瘤进行了PTEN IHC,包括 6 例乳腺癌病例和 3 例对照病例。作者报告,PTEN IHC 缺失对 PHTS 具有很高的灵敏度和特异性,可能是一种有用的筛查检测。使用 PTEN IHC 显然要求病理专家首先对个体乳腺癌的遗传基础有印象。
对患有乳腺癌的女性推荐胚系基因检测的标准没有统一应用。美国乳腺外科医师协会(ASBS)共识声明建议,所有有乳腺癌个人史的患者都可以进行基因检测。PARP 抑制剂奥拉帕利在 BRCA1 和 BRCA2 相关高危乳腺癌的辅助治疗中取得的积极结果将加速乳腺癌患者基因检测的主流化。2024 年 2 月, 美国临床肿瘤学会的外科肿瘤学会建议,所有 ≤65 岁的新诊断乳腺癌患者,所有适合 PARP 抑制剂治疗的复发性乳腺癌患者,以及发生第二原发癌的女性,无论家族史如何,都应进行 BRCA1/2 检测。在澳大利亚,对于新确诊乳腺癌的患者,如果基于家族史和肿瘤病理学,利用经过验证的风险计算器,发现致病性胚系变异的可能性至少为10%,则可获得政府资助的基因检测。最近更新的美国国家综合癌症网络(NCCN)指南提出的阈值为5%。近期,澳大利亚MAGIC研究为所有新确诊乳腺癌或高级别 DCIS的女性提供了通用胚系检测,在所检测的474例女性中,有31例(6.5%)发现了致病性胚系变异。有趣的是,这31例女性中有58.1%不符合基于指南的检测的 10% 风险标准。在政策更新之前,这种程度的基因检测并不是常规的。ASBS 提倡仅对 BRCA1、BRCA2 和 PALB2 进行常规检测。他们建议,对于其他基因,仅根据特定的临床情况和家族史来评估。鉴于 PTEN 新发突变的频率及其不同的疾病表现,即使如此自由的检测策略也不能保证 PTEN 杂合子的识别。
虽然较大的基因panel包括 PTEN,但检测资格仍然依赖于对特定临床情景和家族史的识别,正如我们将看到的那样,在 PHTS 病例中并不是最佳。随着胚系检测转诊日益成为主流,定量风险算法,例如2017年病理学调整的曼彻斯特评分系统(MSS3),常被众多医疗专业人员使用。CanRisk 是一种更复杂的工具,用于计算大量乳腺癌和卵巢癌易感基因的变异概率。但由于需要向在线平台输入更详细的临床数据,在繁忙的临床工作中其使用受到阻碍。参与此类检测的医疗服务提供者应了解,MSS3 专门针对发现 BRCA1/2 携带者,而不是发现其他致病性胚系变异携带者的通用风险计算器。这两种工具都不是为发现 PTEN 携带者而开发的。我们的数据显示,如果使用曼彻斯特风险评估工具,患有 PTEN 相关乳腺癌的女性不太可能被评估为高风险。我们队列中不到一半的癌症诊断于 40 岁前,她们患卵巢癌或胰腺癌的风险没有增加,她们的男性亲属很少患乳腺癌,患前列腺癌的风险也没有增加。此外,PHTS 相关乳腺癌为 ER 阳性,可能具有小叶形态,这些女性中有一半发生 DCIS。在 MSS3 中,后面这些特征会降低总体风险评分。
向怀疑具有家族性乳腺癌易感基因的乳腺癌患者提供基因panel检测越来越普遍,通常包括 ATM、BRCA1、BRCA2、CHEK2、PALB2 和 TP53。此外,还提供更广泛的panel,包括其他高外显率乳腺癌易感基因,如 PTEN、CDH1、STK11 和 NF1,无论其他个人或家族史特征如何。使用这些更广泛的基因panel可能会提高识别 PTEN P/LP 变异携带者的几率。
使用 PTEN 特异性风险评估算法可能在识别 PTEN 携带者方面取得更大的成功。根据克利夫兰诊所对 3000 多例疑似 Cowden 综合征患者的前瞻性研究,可以使用在线风险计算器(http://www.lerner.ccf.org/gmi/ccscore)。>15 分提示具有胚系 PTEN 突变的风险为 >10%。一项经济评估支持这些检测阈值。
当然,选择正确的风险算法取决于医疗服务提供者对疾病临床特征的了解。NCCN PHTS 诊断指南如表 4 所示。美国医学遗传学和基因组学学会建议,对于符合主要或次要诊断标准中任意 3 项的任何人,应考虑转诊进行基因检测。PHTS 多样的疾病表现、非恶性疾病的频率以及以及当代医疗中由多个全科医生和专科医生分散诊疗的情况,都限制了大多数医生积累识别这些患者的经验。

表4
由于 PHTS 影响多个器官系统,全科医生和病理专家可能有助于识别这些患者。我们最近发现,在PHTS个体发生癌症之前,良性黏膜皮肤纤维瘤性病变以及血管畸形/血管瘤常常进行活检,并可能提示这种可能性。我们设想,随着时间推移,技术发展将使实验室信息系统能够常规监测此类及其他遗传性疾病的诊断,并将整理好的结果报告给相关临床团队以便跟进。在此之前,需要依靠众多医生运用他们的知识和临床洞察力来识别这些患者。
一旦遗传咨询和评估确认了可能导致其癌症易感性的突变,这些个体就需要一个多系统筛查和影像学检查计划,以便对一系列癌症进行早期诊断。这包括每年进行乳腺磁共振成像,甲状腺、肾脏和子宫内膜超声检查,子宫内膜活检,结肠镜检查和皮肤检查。由于 PHTS 是一种常染色体显性遗传病,其亲属也应进行胚系检测。
本研究的优势包括对这些女性乳腺癌患病情况独特的长期观察。遗憾的是,由于研究的时间跨度长,大多数病例的原始玻片和组织蜡块无法无法获取以供审查。本文提供的数据基于原始病理报告。
携带 PTEN P/LP 变异的女性患乳腺癌的风险显著增加。本研究表明,其乳腺癌为激素受体阳性和 HER2 阴性,符合luminal型生物学。它们不符合当前大汗腺乳腺癌的定义。不幸的是,PHTS 女性的乳腺癌没有独特的形态学或受体特征,诊断年龄小不是一个一致的发现。在我们看来,患者其他活检的背景,包括既往乳腺疾病诊断,可能为其乳腺癌的遗传基础提供潜在线索。在这个胚系检测主流化的时代,重要的是要意识到,常用的曼彻斯特风险评估工具是专门为识别胚系 BRCA1 或 BRCA2 变异先验概率高的乳腺癌患者设计的,不适合识别具有胚系 P/LP PTEN 变异的患者。目前,由于没有通用于所有新诊断的乳腺癌个体的胚系检测,包括病理专家在内的一系列医生都应了解 PHTS 的临床病理特征,这样才能在女性乳腺癌患者中考虑到存在胚系PTEN变异的可能性。然后可以使用替代的特定的风险计算器,让具有 PTEN 胚系致病性变异的女性及其亲属有机会进行早期识别和预防诊治。
参考文献:
Farshid G, Ibbetson SJ, Pradhan M, Henry L, Manton ND, Dubowsky A, Poplawski NK. Clinical, histological and receptor profiles of invasive breast cancer and ductal carcinoma in situ in females with germline pathogenic variants in PTEN and implications for germline testing. Pathology. 2024 Oct 15:S0031-3025(24)00245-9. doi: 10.1016/j.pathol.2024.08.004. Epub ahead of print. PMID: 39567325.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#乳腺癌# #PTEN胚系突变#
3