文丨新海
国家药品监督管理局2021年至今已经批准了67款新药(不包括新适应症),数量上与往年相比大幅增加,伊匹木单抗(逸沃®)、利司扑兰(艾满欣®)、司美格鲁肽(诺和泰®)等重磅创新药的上市极大的满足国内癌症和罕见病治疗的临床需求,大大推进糖尿病等疾病领域治疗方式和治疗理念的改革。
在COVID-19方面,2021年已附条件批准3款国产新冠疫苗,近期又应急批准了中国首个抗新冠病毒特效药——安巴韦单抗/罗米司韦单抗联合疗法,为全球抗疫做出了重大贡献。
2020年末我们预测的14款重磅新药已全部批准上市,在2021年接近尾声之际,我们再来梳理一下2022年有较大希望在国内批准上市的重磅新药,供大家参考。
NO.1 塞利尼索(Xpovio)
预计批准时间:2022Q1
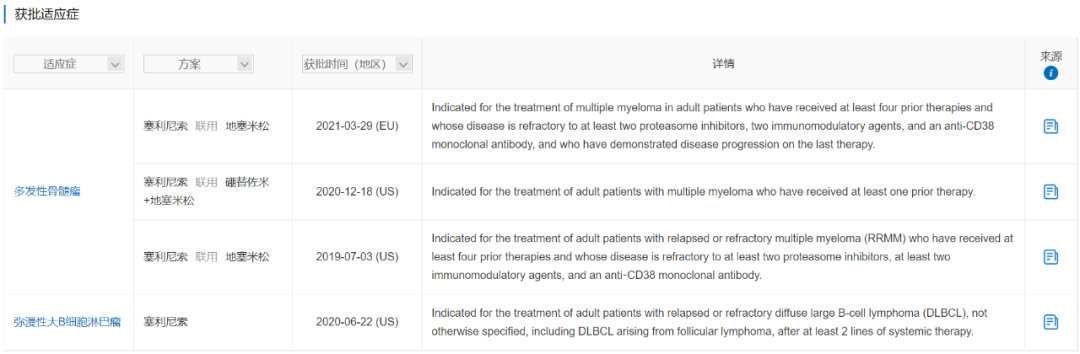
塞利尼索由德琪医药从Karyopharm Therapeutics引进,是全球首个口服选择性核输出蛋白1(XPO1)抑制剂。塞利尼索于2019年7月最先在美国上市,于2021年3月在欧洲上市,目前已获批的适应症包括:多发性骨髓瘤(MM)和弥漫性大B细胞淋巴瘤(DLBCL)。塞利尼索是唯一一个获批用于复发性或难治性DLBCL的口服单药疗法,也是唯一一个同时获批用于MM、DLBCL的药物。
数据来源:NextPharma®-获批适应症
在针对既往接受过至少一线疗法患者治疗多发性骨髓瘤的关键III期试验BOSTON(NCT03110562)中,塞利尼索+硼替佐米和地塞米松(Vd)vs. Vd的mPFS显著提升4.4月。在针对既往至少接受过二线系统治疗患者治疗r/r DLBCL的IIb期试验SADAL(NCT02227251)中,塞利尼索整体ORR达到29%,CR为13%,PR为16%,都显示出塞利尼索卓越的抗肿瘤活性。
塞利尼索于2021年1月向NMPA提交了用于复发/难治性多发性骨髓瘤的上市申请(JXHS2100013),随后于2月被纳入优先审评程序,曾获国家重大新药创制科技重大专项支持,目前已完成技术审评,预计2022Q1获批。
NO.2 依帕伐单抗(Gamifant)
预计批准时间:2022Q1
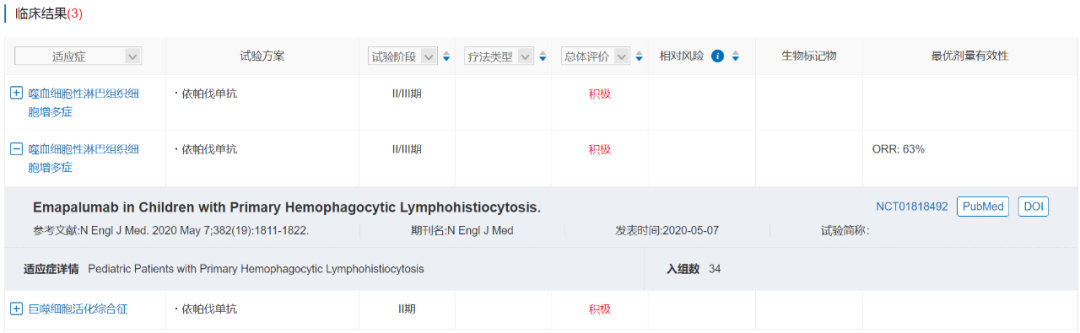
依帕伐单抗是一款由Swedish Orphan Biovitrum和Light Chain开发的靶向IFNγ的单克隆抗体,在美国被授予用于治疗噬血细胞性淋巴组织细胞增多症(HLH)的突破性疗法资格,于2018年11月正式获批。依帕伐单抗是全球批准的唯一一个治疗原发性噬血细胞性淋巴组织细胞增多症的药物,也是第一个专门针对IFNγ的药物。
原发性噬血细胞性淋巴组织细胞增多症是一种超级罕见、进展迅速、常常致命的过度炎症,大量表达IFNγ驱动免疫系统过度激活,最终导致器官衰竭。
一项II/III期临床试验NI-0501-04(NCT01818492)结果显示,在27名既往接受过治疗的原发性HLH患者中,接受依帕伐单抗治疗的ORR达到63%,证明了依帕伐单抗每周两次静脉输注给药的疗效和安全性。
数据来源:NextPharma®-临床结果
依帕伐单抗于2020年12月在中国提交了进口新药上市申请(JXSS2000058、JXSS2000059、JXSS2000060),并被纳入优先审评审批程序,目前处于2轮发补阶段,预计2022Q1获批。
NO.3 乌帕替尼(Rinvoq)
预计批准时间:2022Q1
AbbVie研发的乌帕替尼是一款每日口服1次的JAK1抑制剂,最早于2019年8月在美国获批用于类风湿关节炎,随后在欧洲和日本获批,且于今年8月在欧洲批准用于特应性皮炎,是首个在欧盟获批治疗特应性皮炎的JAK抑制剂。目前乌帕替尼获批的适应症有特应性皮炎、银屑病关节炎、强直性脊柱炎和类风湿性关节炎。

数据来源:NextPharma®-获批适应症
IIIb期试验Heads Up(NCT03738397)数据显示,治疗16周,乌帕替尼 vs. 度普利尤单抗达到EASI 75患者比例为71% vs. 61%,试验达到主要终点。此外,乌帕替尼在所有次要终点中均显示出统计学意义优效性,包括瘙痒减少和皮肤清除改善率。
乌帕替尼自上市以来,销售额急速上升,2020年销售额已达7.31亿美元。乌帕替尼在国内也开展了多种炎症性疾病的临床试验,并于2020年12月提交用于特应性皮炎的新药上市申请(JXHS2000186、JXHS2000187),随后被纳入优先审评审批程序,目前正在审评中,预计2022Q1获批。
目前已有3款JAK抑制剂在国内上市,分别是巴瑞替尼、托法替布、芦可替尼,但尚未获批特异性皮炎适应症。此外,Pfizer的阿布昔替尼也已处于注册审评阶段,也有望于2022年获批用于特异性皮炎。
NO.4 罗特西普(Reblozyl)
预计批准时间:2022Q1
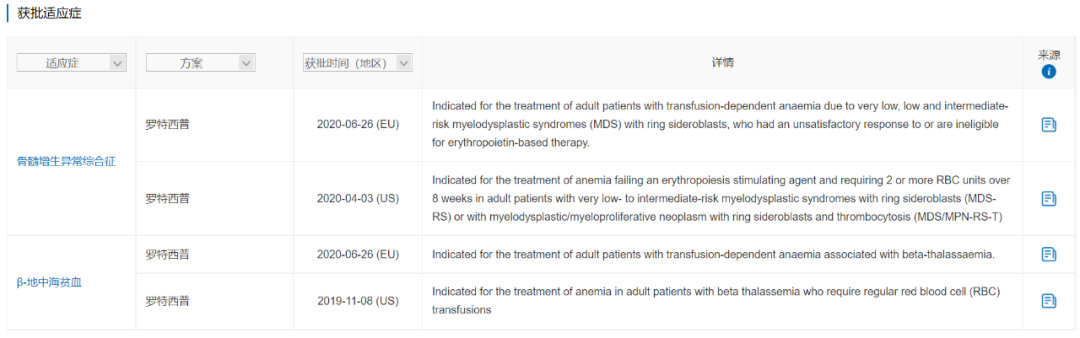
罗特西普是一种ActRIIB-Fc融合蛋白,由Acceleron(已被Merck & Co.收购)与Celgene(已被Bristol-Myers Squibb收购)合作研发,最早于2019年11月在美国获批用于β-地中海贫血,随后于2020年4月获批用于骨髓增生异常综合症相关贫血。罗特西普是FDA批准的第一个用于β-地中海贫血的药物,也是FDA批准的唯一一个红细胞成熟剂,通过促进晚期红细胞成熟减轻患者的输血负担。
数据来源:NextPharma®-获批适应症
在III期临床试验BELIEVE(NCT02604433)中,接受罗特西普vs 安慰剂治疗13-24周,输血负担相较于基线降低≥33%的患者达到21.4% vs 4.5%,试验达到主要终点。
罗特西普的2020年销售额为2.74亿美元。罗特西普于2021年2月直接利用境外临床数据向NMPA提交了治疗需要定期输注红细胞的成人β-地中海贫血的上市申请(JXSS2100010、JXSS2100011),并被纳入优先审评审批程序,目前处于1轮发补阶段,预计2022Q1获批,有望填补中国地中海贫血药物治疗的空白。
NO.5 劳拉替尼(Lorbrena)
预计批准时间:2022Q1
基石药业和Pfizer合作开发的劳拉替尼是第三代ALK抑制剂,于2018年先后在日本和美国获批用于ALK阳性非小细胞肺癌,并于2019年5月在欧洲上市。FDA曾授予劳拉替尼用于ALK+ mNSCLC的突破性疗法资格,今年将其适应症扩展至一线治疗ALK阳性的NSCLC。
劳拉替尼主要针对前两代抑制剂驱动的耐药突变,能够解决第二代抑制剂引起的溶剂前沿G1202R突变。同时,劳拉替尼具有优异的中枢神经系统渗透性,能够解决NSCLC的脑转移。
一线治疗ALK+NSCLC的III期试验CROWN(NCT03052608)结果显示,接受劳拉替尼 vs. 克唑替尼治疗达到12月无疾病进展患者比例为78% vs. 39%,将疾病进展或死亡风险降低72%,ORR为76% vs. 58%,脑转移患者ORR为82% vs. 23%。3/4级不良事件发生率为72% vs. 56%,因不良事件导致的暂停患者比例为7% vs. 9%,达到主要终点。
劳拉替尼的2020年全球销售额为2.04亿美元,是2019年销售额的近2倍。劳拉替尼于2021年4月首次在中国提交了ALK阳性晚期NSCLC的上市申请(JXHS2101002,JXHS2101003),目前处于审评阶段,预计将于2022 Q1获批。
NO.6 戈沙妥组单抗(Trodelvy)
预计批准时间:2022Q2
戈沙妥珠单抗是一种新型靶向TROP2的抗体偶联药物(ADC),大多数ADC都采用超高毒性的载药和稳定的连接子,但是戈沙妥珠单抗采用了中等毒性的SN-38和中等程度稳定的连接子。

戈沙妥珠单抗的结构
戈沙妥珠单抗由云顶新耀从Immunomedics(已被Gilead Sciences收购)引进,FDA曾授予其突破性疗法资格,于2020年4月首次在美国获批用于三线治疗转移性三阴乳腺癌(TNBC),今年4月新增适应症转移性尿路上皮癌。戈沙妥珠单抗是FDA批准的第一个用于复发性或难治性TNBC的抗体偶联药物,也是FDA批准的第一个靶向TROP2的抗体偶联药物。
关键III期试验ASCENT(NCT02574455)结果表明,戈沙妥珠单抗在治疗mTNBC时,将死亡风险和疾病进展风险分别降低了52%和59%,戈沙妥珠单抗vs. 化疗的mOS达到12.1月 vs. 6.7月,证实了其在末线三阴性乳腺癌上相比于标准疗法的显著疗效。
戈沙妥珠单抗的2020年销售额为0.49亿美元。该药于2021年5月提交用于三阴性乳腺癌的上市申请(JXSS2101007),并被纳入优先审评审批程序,目前处在审评阶段,预计2022Q2获批。
NO.7 拉罗替尼(Vitrakvi)
预计批准时间:2022Q2
拉罗替尼最初由Array BioPharma(已被Pfizer收购)发现,于2013年授权给Loxo Oncology(已被Eli Lilly收购),于2017年与Bayer达成合作。2018年11月,率先在美国上市用于NTRK融合阳性实体瘤,此前FDA曾授予其突破性疗法资格,后相继在欧洲和日本上市。拉罗替尼是第一代TRK抑制剂,是第一个基于生物标志物首发上市的药物。
Bayer披露拉罗替尼用于治疗TRK融合阳性肿瘤的3项试验(NCT02122913,NCT02576431和NCT02637687)长期随访数据显示,截止到2019年7月15日,包括17种肿瘤类型的116例成人患者,ORR达到71%,脑转移患者的ORR为71%;中位随访17.4月时,mDOR为35.2月;中位随访14.6月时,mPFS为25.8月;12月OS为87%。
拉罗替尼于2021年5月首次在中国提交上市申请(JXHS2101014、JXHS2101016、JXHS2101015),申报的适应症为携带NTRK融合基因的晚期实体瘤,随后被纳入优先审评程序,目前处于1轮发补阶段,预计2022Q2获批。
NO.8 培美替尼(Pemazyre)
预计批准时间:2022Q2
信达生物从Incyte引进的培美替尼是一种FGFR1/2/3抑制剂,最早于2020年4月在美国获批用于FGFR2融合或重排的局部晚期或转移性胆管癌,2021年3月相继在日本和欧洲获批,同年6月在中国台湾获批相同适应症。培美替尼是第一个获批用于胆管癌的靶向疗法。
在一项针对胆管癌的II期临床试验FIGHT-202(NCT02924376)中,培美替尼单药ORR达到36%,mDOR为9.1月。国内桥接试验CIBI375A201(NCT04256980)研究结果显示,在 30例疗效可评价人群中,ORR达到50%,中位随访5.13个月时,12例患者仍处于病情缓解中,mDOR尚未达到。
培美替尼的2020年销售额为0.26亿美元。培美替尼于2021年7月在中国首次提交进口新药上市申请(JXHS2101026、JXHS2101027、JXHS2101028),随后被纳入优先审评审批程序,目前正在审评中,预计2022Q2获批。
NO.9 Mobocertinib(Exkivity)
预计批准时间:2022Q2
ARIADPharmaceuticals(已被Takeda Pharmaceuticals收购)研发的Mobocertinib是一种靶向EGFR和HER2 exon 20插入突变的小分子酪氨酸激酶抑制剂,于2021年9月在美国获批用于治疗EGFR Exon20插入突变NSCLC,此前FDA授予其相同适应症突破性疗法和孤儿药资格。Mobocertinib是FDA批准的首个治疗EGFR Exon20插入突变NSCLC的口服疗法。
EGFR突变占非小细胞肺癌的10-15%,在亚洲肺腺癌患者中达40-50%,EGFR exon 20插入突变至少占EGFR突变的9%。目前EGFR抑制剂已研发至第四代,但是EGFR exon 20插入突变的患者对前几代抑制剂应答率较低。Mobocertinib的上市可为这类患者带来新的治疗选择。
在用于既往接受过含铂化疗患者治疗EGFR Exon20插入突变NSCLC的I/II期试验EXCLAIM(NCT02716116)中,根据IRC评估的cORR达到28%,mDoR为17.5个月,mOS为24个月,mPFS为7.3个月。
Mobocertinib于2021年7月向NMPA提交上市申请(JXHS2101024),此前被纳入突破性治疗品种,并被纳入优先优先审评程序,目前正在审评中,预计2022Q1获批用于EGFR 20号外显子插入突变阳性的NSCLC。
NO.10 艾伏尼布(Tibsovo)
预计批准时间:2022Q3
艾伏尼布是基石药业与Servier开发的IDH1抑制剂,最先于2018年7月在美国获批,用于治疗IDH1突变的急性粒细胞白血病(AML),是第一个获批上市的IDH1抑制剂。2021年8月,再次获批准作为首个且唯一用于IDH1突变胆管癌患者的靶向药物。此前FDA先后授予用于治疗携带 IDH1 易感突变的AML和携带IDH1易感突变的复发难治骨髓增生异常综合征的突破性疗法资格。
急性粒细胞白血病是最难治的血癌之一,通常恶化很快,不是所有患者都能接受强化化疗,年龄和并发症是限制强化治疗的主要因素,5年存活率只有28%。大约6%-10%的急性粒细胞白血病患者存在IDH1突变。
艾伏尼布联合阿扎胞苷一线治疗新确诊且不适合强化化疗的IDH1突变AML的3期试验AGILE(NCT03173248 )数据。研究结果显示,艾伏尼布+阿扎胞苷 vs 安慰剂+阿扎胞苷的EFS具有显著统计学意义,mOS达到24.0m vs 7.9m,ORR为62.5% vs 18.9%,其中CR为47.2%vs 14.9%。安全性数据与此前公布的一致。
艾伏尼布自上市以来,销售额稳步上升,2020年销售额为1.21亿美元。艾伏尼布被纳入第三批临床急需境外新药名单,于2021年8月直接提交进口新药上市申请(JXHS2101039),并被纳入优先审评审批程序,目前正在审评中,预计2022Q3获批用于IDH1突变的成人复发性或难治性AML。
NO.11 二十碳五烯酸乙酯(Vascepa)
预计批准时间:2022Q3
亿腾医药从Amarin引进的Vascepa最先于2012年7月在美国获批上市,后于2021年3月在欧洲上市。Vascepa是唯一一个FDA批准的EPA处方药,用于降低非常高的甘油三酯(TG ≥500 mg/dL)并且不升高LDL-C。
Vascepa的生产难度非常高,通过一套严格复杂的纯化工艺从鱼类中分离提取,1克胶囊中EPA的含量不低于96%,是一种超纯ω-3脂肪酸专利产品。
一项国际性的针对心血管事件的III期临床试验REDUCE-IT(NCT01492361)结果显示,与安慰剂相比,给予4g/d的Vascepa可显著减少25%的主要心血管事件(5分MACE),优于以往任何疗法。
上市之后,Vascepa的销售额稳步上升,2020年销售额已达到6.14亿美元。Vascepa于2021年2月在中国提交了用于预防心血管风险相关疾病的上市申请(JXHS2100019),后于8月进行了现场核查(CFDI),预计2022Q3获批。
NO.12 多扎格列艾汀(dorzagliatin)
预计批准时间:2022Q3
华领医药研发的多扎格列艾汀是一种双机制变构葡萄糖激酶激活剂,同时作用于胰腺和肝脏葡萄糖激酶。多扎格列艾汀是中国企业研发的第一个达到主要有效性终点的II型糖尿病全球首创新药,获得国家“十二五”、“十三五”重大新药创制科技重大专项支持。2020年8月,华领医药与拜耳在中国达成战略合作协议,双方将强强联手,加速推动多扎格列艾汀的商业化进程。
两项多扎格列艾汀III期注册临床研究均表明,多扎格列艾汀具有良好的安全性和耐受性,可以持续改善β细胞功能和胰岛素抵抗。其中HMM0301(NCT03173391)研究结果显示,多扎格列艾汀 vs 安慰剂的HbA1c相对基线显著变化-1.07% vs. -0.50%,β细胞功能显著改善了3.28%。HMM0302(NCT03141073)研究结果显示,治疗24周,多扎格列艾汀+二甲双胍治疗组HbA1c较基线降低1.02%,餐后2小时血糖较基线显著降低5.45mmol/L。
多扎格列艾汀于2021年4月在中国提交用于治疗II型糖尿病的上市申请(CXHS2101004),是全球范围内首个NDA的葡萄糖激酶激活剂类(GKA)糖尿病治疗药物,目前处于药品注册生产现场检查(CFDI)阶段,预计2022Q3在中国首先上市。
NO.13 卡度尼利单抗(cadonilimab)
预计批准时间:2022Q3
卡度尼利单抗由康方生物自主研发,是一款全球首创的靶向PD-1和CTLA-4的双特异性抗体。卡度尼利单抗在全球范围内开展了多项肿瘤领域不同适应症的临床研究。此前用于治疗铂类化疗失败后的复发或转移性宫颈癌被FDA授予快速通道资格和孤儿药资格,被CDE纳入突破性治疗品种名单。
针对经标准治疗后的复发/转移性鳞状宫颈癌的Ia期试验结果显示,卡度尼利单抗整体ORR达到47.6%。用于一线治疗晚期胃癌或胃食管交界处癌的Ib/II期试验(NCT03852251)结果显示,在接受卡度尼利单抗+奥沙利铂+卡培他滨的可评估的GC或GEJ患者中,ORR达到64.1%,DCR达到87.2%,目前针对该适应症的III期临床试验也已正式启动。
2021年9月,卡度尼利单抗提交上市申请(CXSS2101032),适应症为既往接受过含铂化疗治疗失败的复发或转移性宫颈癌,随后于10月被纳入优先审评审批程序,目前处于审评阶段,预计2022Q3获批,有望成为第一个获批上市的基于PD-1的双特异性抗体药物。
NO.14 奥匹卡朋(Ongentys)
预计批准时间:2022Q3
复星集团子公司万邦医药从Bial-Portela引进的奥匹卡朋,于2016年首次被欧盟批准作为左旋多巴/多巴脱羧酶抑制剂的辅助疗法用于治疗帕金森,并于2020年4月和6月先后在美国和日本上市。
奥匹卡朋是一种长效、第三代儿茶酚-O-甲基转移酶(COMT)抑制剂,只需要一天一次,因其具有极高的结合亲和力和较长的体内作用时间,可显著降低患者服药次数。
两项III期试验BIPARK-1(NCT01568073)和BIPARK-2(NCT01227655)结果,治疗14/15周时,opicapone vs. 安慰剂相较于基线显着减少了“关闭”期时间,并增加了“开启”期时间,达到试验终点。
奥匹卡朋于今年3月在中国提交上市申请(JXHS2100028),目前正在审评中,预计2022Q3获批。
NO.15 卡替拉韦(Vocabria)
预计批准时间:2022Q4
卡替拉韦最初由Shionogi开发,长效注射剂由ViiV Healthcare开发。卡替拉韦每两个月注射一次,是第二代HIV整合酶链转移抑制剂(INSTI),对整合酶耐药突变的活性比拉替拉韦、埃替拉韦更高。该药最早于2020年12月在欧盟获批用于治疗HIV-1感染,随后在美国获批,此前FDA曾授予卡替拉韦用于HIV暴露前预防的突破性疗法资格。
卡替拉韦/利匹韦林(Cabenuva)是唯一一个只需一月注射一次的完整抗HIV-1疗法,可用于病毒已得到抑制且稳定的患者,替代传统的抗病毒疗法。Cabenuva将用药频次从一年365次降低到12次。
用于治疗HIV感染的关键III期试验ATLAS(NCT02951052)和FLAIR(NCT02938520)数据显示,卡博特韦+利匹韦林每月注射一次的治疗方案在维持病毒抑制方面与持续每天口服三种药物治疗方案一样有效。用于预防HIV感染的IIb/III期试验HPTN083(NCT02720094)结果显示,在男性参与者中,每两月注射卡博特韦 vs. 每日口服FTC/TDF预防HIV有效率提高66%,HIV感染率为0.41% vs.1.22%。
卡替拉韦在2021年11月提交了片剂和注射剂两种剂型的上市申请(JXHS2101083、JXHS2101084、JXHS2101085),目前正在审评中,预计2022Q4获批,有望转变国内HIV感染者的治疗方式。
NO.16 曲拉西利(Cosela)
预计批准时间:2022Q4
曲拉西利是一种高活性短效CDK4/6抑制剂,由G1 therapeutics研发,于2020年先后与Boehringer Ingelheim、先声药业合作。曲拉西利曾被FDA授予突破性疗法资格,并于2021年2月在美国上市,用于缓解小细胞肺癌患者在化疗时引起的骨髓抑制,这是首个在化疗前用于保护骨髓的疗法。此前已上市的CDK4/6抑制剂都获批用于HR阳性乳腺癌。
骨髓抑制是化疗最常见的副作用。曲拉西利作为第一个骨髓保护剂,可以暂时地将造血干细胞/祖细胞截在G1期,在化疗结束后重新进入细胞周期,长时间抑制CDK4/6则会阻断T细胞增殖并造成骨髓抑制,使得化疗更加安全同时降低生长因子和输血的需求。
三项II期试验结果,在化疗前接受曲拉西利的患者,在中性粒细胞减少的持续时间和严重程度上均有显著减少,以及对红输血和其他骨髓保护措施有积极影响。
2021年12月1号,曲拉西利首次在中国提交上市申请(JXHS2101087),随后被纳入拟优先审评程序,预计2022Q4获批用于治疗ES-SCLC患者化疗时引起的骨髓抑制。
NO.17 替洛利生(Wakix)
预计批准时间:2022Q4
替洛利生是一个全球首创的H3受体拮抗剂/反向激动剂,该药物于 2016 年被 EMA 批准用于治疗成人发作性睡病日间嗜睡,并于2019年在美国获批相同适应症,2020年10月FDA补充批准治疗发作性睡病相关的猝倒。替洛利生是唯一一个不受美国缉毒局管制的发作性睡病药物。
替洛利生可以结合突触前的H3自受体,阻断组胺(大脑中促进清醒的一种神经递质)与这些受体的结合(拮抗效应),这种结合会促进组胺的合成和释放(反向激动剂效应)。总而言之,替洛利生增加大脑中组胺的量。
在针对发作性睡病的III期试验HARMONYCTP(NCT01800045)中,接受替洛利生单药治疗与安慰剂相比,平均每周猝倒发作频率降低-75% vs -38%(HR为0.51, p<0·0001);III期试验HARMONY 1(NCT01067222)结果显示,接受替洛利生vs 莫达非尼 vs 安慰剂的平均ESS得分降低-5.8 vs -6.9 vs -3.4(p=0.024),优于安慰剂,不劣于莫达非尼。
替洛利生的销售额增长迅速,2020年全球销售额达到1.6亿美元。该药在中国内地没有开展临床试验,于2021年9月直接提交进口新药上市申请(JXSS2000048),目前正在审评中,预计2022Q4获批用于治疗发作性睡病成人患者的日间过度嗜睡或猝倒。
NO.18 贝舒地尔(Rezurock)
预计批准时间:2022Q4
烨辉医药从Kadmon(已被Sanofi收购)引进的贝舒地尔于2021年7月在美国获批上市,用于慢性移植物抗宿主病,此前被FDA授予突破性疗法资格和优先审评资格。贝舒地尔是第一个也是唯一一个FDA批准的小分子ROCK2抑制剂,它能够通过下调STAT3减少Th17细胞,同时通过上调STAT5增强Treg细胞。
针对慢性移植物抗宿主病的II期试验ROCKstar(NCT03640481)结果显示,在既往接受过至少2线系统疗法患者中,贝舒地尔200mg每天的ORR达到74%,贝舒地尔 200mg每天两次的ORR达到77%。
2020年12月,贝舒地尔用于慢性移植物抗宿主病被CDE纳入突破性治疗品种名单,并于2021年11月在中国提交了进口新药上市申请(JXHS2101080),目前正在审评中,预计2022Q4获批。
NO.19 维博妥珠单抗(Polivy)
预计批准时间:2022Q4
Genentech(已被Roche收购)和Seagen合作开发的维博妥珠单抗是全球首创的靶向CD79b的抗体偶联药物,于2019年6月被FDA批准上市,用于三线治疗复发或难治性弥漫性大B细胞淋巴瘤(DLBCL),并于2020年和2021年相继在欧洲和日本上市。
CD79b蛋白在大多数B细胞中特异性表达,在淋巴组织中大量存在。维博妥珠单抗通过与CD79b蛋白特异性结合并释放化疗药物来破坏B细胞,使其对正常细胞的影响降到最低。
针对成人R/R DLBCL的Ib/II期试验GO29365(NCT02257567)结果显示,Polivy+苯达莫司汀+利妥昔单抗(BR) vs. BR的CR达到40% vs.17.5%,mOS达到12.4月 vs. 4.7月。这是唯一一个证明比苯达莫司汀/利妥昔单抗更高应答率的关键随机试验。一线治疗DLBCL的关键III期试验POLARIX(NCT03274492)结果显示,Polivy+R-CHP vs R-CHOP显著改善PFS,达到其主要终点。
维博妥珠单抗的2020年销售额达到1.69亿瑞士法郎,约2019年销售额的三倍。2021年12月2日,在中国提交上市申请(JXSS2101035、JXSS2101034),预计2022Q4上市用于弥漫性大B细胞淋巴瘤。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












涨知识
67
涨知识了
90
学习了
76
涨知识了
75
#重磅#
48
学习学习了
83
不错学习了
74