Cell子刊: 同济大学刘占举/朱瑞新/西湖大学郭天南揭示了肠道及其附属组织的相互作用网络
2023-05-19 iNature iNature 发表于上海
该研究分析了来自30名CD患者的肠粘膜、粘膜下-肌层-浆膜、肠系膜脂肪组织、肠系膜和肠系膜淋巴结的540份样本中的宿主蛋白和组织微生物,并在空间上解读了宿主-微生物的相互作用。
失调的宿主-微生物相互作用在克罗恩病(CD)肠道炎症的发生和延续中起关键作用。然而,肠道及其附属组织的空间分布和相互作用网络仍然是难以捉摸的。
2023年5月11日,同济大学刘占举、朱瑞新及西湖大学郭天南在Cell Reports Medicine在线发表了题为“Integrative multi-omics deciphers the spatial characteristics of host-gut microbiota interactions in Crohn’s disease”的研究论文,该研究分析了来自30名CD患者的肠粘膜、粘膜下-肌层-浆膜、肠系膜脂肪组织、肠系膜和肠系膜淋巴结的540份样本中的宿主蛋白和组织微生物,并在空间上解读了宿主-微生物的相互作用。
该研究观察到在CD中多组织异常的抗菌免疫和代谢过程和确定细菌传播随着改变的微生物群落和生态模式。此外,该研究还确定了几种宿主蛋白和微生物之间的候选相互作用对,这些相互作用对与CD中肠道炎症的持续存在和细菌跨多组织的迁移有关。宿主蛋白(例如SAA2和GOLM1)和微生物(例如Alistipes和链球菌)的特征改变进一步烙印在血清和粪便样本中,作为潜在的诊断生物标志物,从而为精确诊断提供了依据。

克罗恩病(CD)是炎症性肠病(IBD)的一种,是一种慢性肠道疾病,涉及胃肠道的任何部分,以跨壁炎症为特征,全球有350多万人患有这种疾病。多种因素,包括遗传易感性、免疫失调和微生物群紊乱,被认为是CD的驱动因素。然而,CD的病因和病理生理尚不完全清楚。
一般认为炎症性病变最初是在肠黏膜(MUC)引起的,而跨壁炎症可累及CD患者的粘膜下-肌层-浆膜(SMS)。越来越多的证据表明,肠系膜脂肪组织(mesenteric adipose tissue, MAT)、肠系膜(mesentery, MES)和肠系膜淋巴结(mesenteric lymph nodes, MLNs)等肠道附属组织与CD的临床病程和病理生理密切相关。在稳态条件下,肠系膜脂肪组织由多种细胞组成,包括脂肪细胞、纤维细胞、免疫细胞以及庞大的血管和淋巴管网络。然而,CD MES的特点是肠系膜血管充血和水肿,脂肪密度增加,纤维脂肪增生,肠系膜淋巴结病变,结缔组织增厚,炎症细胞和增生性脂肪细胞密集浸润。邻近肠的慢性炎症与脂肪包裹显著相关。
炎症MAT (iMAT)包裹受累肠段并侵入邻近肠道,也被称为“蠕动脂肪”(CrF),是CD的宏观现象,也是促炎细胞因子的重要来源。同样,同时进行部分MES切除术的CD患者术后复发和再手术发生率显著降低。然而,最近的一项研究表明,MAT中细菌联合体的特异性易位促进了CrF的形成,从而阻止了系统性细菌易位并限制了肠道炎症的持续。总的来说,肠道附属组织在CD的发展中出现了有益或有害的双重作用。因此,阐明肠道及其附属组织在治疗和管理CD中的确切作用是至关重要的。
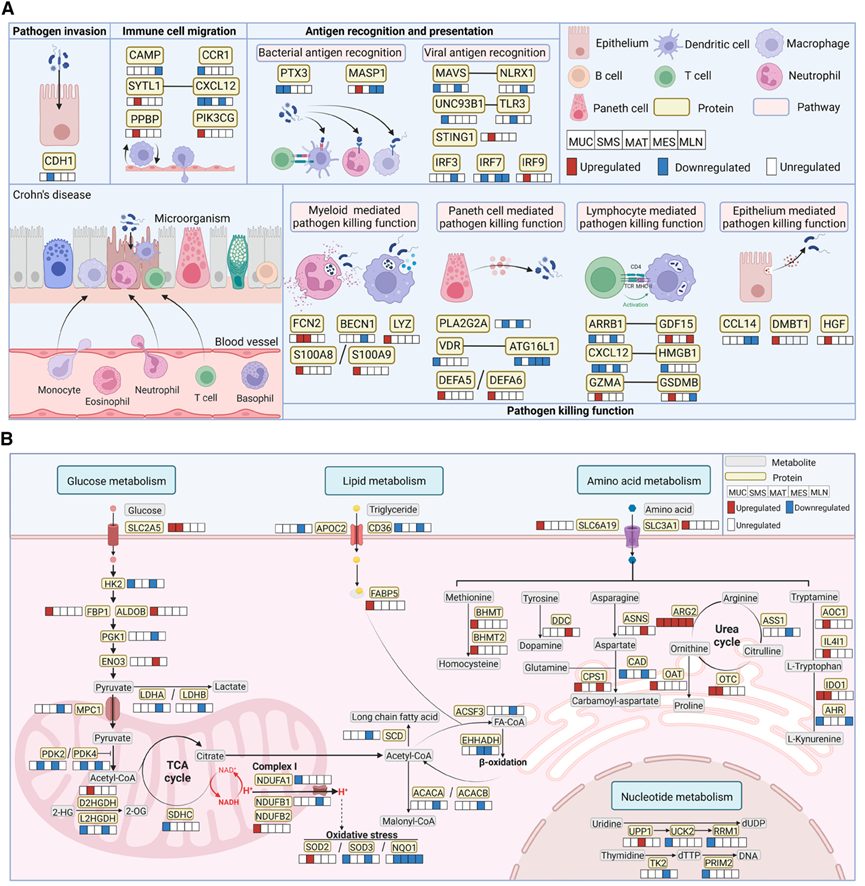
抗微生物免疫和代谢相关蛋白在不同类型的肠道组织中失调(图源自Cell Reports Medicine )
肠道微生物群在CD的发病机制中一直被认为是一个重要的因素。肠道炎症、跨壁炎症和肠道血管屏障受损等危险条件会促进细菌传播到肠道和肠外组织,并进一步促进肠道炎症的发生和持续,但调节细菌传播和肠道炎症的潜在机制尚不清楚。最近,大规模全基因组关联研究(GWASs)已经确定了240多个IBD易感等位基因,这些等位基因与细菌感知和先天免疫有关,特别是CD特异性易感基因。
单细胞RNA测序和宏基因组学在内的多组学分析也揭示了肠道微生物群在CD发病机制中的重要作用。然而,转录组学不能完全剖析乳糜泻期间宿主和肠道微生物群之间的功能相互作用。因此,人们的注意力主要转向蛋白质组学分析,一些研究已经提供了蛋白质水平上对乳糜泻发病机制的深入了解,并在血清、粪便、以及IBD患者的粘膜活检。然而,宿主蛋白质组如何通过肠道和肠外组织与肠道微生物群相互作用仍然是很大程度上未知的;阐明这一点将使人们更好地了解乳糜泻期间细菌传播的潜在机制。
该研究收集了来自30名CD患者的540份组织样本和来自5名非CD对照(NC)的50份组织样本,用于配对组织蛋白质组和微生物组,包括MUC, SMS, MAT, MES和MLN样本。该研究绘制了蛋白质和肠道微生物群的空间分布,并破译了宿主蛋白质组和肠道微生物群在参与疾病发病机制的不同组织之间的相互作用。此外,该研究还观察到宿主蛋白质组(如SAA2、GOLM1、IGFBP2、GBP1和DPP4)和肠道微生物组(如Alistipes、Dialister和链球菌)的明显改变可以在另一组30例CD患者的血清和粪便样本中检测出来,从而为精确诊断和深入了解发病机制提供了组学数据集的基本原理。
原文链接:
https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(23)00164-7#%20
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








好文章,值得一读。
70