【Int J Cance】中国真实世界研究证实强化治疗可改善初治晚期结外NK/T细胞淋巴瘤长期生存
2023-08-17 聊聊血液 聊聊血液 发表于上海
作者回顾性收集了来自中国医学科学院肿瘤医院和北京肿瘤医院的195例新诊断晚期ENKTL患者,以分析临床特征、治疗和预后,旨在为此类患者提供最新的生存数据和有效的治疗方案。
结外NK/T细胞淋巴瘤
结外NK/T细胞淋巴瘤(ENKTL)是一种罕见但独特的非霍奇金淋巴瘤(NHL)亚型,多为早期局限性病变(70%-90%),仅10%-30%的患者表现为晚期病变。对于早期局限性ENKTL,单纯放疗(RT)或联合化疗(CT)大幅改善了生存率,5年总生存率(OS)为50%-80%。但对于晚期患者,目前的治疗方式尤其是综合疗法仍存在一定的不足,5年OS不足20%。
NCCN指南推荐对晚期ENKTL进行多学科综合治疗,包括基于门冬酰胺酶(Aspa)的CT、RT和造血干细胞移植(HSCT)巩固治疗(如适用);首选临床试验,因为尚未就最佳治疗达成共识。既往研究多集中于早期病变,但新诊断晚期ENKTL很少有大样本研究。
《International Journal of Cancer》近日发表一项中国多中心研究,作者回顾性收集了来自中国医学科学院肿瘤医院和北京肿瘤医院的195例新诊断晚期ENKTL患者,以分析临床特征、治疗和预后,旨在为此类患者提供最新的生存数据和有效的治疗方案。共同通讯作者为董梅教授、朱军教授和宋玉琴教授。

研究结果
作者回顾性筛选并收集了中国医学科学院肿瘤医院2005~2020年期间和北京肿瘤医院2010~2020年期间,经病理确诊且接受至少一种治疗的新诊断Ⅲ/Ⅳ期ENKTL患者,收集完整的病历记录和随访数据等。
患者特征
两家中心共2485例PTCL患者,包括1150例ENKTL患者和1335例其他亚型病例;包括948例早期ENKTL患者、7例无病历的患者和195例新诊断III/IV期ENKTL患者。因此,在这两家机构,ENKTL占PTCL的46.3%(1150/2485),17.0%(195/1150)的ENKTL患者在初次诊断时为晚期。
患者基线特征列于表1。男/女为2.31(136/59),中位年龄为44岁;169例(86.7%)患者ECOG评分为0-1分,112例(57.4%)存在至少一种B症状。初诊时Ann Arbor Ⅲ和Ⅳ期患者分别为21例(10.8%)和174例(89.2%)。根据是否存在鼻腔受累,分别将139例(71.3%)和56例(28.7%)患者分为鼻型和非鼻型。141例(72.3%)患者存在淋巴结受累。177例患者行Ki-67染色,其中91例(91/177,51.4%)表达水平超过65%,中位值为50%。117例(60.0%)患者LDH升高。

生存结局和预后
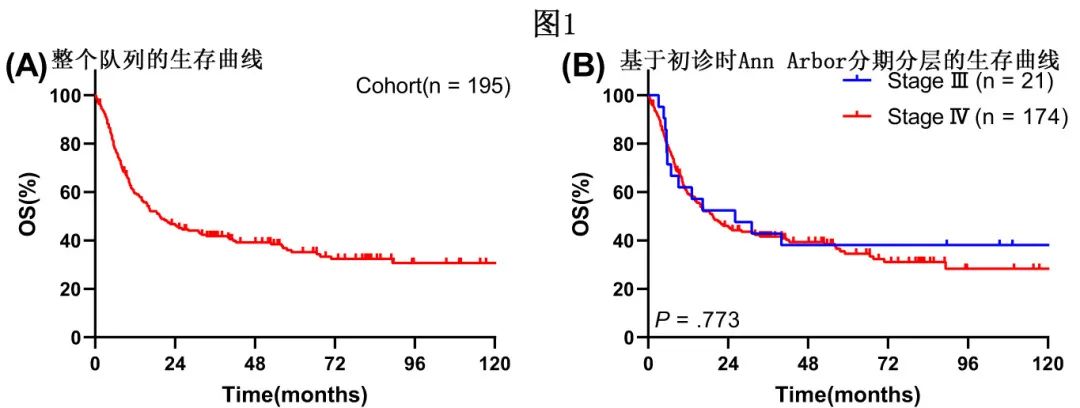
整个队列的生存
中位随访75.03个月,17例(8.7%)患者失访,共有126例(64.6%)患者死于肿瘤复发、进展或相关并发症。25例(12.8%)患者发生噬血细胞综合征,6例(3.1%)发生胃肠道出血。整个队列的中位总生存期(mOS)为19.43个月(图1A),估计的1、2、3和5年OS分别为59.5%、46.3%、41.8%和35.1%;10例患者OS>10年。III期患者(n=21)的估计1、2、3和5年OS率分别为61.9%、52.4%、42.9%和38.1%,mOS为26.07个月;IV期患者(n=174)分别为59.2%、45.5%、41.7%和34.5%,mOS为19.43个月(图1B)。
预后因素
单变量分析显示ECOG评分≥2分(P<0.001)、B症状(P=0.001)和LDH升高(P=0.010)均与OS较差显著相关(表2)。

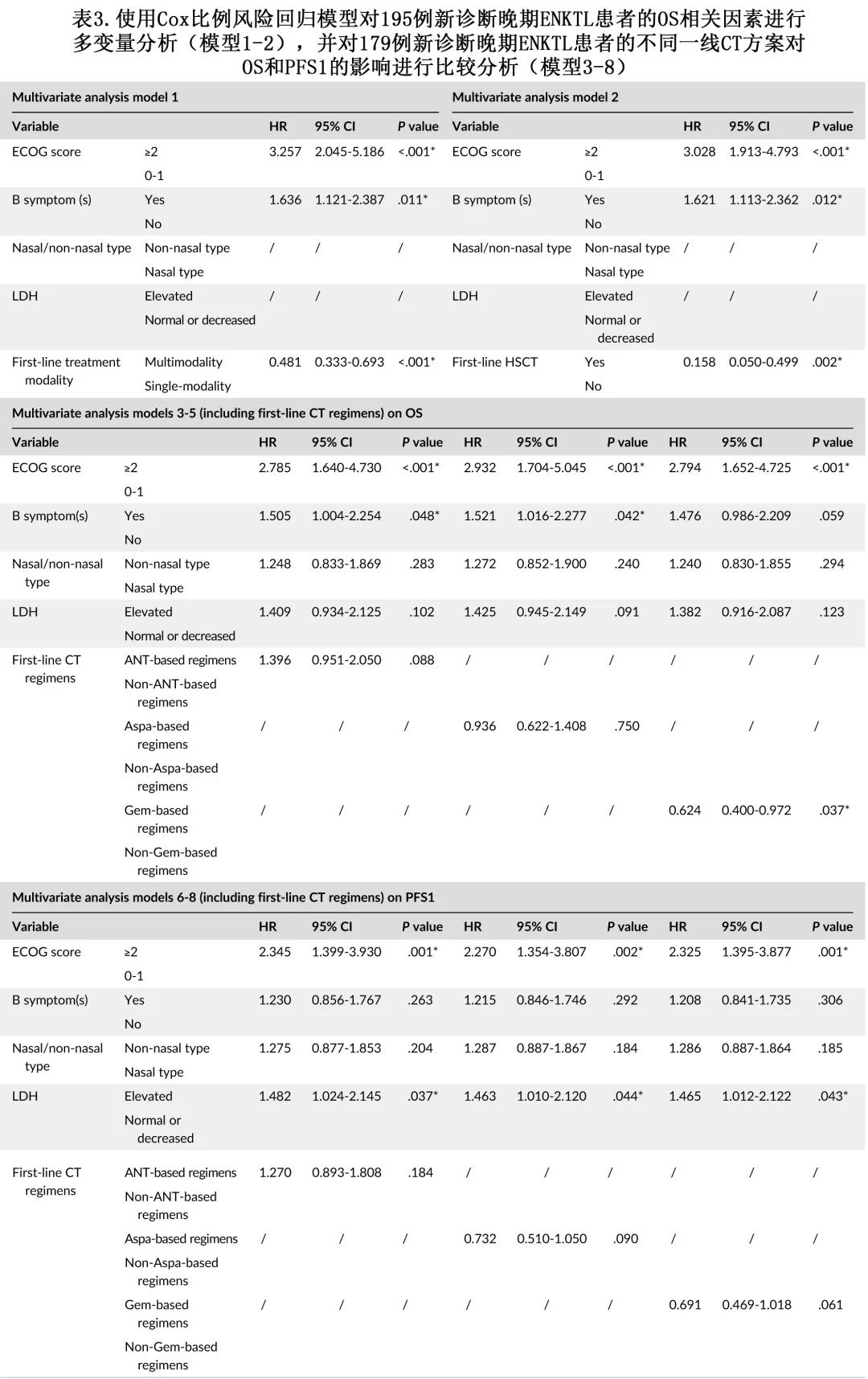
由于一线治疗方式和HSCT均为治疗相关变量,因此不能同时纳入。两种多变量分析模型均发现,ECOG评分≥2分(模型1中HR=3.257,P<0.0001;模型2中HR=3.028,P<0.011)和B症状(模型1中HR=1.636,P=0.011;模型2中HR=1.621,P=0.012)是OS的独立风险因素(表3)。
一线治疗
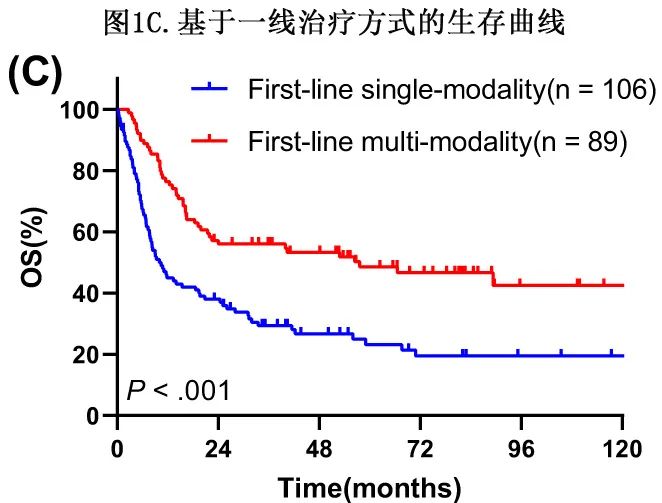
单变量和多变量分析均显示,与单模态治疗(n=106)相比,一线综合治疗(n=89)可显著延长OS(单变量分析中P<0.001;多变量分析中HR=0.481,P<0.001;表2和3;图1C)。
化疗
181例(92.8%)患者应用了一线CT,包括179例CT方案可溯源的患者,随后进行分析。方案包括:COEPL[环磷酰胺+长春新碱+依托泊苷+泼尼松+Aspa(n=41)]、CHOPL[环磷酰胺+蒽环类药物(ANT)+长春新碱+泼尼松+Aspa(n=24)]、CHOP(n=15)、DDGP[吉西他滨(Gem)+地塞米松+顺铂+Aspa(n=15)]、GELOX [Gem+Aspa +奥沙利铂(n=13)]、CHOPE [CHOP+依托泊苷(n=13)]、IDDGP [DDGP+异环磷酰胺(n=11)]、GDP(n=9)、SMILE[类固醇+甲氨蝶呤+异环磷酰胺+Aspa+依托泊苷(n=3)]和其他(n=51)。ANT、Aspa和Gem是三种主流CT药物,分别用于一线治疗的60、123和56例患者。
通过对比分析以评估三种代表性CT药物的生存影响。首先比较了含或不含三种药物的不同方案之间的OS。ANT为基础方案(n=60)的OS劣于非ANT为基础方案(n=119)(mOS:11.80 vs 31.07个月,2年OS:36.7% vs 53.3%,P=0.010;图2A);而Gem为基础方案(n=56)的OS优于非Gem方案(n=123)(mOS:70.90 vs 15.67个月,2年OS:65.0% vs 39.8%,P=0.003;图2C)。Aspa为基础的治疗方案(n=123)最常用,但与非Aspa方案(n=56)相比,未显著改善OS(mOS:25.13 vs 13.37个月,2年OS:51.5% vs 39.3%,P=0.086;图2B)。
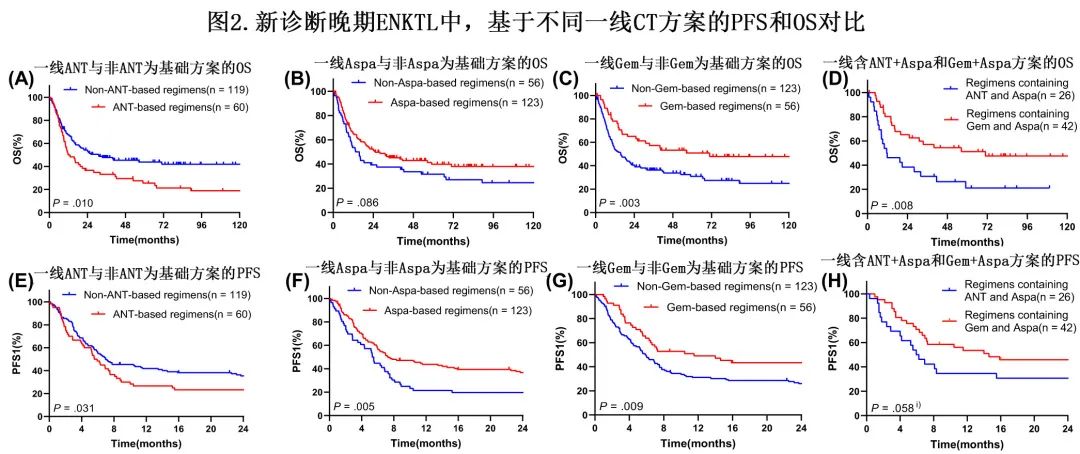
多变量分析显示,与非Gem为基础治疗方案相比,Gem可显著改善OS(HR=0.624,P=0.037;表3),而ANT对比非ANT方案(HR=1.396,P=0.088)及Aspavs对比非Aspa方案(HR=0.936,P=0.750)无统计学显著性。由于某些方案包括这些药物的联合治疗,进一步探索了双联和单药之间的生存差异。ANT+Aspa联合治疗(n=26)的OS略短于ANT(n=34)或Aspa(n=56)单药治疗(mOS:11.53 vs 13.07 vs 21.87个月;成对比较分别为P=0.822,P=0.204和P=0.228);Gem+Aspa组合(n=42)的OS略优于Gem(n=14)或Aspa(n=56)单药(mOS:70.90 vs 40.37 vs 21.87个月;成对比较分别为P=0.813,P=0.151和P=0.534)。比较两种类型的双重组合发现,Gem+Aspa组OS显著优于ANT+Aspa组(mOS:70.90 vs 11.53个月,2年OS:65.1% vs 38.5%,P=0.008;图2D)。
随后在一线PFS(PFS1)中进行了对比分析,以明确不同方案的疗效。
首先,非ANT对比ANT方案(中位PFS1 [mPFS1]:6.97 vs 5.57个月,1年PFS:41.8% vs 26.7%,P=0.031;图2E)、Aspa对比非Aspa方案(mPFS1:7.27 vs 5.33个月,1年PFS:43.7% vs 21.4%,P=0.005;图2F)、Gem对比非Gem方案(mPFS1:11.53 vs 5.93个月,1年PFS:49.0% vs 31.1%,P=0.009;图2G)分别显示出显著更优的PFS1。多因素分析显示Gem(HR=0.691,P=0.061;表3)和Aspa为基础方案(HR=0.732,P=0.090)分别较对应方案有改善PFS1的趋势。
其次,ANT+Aspa组、单纯ANT组和单纯Aspa组的PFS1未见统计学意义(mPFS1:5.93 vs 5.33 vs 6.03个月,成对比较分别为P=0.369,P=0.589和P=0.096);Gem+Aspa组、Gem单药组和Aspa单药组也无统计学显著差异(mPFS1:14.60 vs 5.30 vs 6.03个月,成对比较分别为P=0.210,P=0.116和P=0.975)。
第三,ANT+Aspa和Gem+Aspa组之间的PFS1差异具有临界显著性(mPFS1:5.93 vs 14.60个月,1年PFS:34.6% vs 53.5%,P=0.058[对数秩检验]和P=0.036[Breslow检验];图2H)。除了小样本量可能导致这种临界显著性外,还分析了疾病进展患者的二线治疗,以更好地解释OS和PFS1的差异。ANT+Aspa组21/26例患者疾病进展,14例随后接受二线治疗,其中单纯CT 11例,单纯RT、CT+RT和CT+免疫治疗(IT)各1例;Gem+Aspa组26/42例患者疾病进展,18例接受二线治疗,包括2例单纯最佳支持治疗(BSC)、6例单纯CT、3例单纯靶向治疗(TT)/IT、1例CT+异基因HSCT(allo-HSCT)、4例TT+CT/IT和2例RT+CT/IT。这两个亚组的二线PFS(PFS2)存在显著差异,一线Gem+Aspa组和ANT+Aspa组的中位PFS2(mPFS2)分别为4.54个月和1.94个月(P=0.026)。此外,一线Gem+Aspa组患者的PFS1+PFS2显著优于一线ANT+Aspa组(PFS1 +PFS2为15.80 vs 5.23个月,P=0.002),对OS差异有显著贡献。
总而言之,含Gem或Aspa的一线CT方案可有助于更优的PFS和OS,而同时含有Gem和Aspa的方案似乎具有最佳的疗效和生存结局。
放疗
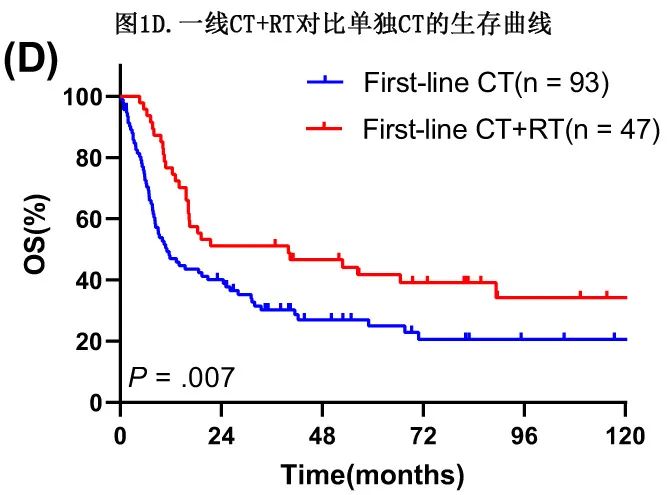
62例(62/195,31.8%)患者接受一线放疗,其中51例接受鼻联合或不联合区域淋巴结放疗。单变量分析显示,CT联合RT(n=47)作为一线治疗较单纯CT(n=93)具有显著更好的OS(mOS:39.97 vs 11.10个月,P=0.007;图1D),表明在CT基础上加用RT可进一步提高晚期患者的生存率。基线特征比较显示各方面差异均无统计学意义(均P>0.05),但单纯CT组接受Aspa为基础方案的患者数量更多(71.0% vs 51.1%,P=0.020),CT+RT组患者具有显著更优的OS。一线RT的常见适应症包括:(a)需要巩固治疗的巨大病灶(直径≥5cm);(b)提示对CT不敏感的中期缓解评估;(c)CT完成后的残留病灶。
造血干细胞移植
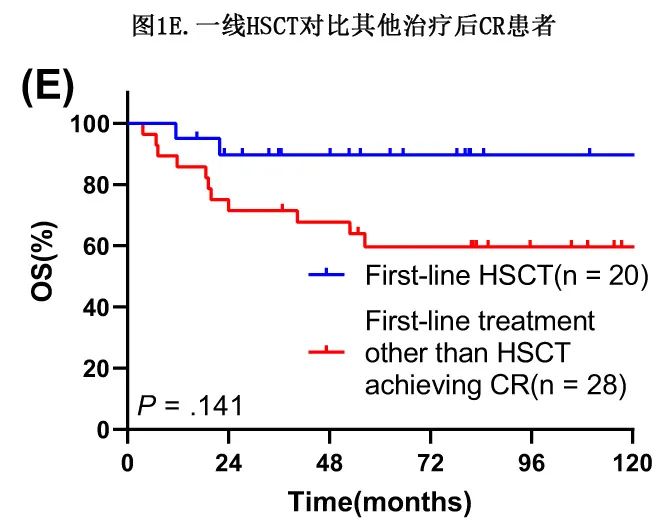
共20例(10.3%)患者接受了一线HSCT,其中19例自体HSCT(auto-HSCT)和1例allo-HSCT。19例患者在首次完全缓解(CR)时接受HSCT,其余1例患者在既往诱导治疗达到部分缓解(PR)后接受auto-HSCT。单变量和多变量分析均证明一线HSCT可显著改善OS(单因素分析中mOS:126.83 vs 15.70个月,P<0.001;多变量分析中HR=0.158,P=0.002;表2和3)。29例(14.9%)患者在整个治疗过程中接受了HSCT,同样显著改善了OS(mOS:126.83 vs 14.03个月,P<0.001;表2)。
考虑到许多患者可能不适合HSCT,作者对比了使用非HSCT方案达到CR的患者(non-HSCT-CR组)与一线治疗中接受HSCT的患者之间的生存差异,结果non-HSCT-CR(n=38)和HSCT(n=20)组的mOS分别为未达到和126.83个月(P=0.160)。基线特征对比显示,除年龄>60岁的患者仅存在于non-HSCT-CR亚组外,两亚组之间无统计学显著差异(P=0.031)。为消除年龄分布的影响,将10例>60岁患者从non-HSCT-CR组排除,结果non-HSCT-CR组剩余患者(n=28)和HSCT组之间的生存结局仍无显著差异(mOS:未达到vs 126.83个月,P=0.141;图1E);HSCT患者表现出OS略好的趋势,但两组之间的基线特征也无显著差异(所有P>0.05)。non-HSCT-CR组的28例患者中有15例患者接受了CT+RT治疗,10例患者接受了单纯CT治疗,2例患者接受了CT+西达本胺维持治疗(MT),1例患者接受了CT+IT治疗,1例患者接受了SG+CT治疗;此外,28例患者中的24例(85.7%)接受了Aspa或Gem为基础的CT。
维持治疗
对于新诊断晚期ENKTL,指南中相对成熟的治疗方案是以门冬酰胺酶为主的化疗±放疗+移植;但由于存在合并症、个人不愿HSCT或费用问题,往往难以坚持推荐方案,因此需要根据患者的身体状况、个人意愿、经济状况以及最重要的诱导治疗结束时疗效评估及时调整。在作者的真实世界临床实践中,部分患者无法遵循既定计划(尤其是HSCT)或在诱导治疗后有残留病变,因此在诱导治疗结束时进行完整评估后接受了西达本胺MT。9例患者曾在一线治疗中接受西达本胺治疗,mPFS1和mOS分别达到53.63和54.80个月;其中4例患者一线使用西达本胺>2年(中位42.5个月),可以认为是西达本胺MT方案,该CT±RT+序贯西达本胺MT的mPFS1为55.83个月,mOS为60.65个月。
新诊断晚期ENKTL中强化治疗的作用
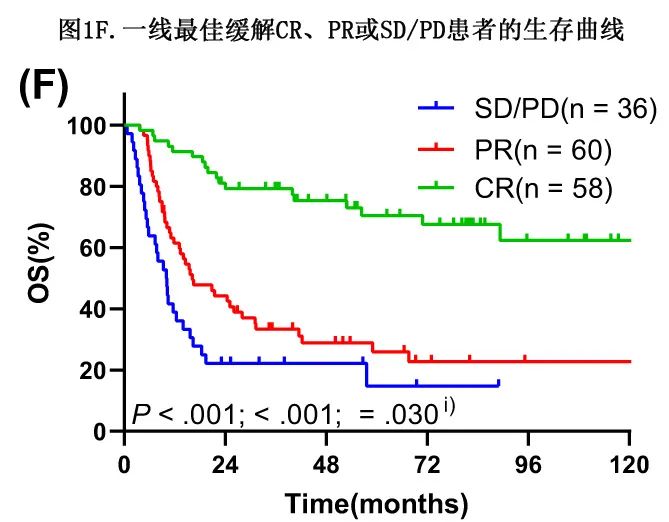
一线治疗分别有58、60和36例患者达到CR(包括CMR)、PR和疾病稳定或进展(SD/PD)。两两比较显示,与PR或SD/PD组相比,CR组的OS显著更优,而PR组的OS显著优于SD/PD组患者(mOS:126.83 vs 16.20 vs 10.00个月;成对比较分别为P<0.001、P<0.001和P=0.030;图1F)。不同治疗反应患者之间基线特征无显著差异(所有P>0.05),进一步证明了强效一线治疗对于改善长期生存的必要性。
基于上述分析,作者总结了新诊断晚期ENKTL一线治疗的四大组成部分——CT、RT、HSCT和西达本胺MT,阐述了它们各自对患者生存的贡献,并首次针对该特定人群引入一线“强化治疗”(图3)。
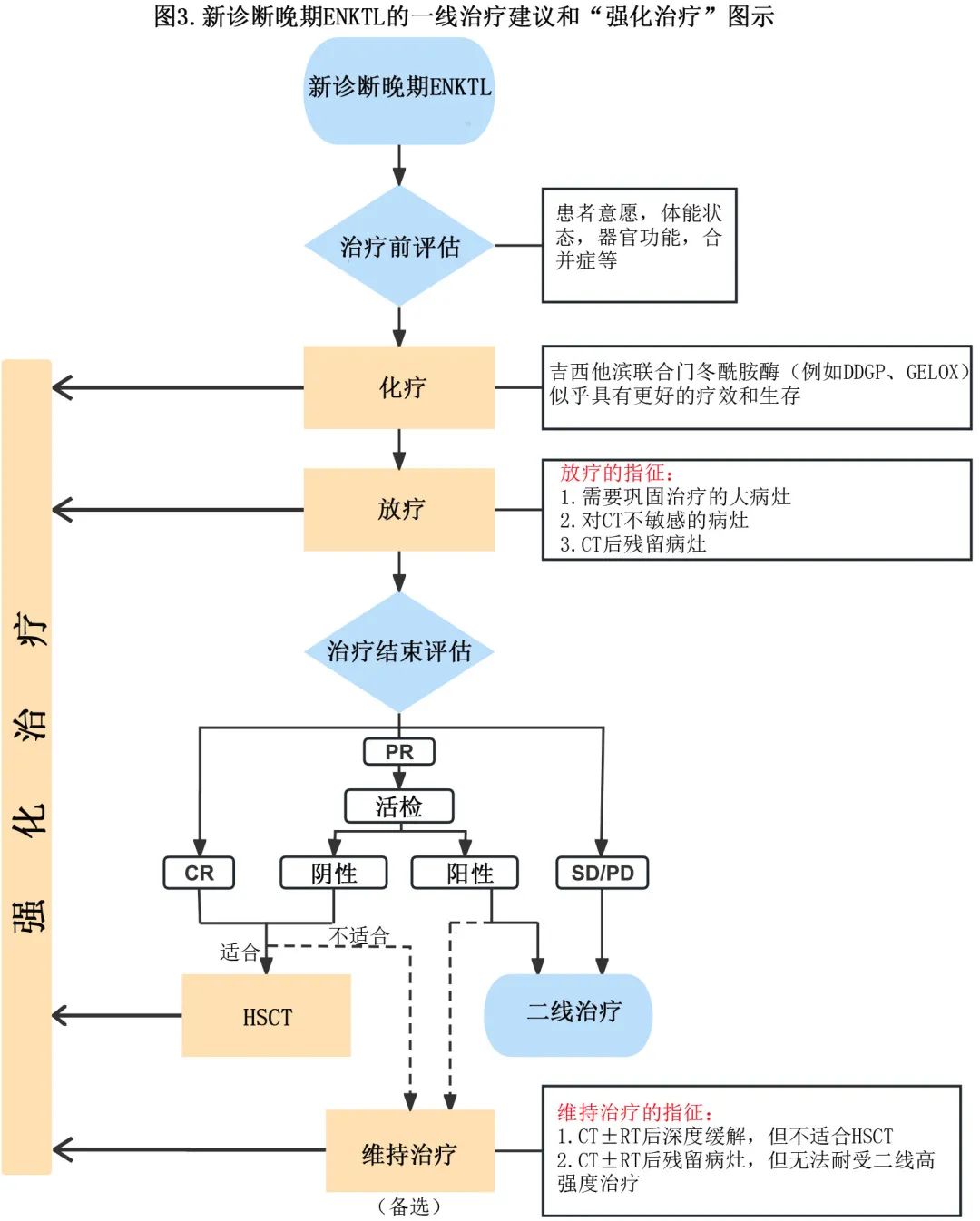
总结
该研究分析了晚期ENKTL的治疗和预后。中位随访75.03个月,195例新诊断III/IV期ENKTL患者的中位总生存期为19.43个月,估计的1年、2年、3年和5年OS分别为59.5%、46.3%、41.8%和35.1%。化疗+放疗对比单纯CT(P=0.007)和造血干细胞移植对比非HSCT(P<0.001)均改善了OS。对于≤60岁且不适合HSCT的患者,其他完全缓解治疗的OS相当(P=0.141)。9例曾接受西达本胺治疗的患者中位无进展生存期和总生存期分别为53.63和54.80个月,其中4例接受西达本胺维持治疗的患者中位无进展生存期和总生存期分别为55.83和60.65个月,可能为非HSCT患者提供备选治疗选择。非蒽环类药物对比蒽环类药物、门冬酰胺酶对比非门冬酰胺酶和吉西他滨对比非吉西他滨为基础方案,均可延长PFS(P=0.031;P=0.005;P=0.009)和OS(P=0.010;P=0.086;P=0.003)。多变量分析显示,吉西他滨为基础的治疗方案可改善PFS(HR=0.691,P=0.061)和OS(HR=0.624,P=0.037)。与含吉西他滨或门冬酰胺酶单药方案相比,吉西他滨+门冬酰胺酶联合治疗可略微改善PFS和OS(P>0.05)。
作者分析了过去10-15年中国新诊断晚期ENKTL患者的临床特征、治疗和预后,并提出了由化疗(尤其是吉西他滨+门冬酰胺酶方案)、放疗、造血干细胞移植和西达本胺维持治疗组成的一线强化治疗方案,可改善晚期ENKTL的长期生存。正在进行的前瞻性临床研究可能进一步揭示西达本胺维持治疗的价值。
此外,作者认为,吉西他滨+门冬酰胺酶方案组合似乎可产生最佳的疗效和生存;当存在体积较大的病灶、对CT不敏感的病灶或CT后残留时,应考虑RT;首选HSCT巩固治疗,其有明显的生存获益;对于初诊时肿瘤负荷高、不适合或不愿意接受HSCT巩固治疗、或治疗结束评估时病灶残留但无法耐受二线CT的晚期患者,可选择西达本胺维持治疗。
参考文献
Wei YC, Qi F, Zheng BM,et al. Intensive therapy can improve long-term survival in newly diagnosed, advanced-stage extranodal NK/T-cell lymphoma: A multi-institutional, real-world study.Int J Cancer . 2023 Aug 4. doi: 10.1002/ijc.34672.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言