FDA:2021年共批准49个新药
2021-12-29 美柏医健 美柏医健
2021年以来,美国食品药品监督管理局(FDA)下设的药审中心(Center for Drug Evaluation and Research, CDER)批准了49个新药(New Molecular
2021年以来,美国食品药品监督管理局(FDA)下设的药审中心(Center for Drug Evaluation and Research, CDER)批准了49个新药(New Molecular Entity和New Therapeutic Biological Product),批准新药数量持续位于高位,显示出全球新药研发态势的持续活跃。我们回顾和盘点FDA年度批准的新药,可以看出当下医药研发的热点、前沿技术的突破方向以及未来新药创新的趋势。这对国内医药企业的研发布局具有一定的启示和借鉴意义。同样,NMPA也批准不少,见:NMPA:2021年获批准上市的创新药
1、FDA年度批准新药数量持续高位运行
全球新药研发进入收获期。随着FDA四大绿色通道(快速通道、优先审评、突破性疗法和加速审批)制度的完善与高效运行,自2017年以来,FDA年度批准新药数量在50个左右,较2016年之前有明显的提升。FDA在2021年度批准新药49个,与近三年接近,处于新药获批数量较高的历史时期。2020年的FDA批准新药数据:【深度盘点】2020年FDA批准53款新药上市,肿瘤药占1/3
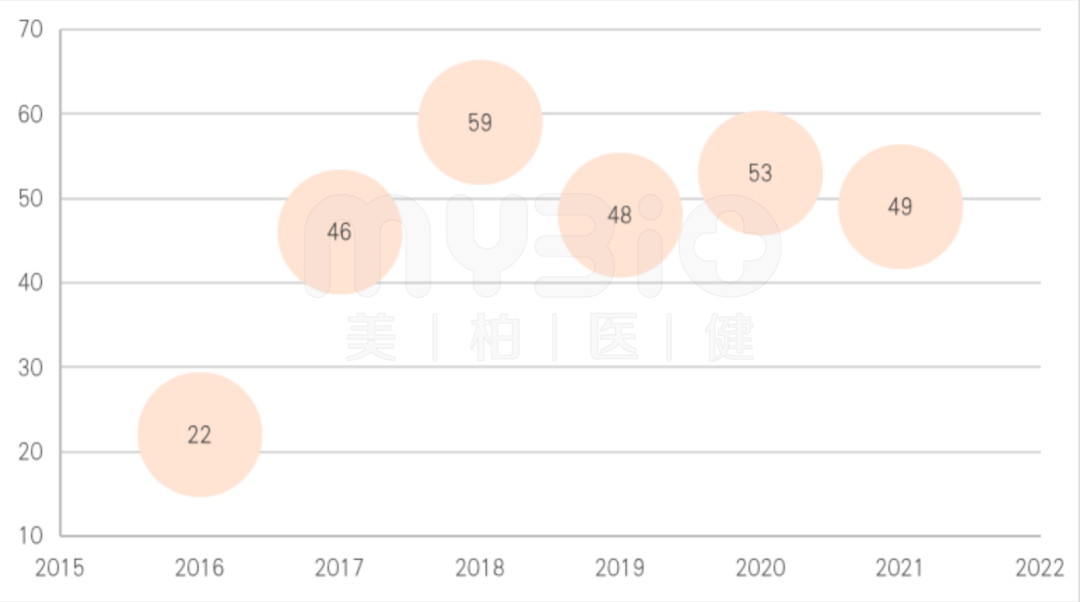
▲图:FDA批准新药数量(个)
数据来源:FDA
2021年FDA批准新药中,小分子产品32个,占比65%;生物制品17个,产品类型多样,包括单抗、双抗、抗体偶连药物、多肽、重组蛋白、酶类、以及RNA药物。随着生物前沿技术的不断突破,创新药物类型将呈现多元化。
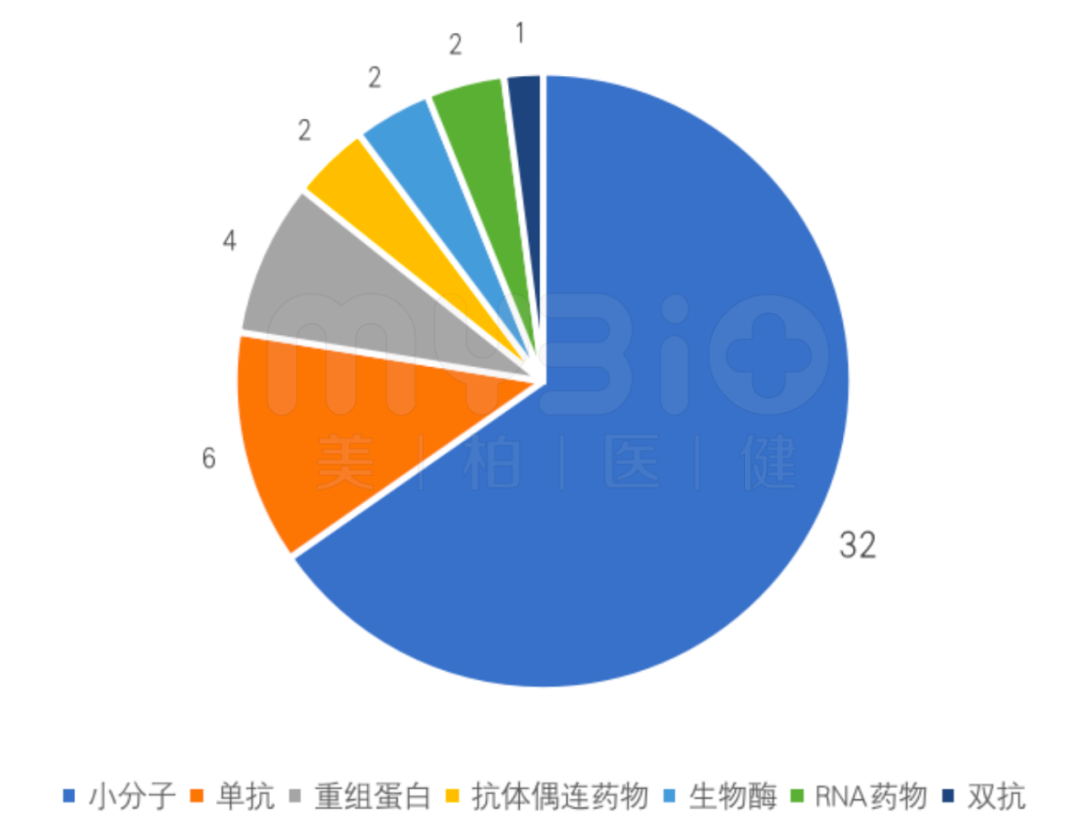
▲图:2021年FDA批准新药类型
数据来源:FDA
3、FDA批准新药创新性引领行业
2021年FDA批准的新药里,“first in class”产品共有24款,占比近50%。很多新药具有里程碑意义。比如,首款KRAS抑制剂获FDA加速批准,治疗非小细胞肺癌;RNAi创新疗法Leqvio,用于治疗胆固醇;重磅药物Aduhelm,用于阿尔茨海默病的治疗。从近几年来看,2021年的“first in class”产品数量处于最高的年份。
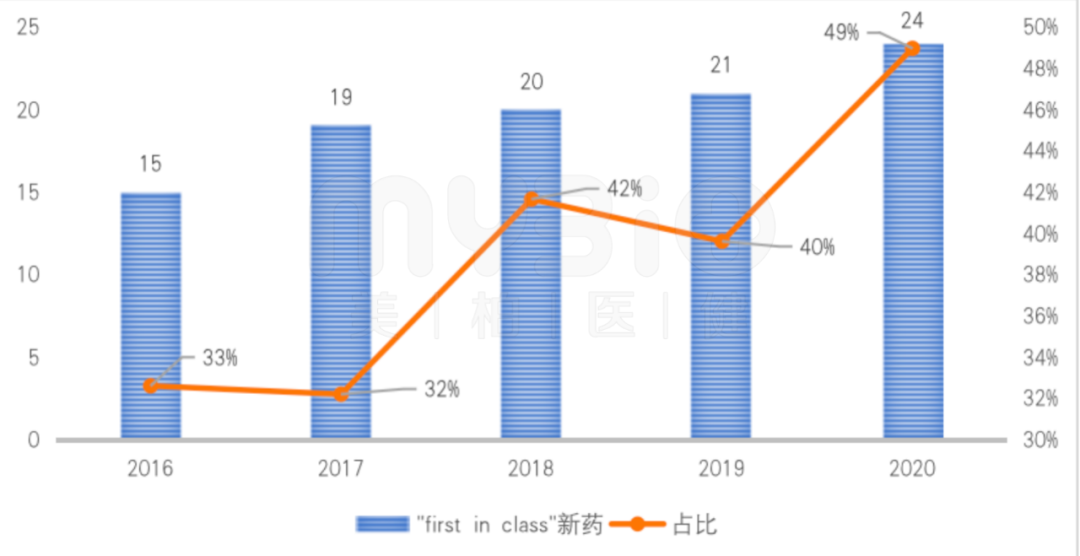
▲图:FDA批准新药中“first in class”产品的情况
数据来源:FDA
2021年FDA批准的新药中,重点聚焦在抗肿瘤和罕见病领域,相关产品数量分别为16个、10个。此外,在慢性病领域、自身免疫性疾病、儿童用药等方面也有一批产品获批。
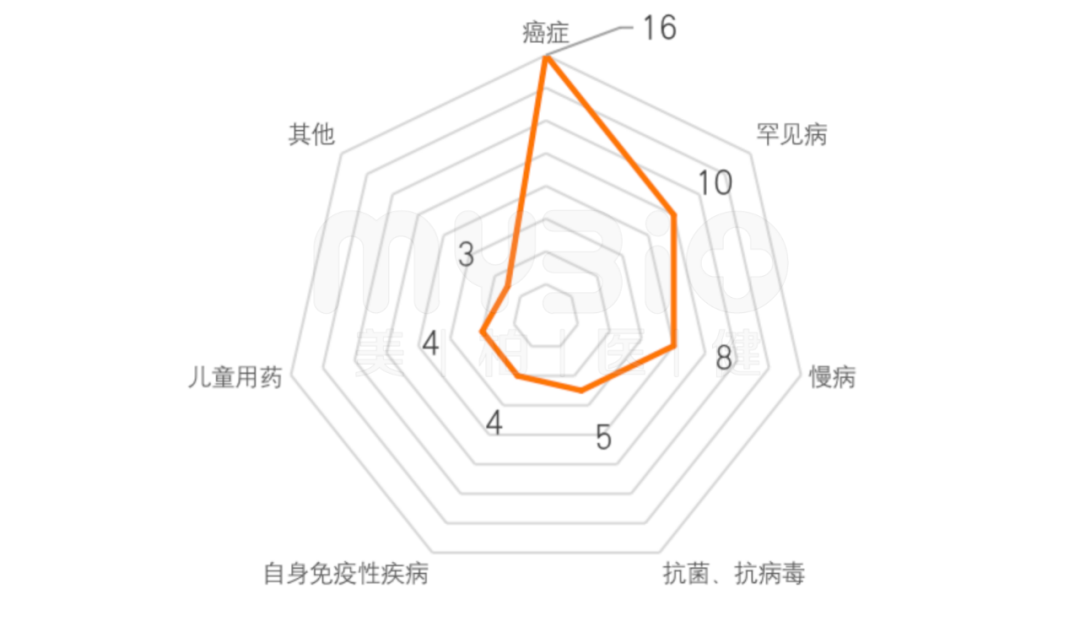
▲图:2021年FDA批准新药适应症领域
数据来源:FDA
5、抗肿瘤新药
在抗癌药物中,有5个是生物制品,10个为小分子,小分子主要为替尼类产品。适应症覆盖广泛,包括非小细胞肺癌、淋巴瘤、骨髓瘤等常见疾病,以及宫颈癌、前列腺癌、卵巢癌、子宫内膜癌等生殖系统肿瘤。此外,FDA批准两款肿瘤细胞显影剂上市。
▲数据来源:FDA
5.1. 首个KRAS抑制剂获批准,用于治疗非小细胞肺癌
2021年5月28日,FDA加速批准Lumakras(Sotorasib)上市。Lumakras是由安进(Amgen)研制的KRAS G12C抑制剂,用于治疗非小细胞肺癌(NSCLC)。在非小细胞肺癌中,大约有25%的患者会出现KRAS基因突变,其中13%为KRAS G12C突变。
FDA加速批准Lumakras是基于一项代号为CodeBreaK 100的I/II期临床研究结果。在既往接受过化疗和/或免疫疗法疾病进展KRAS G12C突变的124例NSCLC患者中,sotorasib达到36%的客观缓解率(ORR),其中58%的患者持续缓解≥6个月。
KRAS基因突变是癌症中最常见的突变之一,发生于约25%的癌症病例中,主要见于肺癌、胰腺癌和结直肠癌,与极差的疾病预后有关。同时,KRAS也是著名的“难成药”靶点,许多项目在这个领域折戟。在经过40多年KRAS突变研究之后,Sotorasib突破重重障碍,成为全球首个成药的KRAS G12C抑制剂,具有里程碑意义。

▲图:Lumakras(Sotorasib)获批上市
5.2. EGFR外显子20插入突变的非小细胞肺癌迎来首个靶向药
2021年5月21日,FDA批准Rybrevant(amivantamab-vmjw)上市,用于EGFR基因外显子20插入突变阳性的转移性非小细胞肺癌(mNSCLC)。据美国癌症协会(ACS)统计,非小细胞肺癌(NSCLC)占肺癌的80%-85%。大约2%-3%的NSCLC患者携带EGFR外显子20插入突变,是第三种最常见的EGFR突变类型。Rybrevant由强生(JNJ)研制,是第一个获批准治疗EGFR外显子20插入突变阳性NSCLC的靶向疗法。
Rybrevant是一种全人EGFR-间质表皮转化因子(MET)双特异性抗体,具有免疫细胞导向活性,靶向携带激活和耐药EGFR及MET突变及扩增的肿瘤。临床表明,在接受Rybrevant治疗的患者中,ORR为40%,中位缓解持续时间(DOR)为11.1个月。在病情缓解的患者中,有63%缓解持续时间≥6个月。

▲图:Rybrevant(amivantamab-vmjw)结构示意
5.3. 首个靶向CD19的抗体偶联药物,治疗大B细胞淋巴瘤(LBCL)
2021年4月23日,FDA批准Zynlonta(loncastuximab tesirine-lpyl)上市,用于治疗已接受过2种或多种系统疗法的复发或难治性(r/r)大B细胞淋巴瘤(LBCL)成人患者。Zynlonta是首个靶向CD19的抗体偶联药物。CD19是一个经验证的治疗B细胞恶性肿瘤的热门靶点。
Zynlonta的活性药物成分为loncastuximab tesirine,这是一种靶向CD19的抗体偶联药物(ADC),由一种人源化抗人CD19单克隆抗体通过连接器与吡咯并苯并二氮杂卓(pyrrolobenzodiazepine,PBD)二聚体细胞毒素偶联而成。
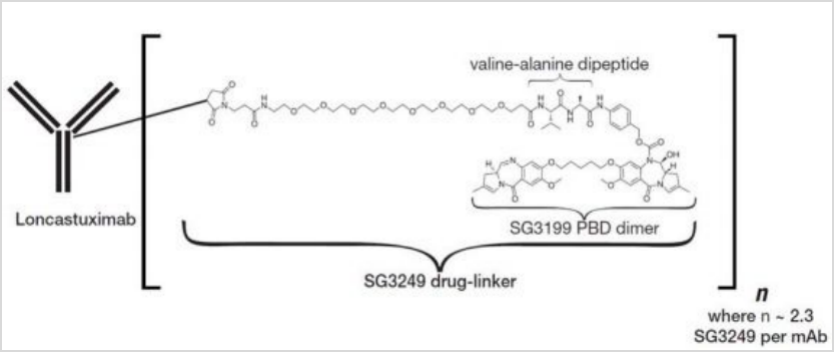
▲图:loncastuximab tesirine分子结构
临床结果显示,Zynlonta单药治疗的客观缓解率(ORR)为48.3%(70/145例)、完全缓解率(CR)为24.1%(35/145例)。在病情缓解的70例患者中,中位缓解持续时间(DOR)为10.3个月。
5.4. 两款手术辅助显影剂获批,助力生殖系统肿瘤精准治疗
2021年5月26日,FDA批准Pylarify(piflufolastat F 18)上市,用于前列腺癌患者精准诊断。Pylarify是一种放射性诊断剂,用于前列腺癌患者前列腺特异性膜抗原(PSMA)阳性病变的正电子发射断层显像(PET)。Pylarify通过静脉进行注射,以PET成像来表明体内组织中是否存在PSMA阳性的前列腺癌病变。临床表明,Pylarify的PET成像的特异性和阳性预测值(PPV)优于常规成像,显示了较高的正确定位和检测率。
▲图:前列腺癌是男性中第二大常见的癌症类型,据世卫组织估计,全球年新增确诊病例约130万,约40万人死亡。
2021年11月29日,FDA批准Cytalux(pafolacianine sodium)上市,用于成年卵巢癌术中识别恶性病变的辅助手段。Cytalux 是一种在术中标记卵巢癌的靶向荧光显像剂,通过静脉注射给药后,与大多数上皮性卵巢癌中过度表达的叶酸受体结合,并在术中近红外光下显像。在接受一剂 Cytalux 并在手术期间在正常光和荧光灯下进行评估的134名女性(33至81岁)中,26.9%的女性至少检测到一个标准视觉或触觉检查未观察到的癌性病变。
▲图:卵巢癌是女性生殖系统癌症中最致命的肿瘤。据美国癌症协会预计,2021 年将有超过 2.1万例卵巢癌新病例和 1.3万死亡病例。
6、罕见病新药
罕见性疾病治疗一向是新药开发的重点。2021年FDA批准的新药中,适应症为罕见性疾病的药品达到9个,数量仅次于治疗癌症的药品,成为第二大治疗领域。家族性高胆固醇、重症肌无力、多发性硬化症、庞贝病等一批罕见性疾病迎来新的治疗方法。
表2 2021年FDA批准的罕见病治疗新药
6.1. 首个外显子45跳跃型杜氏肌营养不良寡核苷酸疗法
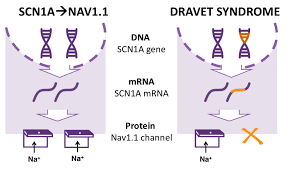
2021年2月25日,FDA批准Sarepta Therapeutics公司研发的反义寡核苷酸疗法Amondys45(casimersen)上市,用于治疗基因突变外显子45跳跃型的杜氏肌营养不良症患者。杜氏肌营养不良症(DMD)是一种罕见的致命神经肌肉遗传病,是最常见的肌肉营养不良类型。
Amondys 45是首个针对外显子45跳跃型的DMD治疗药物,成为继Exondys 51(eteplirsen)、Vyondys 53(golodirsen)之后,第3个在美国获批的RNA外显子跳跃突变DMD的反义寡核苷酸疗法。反义寡核苷酸疗法包含一小段核苷酸序列,它们通过与mRNA前体的特定序列结合,改变mRNA的剪接过程。
▲图:Amondys 45(casimersen)获批上市
6.2. 庞贝病迎来高效酶替代疗法
2021年8月6日,FDA批准创新酶替代疗法Nexviazyme(avalglucosidase alfa-ngpt)上市,用于治疗1岁及以上的晚发性庞贝病(LOPD)患者。
Nexviazyme是一种酶替代疗法(ERT),是特异性靶向细胞摄取的关键途径甘露糖-6-磷酸(M6P)受体,该受体主要负责将GAA酶转运到细胞内溶酶体。Nexviazyme靶向M6P的独特设计,不仅提高了细胞对酶的摄取,还能有效的清除肌细胞中的糖原积聚。与标准治疗α-葡萄糖苷酶相比,Nexviazyme的M6P含量增加了约15倍。在关键3期COMET临床试验中,100名晚发性庞贝病患者随机接受Nexviazyme和标准疗法。Nexviazyme不仅能改善患者的呼吸功能和步行距离,而且安全性良好,为庞贝病患者带来了一种新的酶替代疗法选择。
庞贝病,又名糖原贮积病Ⅱ型(Pompe病)或酸性麦芽糖酶缺乏症(AMD),主要是由体内酸性α-葡萄糖苷酶(GAA)的遗传缺陷或功能障碍引起的,导致全身肌肉细胞中糖原的积累。糖原的积累会对肌肉造成不可逆转的损害,该病的主要症状表现是全身的肌肉无力,严重影响人的行动、呼吸等功能。
▲图:创新酶替代疗法Nexviazyme(avalglucosidase alfa-ngpt)获批上市
6.3. 创新疗法S1P1调节剂用于多发性硬化症治疗
2021年3月18日,FDA批准Ponvory(ponesimod)上市,用于治疗复发型多发性硬化症(MS)成人患者。Ponvory由强生(JNJ)旗下杨森制药研制,是一种选择性鞘氨醇-1-磷酸受体1(S1P1)调节剂,可功能性抑制S1P蛋白的活性,并将淋巴细胞束缚在淋巴结内,从而减少可穿过血脑屏障的循环淋巴细胞的数量。
目前,美国有近100万多发性硬化症(MS)成人患者,约85%在最初诊断时确诊为复发型MS。尽管近年来已取得了进展,但该领域仍然存在着未满足的医疗需求。目前,鞘氨醇-1-磷酸(S1P)受体已成为MS领域新药研发的一个重要靶点。Ponvory的批准上市,将为患者提供一个重要的新口服药物。与市面上的口服MS药物Aubagio(teriflunomide,特立氟胺)相比,Ponvory在降低年复发率方面显示出优越疗效(年复发率减少近三分之一),而且已有超过10年的累积临床研究数据证明了其有效性和安全性。
▲图:Ponvory(ponesimod)获批上市
6.4. 首个新生儿Fc受体(FcRn)阻断剂获批,用于治疗重症肌无力
2021年12月17日,FDA批准Vyvgart(efgartigimod alfa-fcab)上市,用于治疗抗乙酰胆碱受体抗体阳性的全身性重症肌无力患者。Vyvgart由Argenx公司研发,是FDA批准的首个新生儿Fc受体阻断剂。
Vyvgart通过与新生儿Fc受体(FcRn)结合,阻止FcRn将免疫球蛋白G(IgG)再循环回血液中。临床表明,在接受Vyvgart第一个治疗周期内,68%乙酰胆碱受体抗体阳性全身型重症肌无力(gMG)患者的日常生活评分应答率为68%,安慰剂组的应答率为30%。
全身性重症肌无力(gMG)是一种罕见的、慢性自身免疫性疾病。免疫球蛋白G(IgG)抗体会破坏神经和肌肉的沟通,引起虚弱和可能危及生命的肌无力。根据GlobeNewswire的报道,全球重症肌无力药物市场规模在2020年估计约为13亿美元,预计到2027年将达到23亿美元。2021年1月,再鼎医药与Argenx公司达成合作,宣布获得这款创新静脉注射液在大中华区的开发和商业化权益。
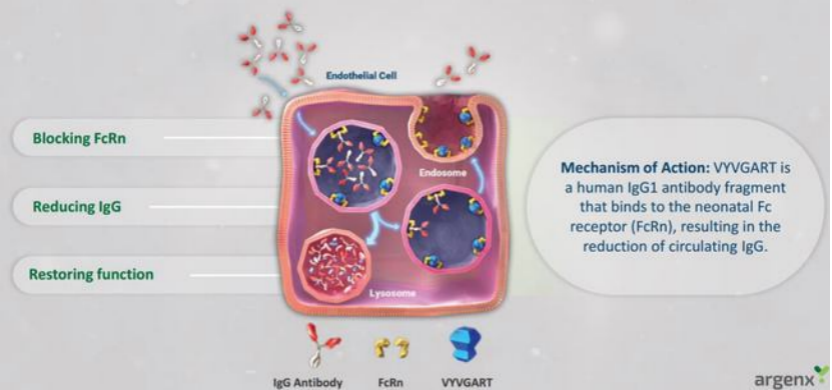
▲图:Vyvgart作用机制示意图
7、慢病新药
2021年,FDA批准多款治疗治疗慢性疾病的新药,为慢性病的治疗与预防提供了新的选择。这些新药治疗领域涉及高血脂、哮喘、与糖尿病相关的肾脏疾病、老年痴呆以及心脑血管疾病等。
表3 2021年FDA批准的慢病治疗新药
7.1. 首个用于降低低密度脂蛋白胆固醇(LDL-C)的小干扰RNA(siRNA)药物上市
2021年12月22日,FDA批准Leqvio(Inclisiran)上市,用于治疗杂合子家族性高胆固醇血症或临床动脉粥样硬化性心血管疾病。Inclisiran是一种首创的siRNA药物,与编码PCSK9蛋白的mRNA结合,通过RNA干扰作用降低mRNA的水平、阻止肝脏产生PCSK9蛋白,从而增强肝脏从血液中清除LDL-C的能力,实现降低LDL-C水平的目的。
目前,心血管疾病仍是全世界人类首要的死亡因素,其中,起动脉粥样硬化性心血管疾病(ASCVD)约占所有心血管疾病死亡的85%以上。心血管疾病的治疗以他汀类药物为主,但80%的高危患者仍无法达到指南推荐的LDL-C最佳水平。目前已有多款PCSK9抑制剂获FDA批准,但Inclisiran的优势在于首次注射后,患者只需每年接受2次皮下注射就可控制胆固醇水平,多了一种非常便捷的治疗选择。
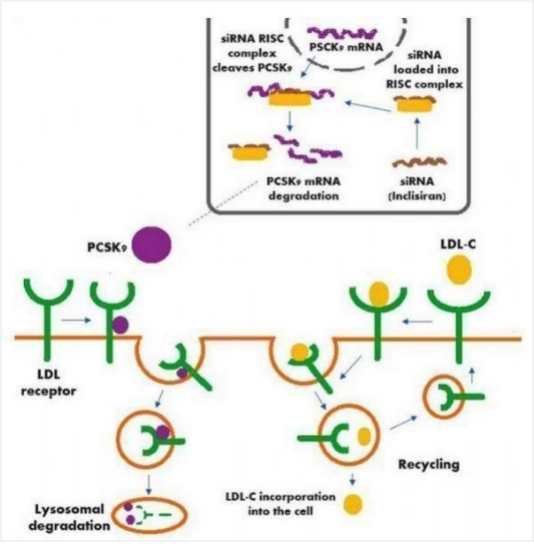
▲图:Leqvio作用机制示意图
7.2. 相隔近20年,FDA再批准阿尔茨海默病治疗创新药上市
2021年6月7日,FDA批准Aduhelm(aducanumab-avwa)上市,用于治疗早期阿尔茨海默病(AD)患者。Aduhelm由渤健(Biogen)和卫材(Eisai)株式会社联合研制,是一种高亲和力、靶向-Aβ构象表位的全人IgG1单克隆抗体。它能够有选择性地与AD患者大脑中的淀粉样蛋白沉积结合,然后通过激活免疫系统,将大脑中的沉积蛋白清除。
Aduhelm是自2003年以来FDA批准的首个治疗AD(老年痴呆)的新药,也是目前首个通过减少大脑中的淀粉样蛋白沉积来解决该疾病的明确病理的阿尔茨海默病(老年痴呆)的治疗方法。根据临床数据,aducanumab治疗的AD患者在第78周的认知能力评分(CDR-SB)与对照组相比显著降低了23%,到达了主要终点。
2007年11月,渤健(Biogen)从Neurimmune获得Aducanumab的研发许可。2017年10月起,渤健(Biogen)和卫材(Eisai)在全球合作开发和商业化Aducanumab。在美国,渤健(Biogen)公司设定Aduhelm(aducanumab-avwa)的上市价格为5.6万美元/年。
阿尔茨海默病(Alzheimer ′s disease,AD)是老年期痴呆最常见的一种类型,以进行性发展的神经系统变性为特征,是导致老年人失能的重要原因。该疾病可造成思维、记忆和独立性受损,导致患者过早死亡。根据世界卫生组织(WHO)公布数据,全球有数千万例AD患者,未来几年这个数字还将增长。
▲图:Aduhelm(aducanumab-avwa)获批上市
7.3. 首创TSLP靶向单抗,治疗哮喘疾病
2021年12月17日,FDA批准Tezspire(tezepelumab-ekko)上市,用于12岁及以上患有严重哮喘的成人和儿童患者的附加维持治疗。Tezspire由安进和阿斯利康联合研制,是治疗严重哮喘的一款首创(first-in-class)抗胸腺间质淋巴细胞生成素(TSLP)单克隆抗体药物,通过阻断TSLP在炎症级联反应的顶端发挥作用。TSLP是一种针对促炎性刺激(例如肺内过敏原、病毒及其他病原体)产生的上皮细胞因子,在气道炎症的发生和持续中起着关键作用。由于作用于炎症级联反应的早期上游,tezepelumab可能适用于广泛的重度不受控哮喘患者。
全世界约有3400万人受严重哮喘疾病影响。由于严重哮喘的复杂性,尽管接受了标准护理吸入药物、目前可用的生物疗法以及口服皮质类固醇(OCS),许多严重哮喘患者仍会继续经历症状和频繁的恶化。Tezspire有潜力改变目前服务不足的广大严重哮喘患者群体的治疗现状。
Tezspire的批准上市,或将在哮喘治疗领域掀起一场变革,其治疗人群大于目前已上市的生物疗法,包括葛兰素史克(GSK)的Nucala(mepolizumab,靶向IL-5),梯瓦的Cinqair(reslizumab,靶向IL-5),以及目前正在开发治疗哮喘的生物疗法,例如阿斯利康自己的benralizumab(靶向IL-5受体α亚基[IL-5Rα])以及赛诺菲的Dupixent(靶向IL-4/IL-13),所有这4种疗法仅靶向于驱动哮喘炎症的特定炎性分子,只适合某些类型的重症哮喘患者。
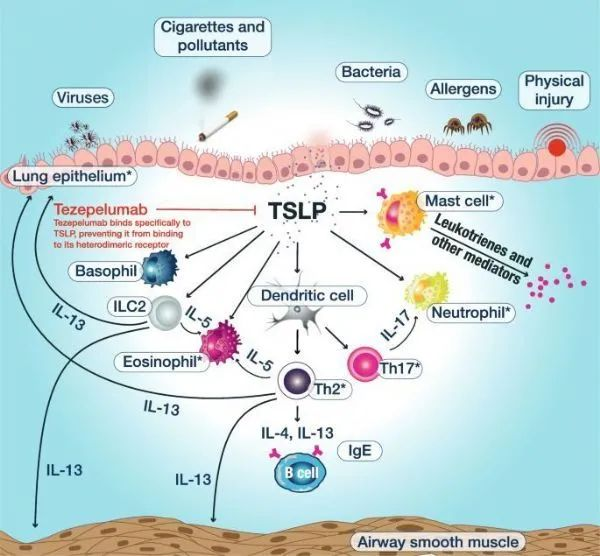
▲图:tezepelumab作用机制
8、结语
FDA年度批准新药是生物医药产业发展的风向标。在2021年上市的新药中,适应症聚焦癌症、罕见病、慢病等临床未被满足领域,成为创新疗法开发的主赛道;此外,我们也看到针对自身免疫性疾病、儿童用药等领域的创新开拓。越来越多的新技术从实验室走向临床一线,双抗、抗体偶联药物、肽偶连药物、反义寡核苷酸疗法、生物酶替代等前沿技术已经从概念走向了产业化实践,这将重塑未来医药产业竞争的格局。无论技术如何更迭,以临床价值为核心的药品开发理念,以安全、有效、可及为原则的新药开发目标一直被奉为圭臬。
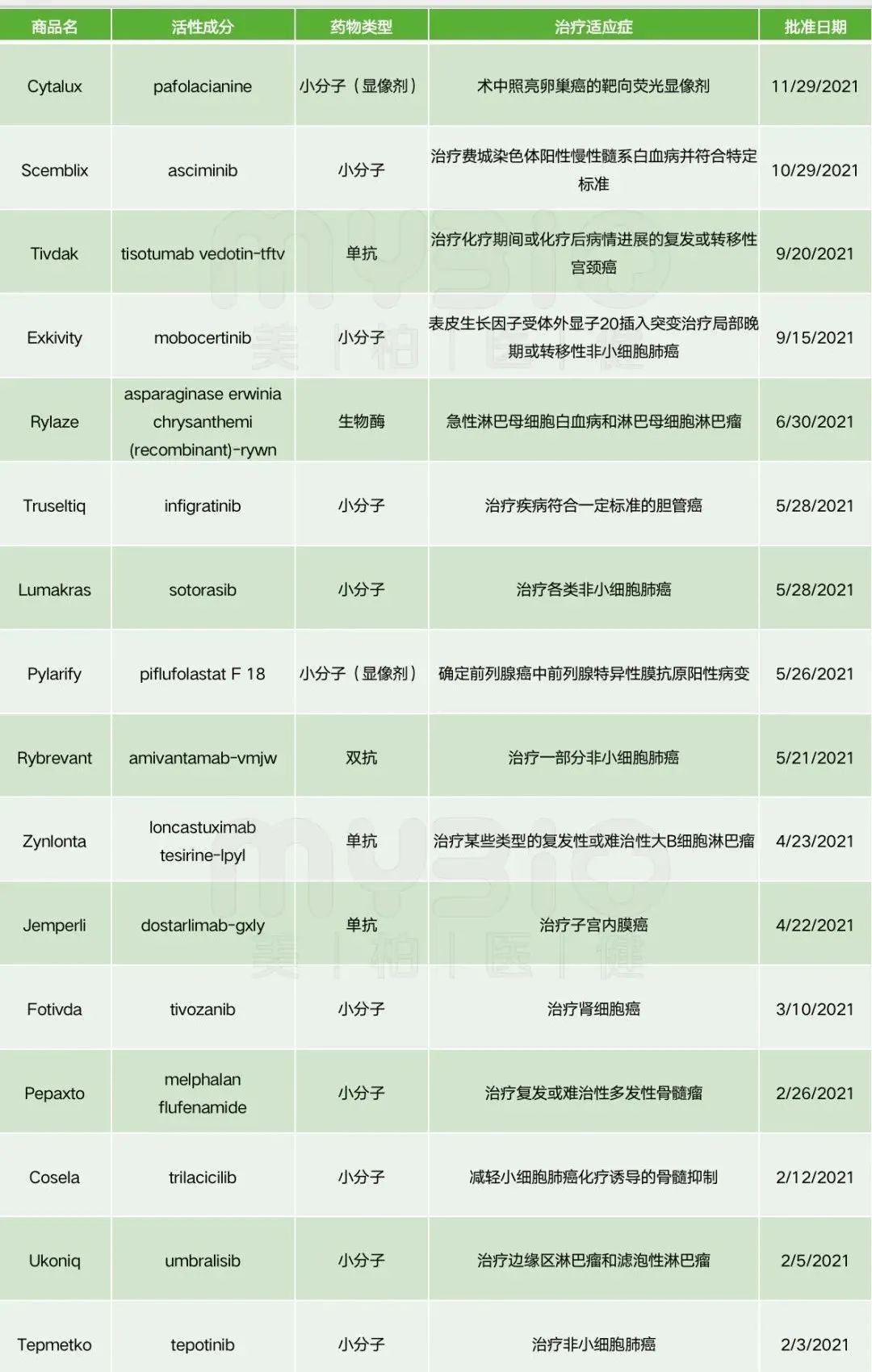
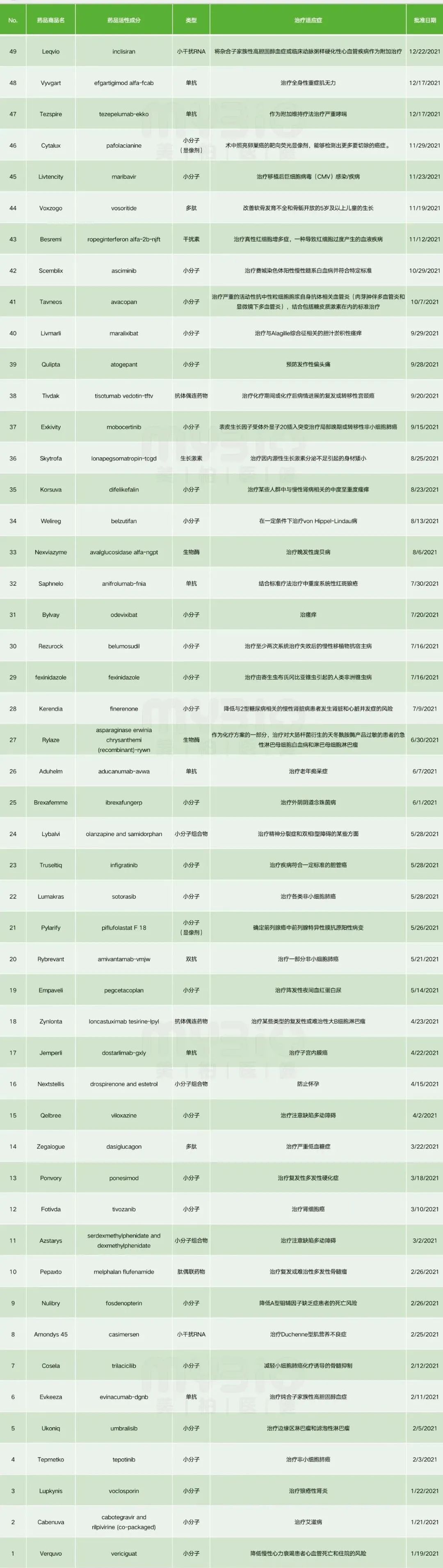
附件:2021年FDA批准新药清单
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






.jpg)




学习
90
#FDA#
138