黄芪-红花如何神奇逆转脑缺血/再灌注损伤:空间代谢组学的惊人发现!
2024-08-20 梅斯循证中医药 MedSci原创 发表于上海
文章揭示了CIRI在系统和微区水平的特定代谢重编程并阐明了AC的治疗机制。
脑缺血/再灌注损伤(CIRI)能够引发严重神经功能障碍,而代谢紊乱是CIRI最突出的特征,会影响神经损伤的严重程度和预后,现有的预防和治疗策略仍有限。中枢神经系统(CNS)涉及多个相互连接且交互作用的微区,其内源性代谢物表现出区域特异性,因此,理解不同微区的代谢特征对于阐明CIRI的病理机制及开发有效治疗策略至关重要。
黄芪(Astragalus membranaceus)和红花(Carthamus tinctorius)(下文简称AC)有益气活血之效,现代研究表明二者具备增强免疫、抗炎和抗氧化等特性,被广泛用于改善血液循环、减轻氧化应激以及促进脑缺血恢复等,然而,对于AC的代谢调控机制研究尚不充分。
日前,一篇名为“Efficacy of Astragalus membranaceus - Carthamus tinctorius in cerebral ischemia/reperfusion injury: Insights from metabolomics and mass spectrometry imaging”的文章揭示了CIRI在系统和微区水平的特定代谢重编程并阐明了AC的治疗机制。

图1 论文首页
研究方法
研究者基于大脑中动脉闭塞(MCAO)模型建立了CIRI大鼠模型,并分成假手术组(Sham)、模型组(R)、尼莫地平组(Nim)、高剂量AC组(H-AC)、中剂量AC组(M-AC)和低剂量AC组(L-AC)。通过HE染色、尼氏染色和免疫荧光染色观察微观变化。同时,为了解决传统代谢组学在评估脑微区方面的局限性,研究者采用了空间代谢组学(AFADESI-MSI)这一新兴技术,其优势在于保持代谢物原始状态的同时,还提供了高空间分辨率的代谢视图,对血清、脑组织和微区进行了全面的代谢组学研究,以确定CIRI涉及的关键代谢途径以及代谢物,并了解它们在微区的空间分布。研究者还进行了神经系统评估、脑梗塞测量和伊文斯蓝染色,以评估AC对系统和局部代谢的影响。
AC对CIRI具有确切的治疗效果
结果显示,Nim、H-AC和M-AC显著改善了神经功能缺损评分(图2A)。TTC染色结果则确定了各组脑梗塞面积情况(图2B-C),其中H-AC、M-AC和Nim组的梗死面积明显减小。此外,伊文斯蓝染色结果表明,H-AC、M-AC和Nim组则对BBB具有一定保护作用(图2D)。
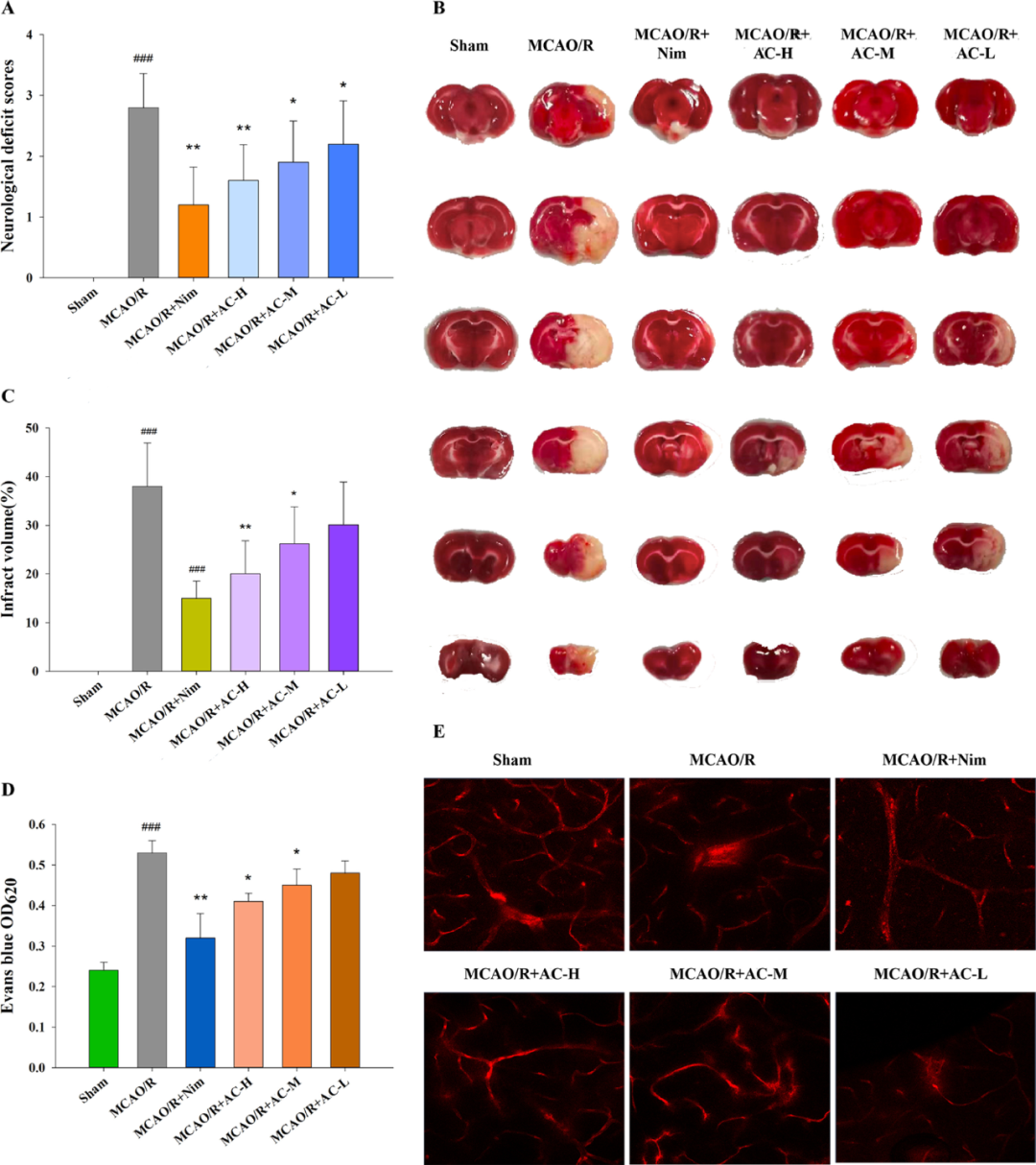
图2 AC对CIRI的药效作用
图3可见MCAO/R组大脑皮层(CTX)、海马体(HP)、尾状壳核(CP)、丘脑(TH)、小脑皮层(CBC)和纤维束(FT)均产生大量空泡和细胞核收缩,其完整的组织结构有所损伤,而H-AC、M-AC和Nim可缓解CIRI诱导的组织病理学变化。
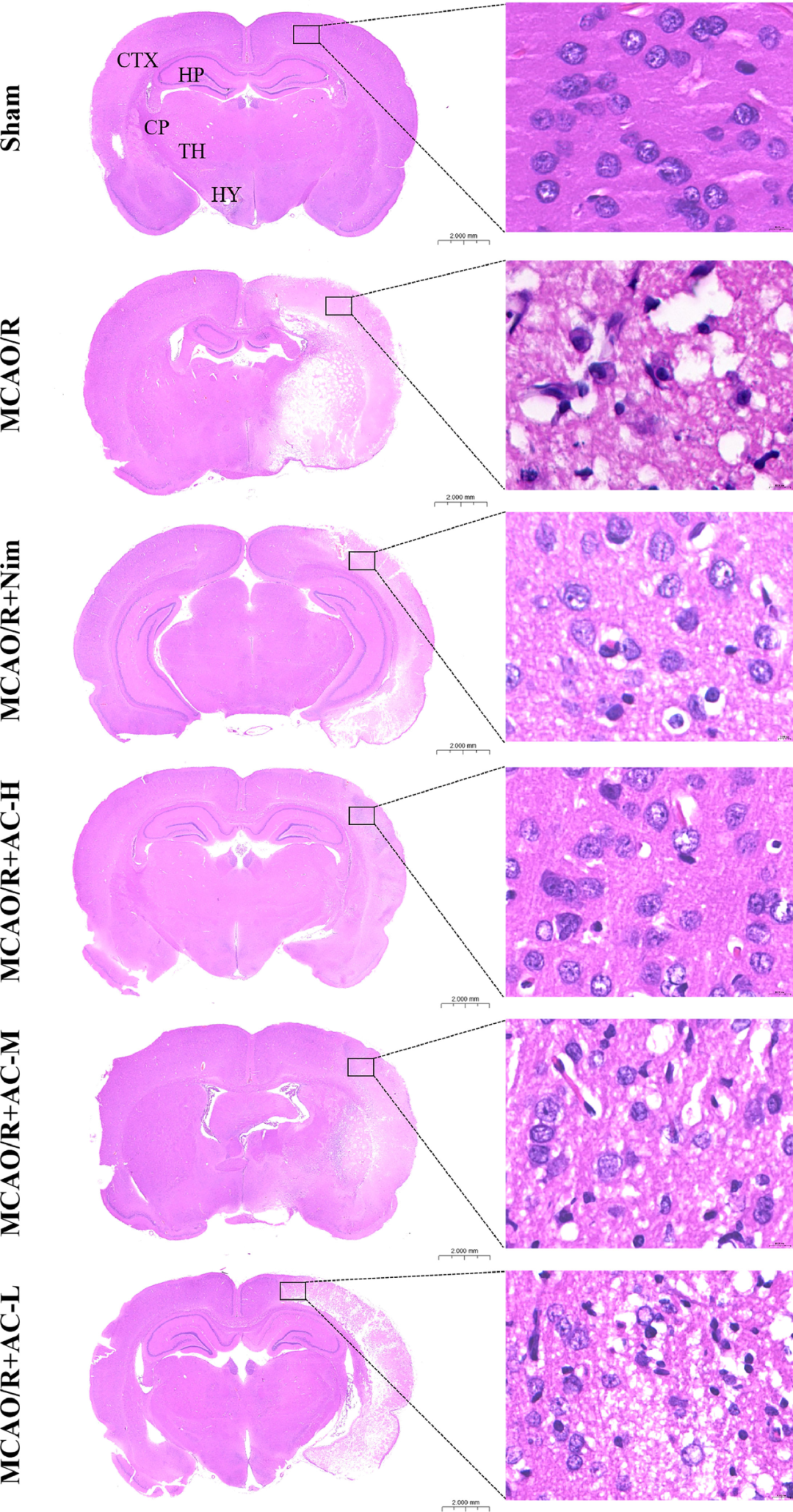
图3 各组脑HE染色
整合LC-MS以及AFADESI-MSI的代谢组学分析结果
代谢组学研究表明,CIRI是由局部失调所引发全身代谢失衡。基于液质联用(LC-MS)以及AFADESI-MSI,研究者确定了AC处理后发生显着改变的潜在生物标志物,血清、组织和脑微区的分别为20个、4个和16个(图4、图5B)。
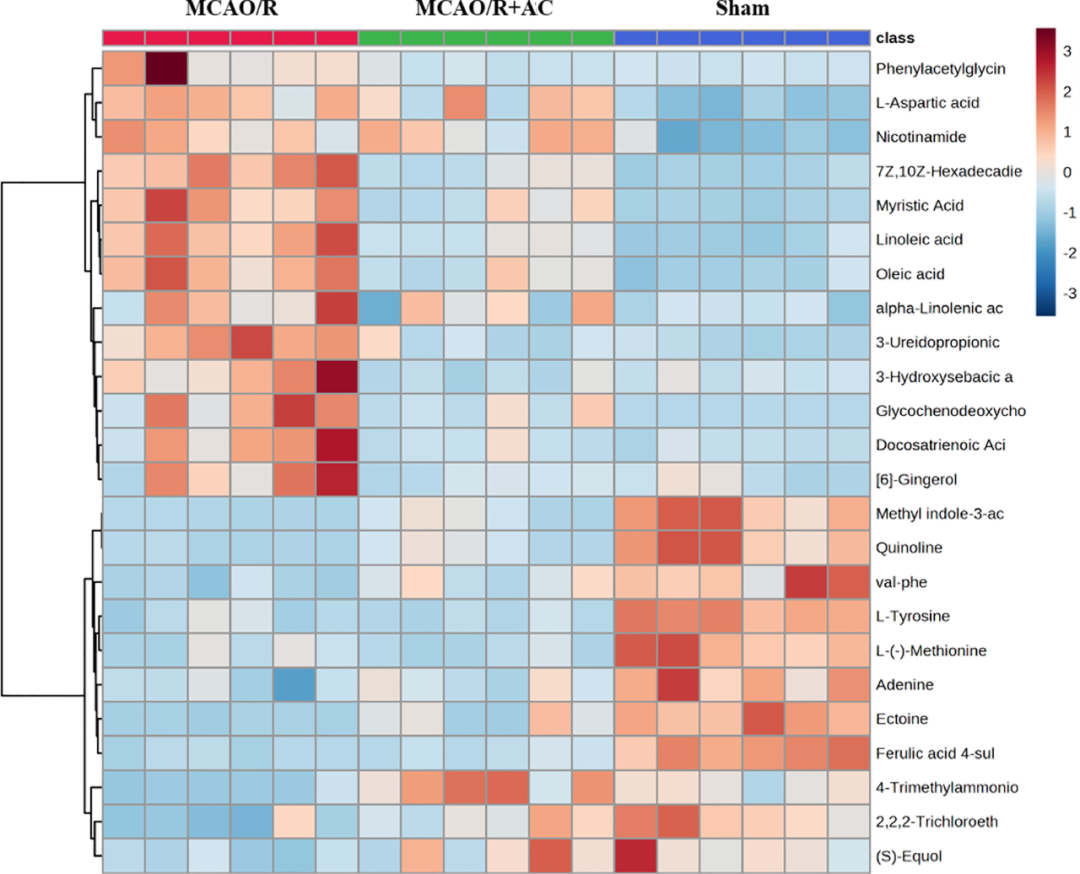
图4 差异代谢物热图
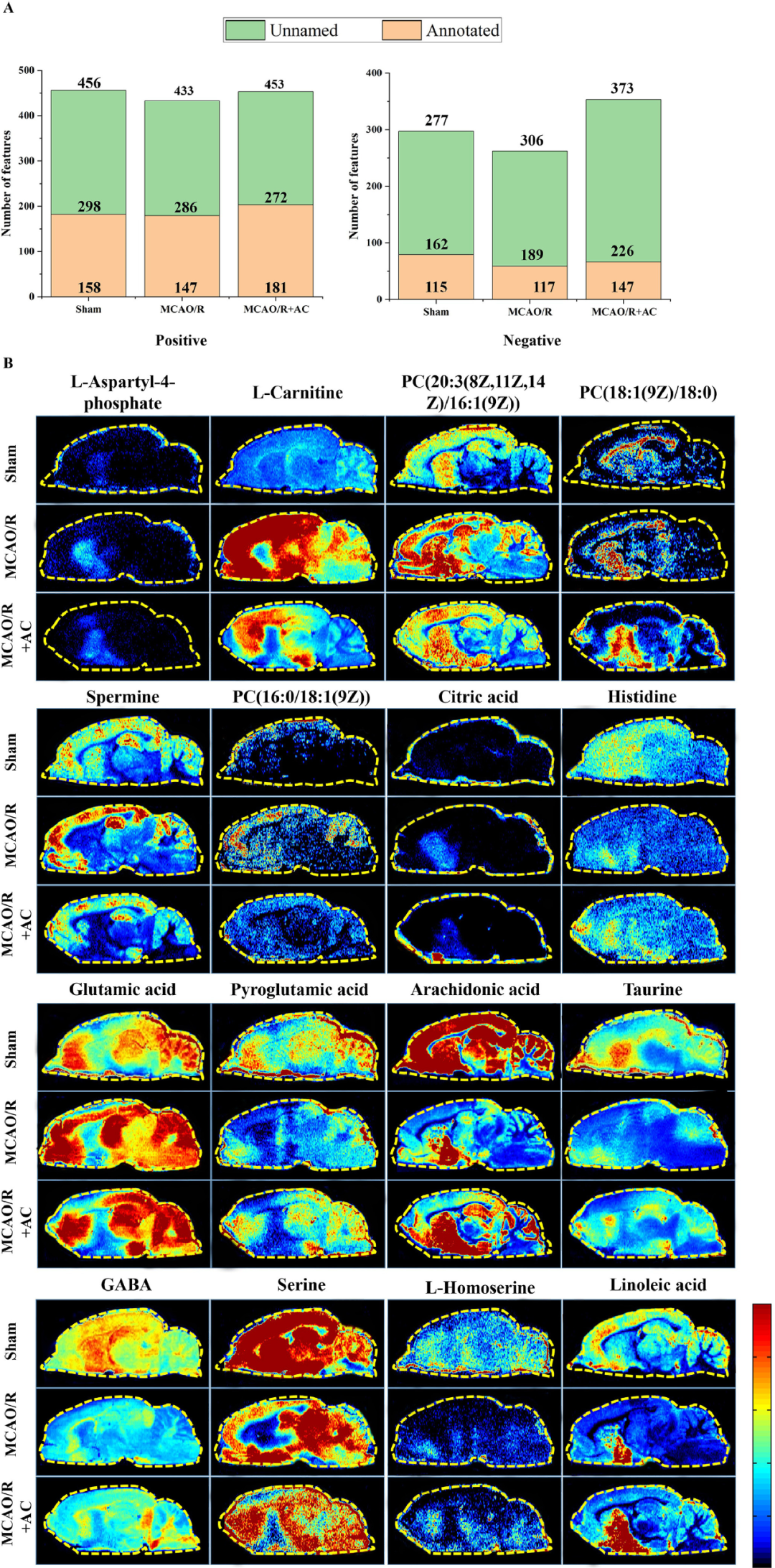
图5 基于AFADESI-MSI的代谢组学分析
研究者还评估了内源性代谢物在大脑区域的分布模式,其中CTX和CBC的信号强度尤为突出。在大鼠脑切片中,分别在CTX、CP、TH、HP、FT和CBC中鉴定出了97、80、85、95、109和109种代谢物,某些代谢物仅在特定区域表现出变化(图6A),图6B显示了不同大脑区域代谢物谱之间的分离程度,各脑区代谢物变化情况则如图7所示。
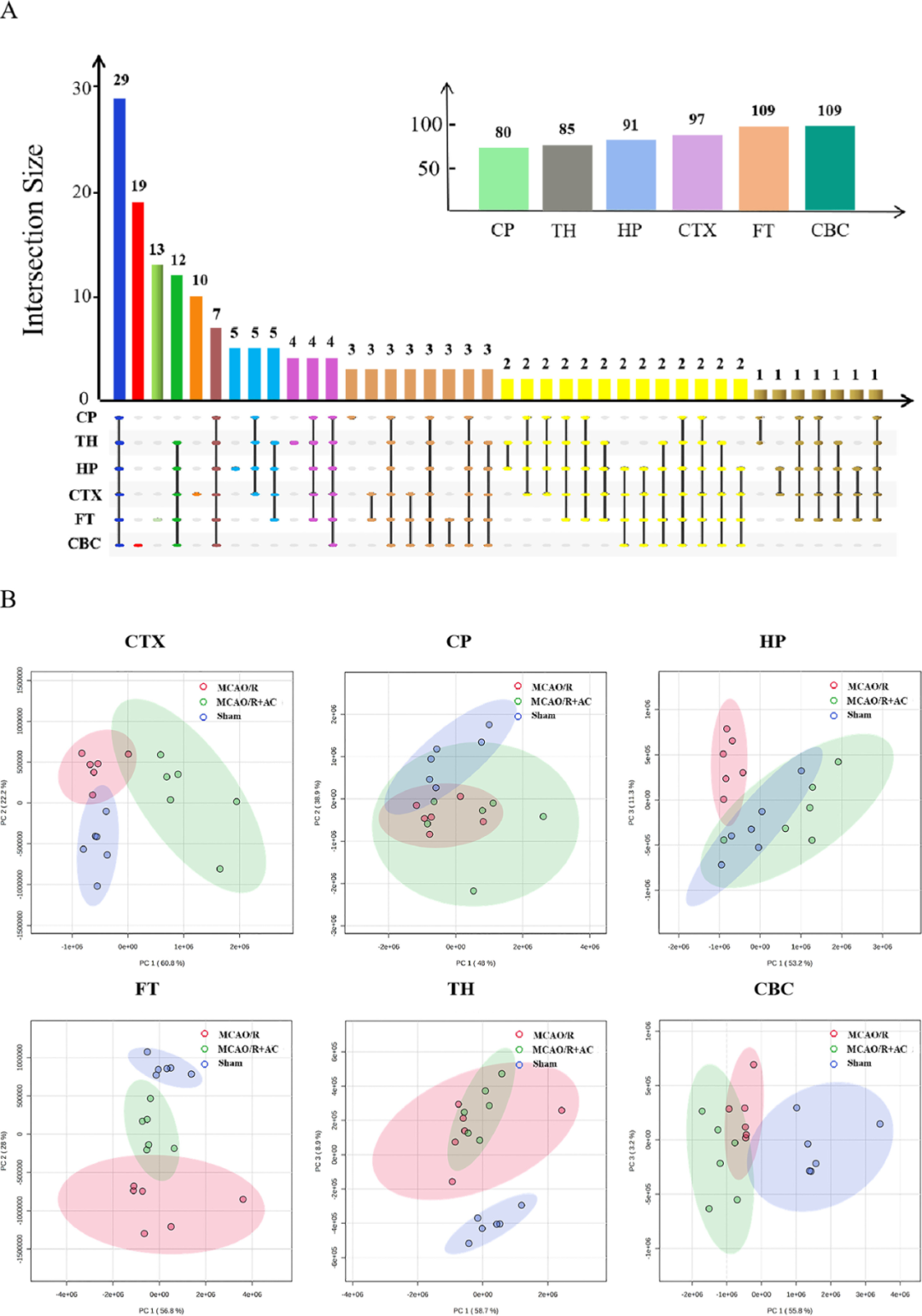
图6 H-AC处理下CIRI大鼠不同脑区的空间代谢物变化
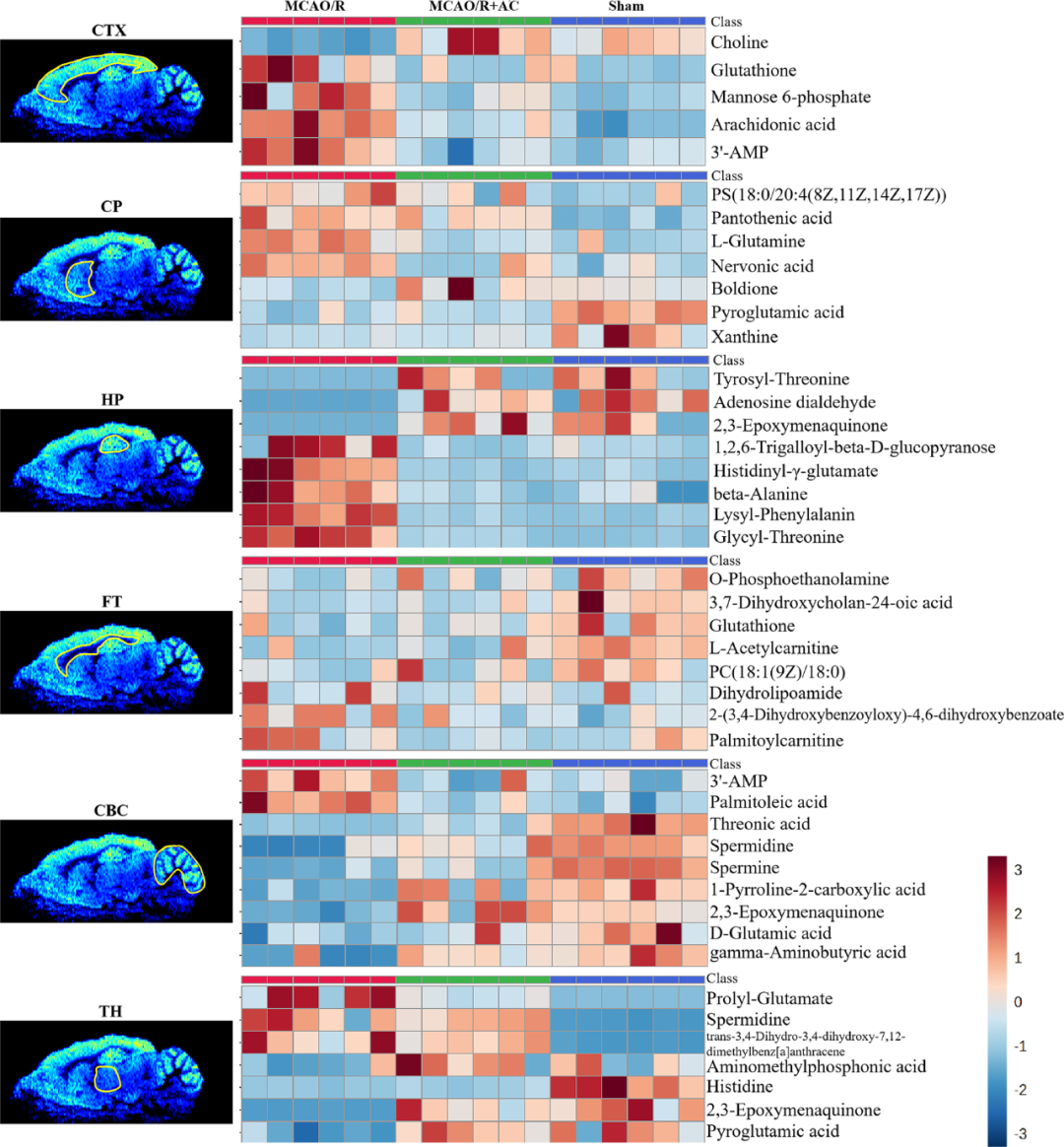
图7 各脑区代谢物热图
AC治疗CIRI的潜在代谢机制
脑微区中神经代谢物的组成和分布变化是CIRI代谢表型改变的重要指标,可以作为临床诊断、筛查和治疗干预的关键标志物。研究者首先探索了22种典型神经化学物质在不同微区的分布和改变(图8)。结果显示,AC可显著改变特定脑微区的谷氨酸(Glu)、谷氨酰胺(Gln)、N-乙酰天门冬氨酸(NAA)、天冬氨酸(Asp)的水平;AC可降低肾上腺素(E)从而缓解其介导的炎症反应与氧化应激;AC还可使多个区域的5-羟色胺(5-HT)信号增加,还改变了多巴胺(DA)的分布。
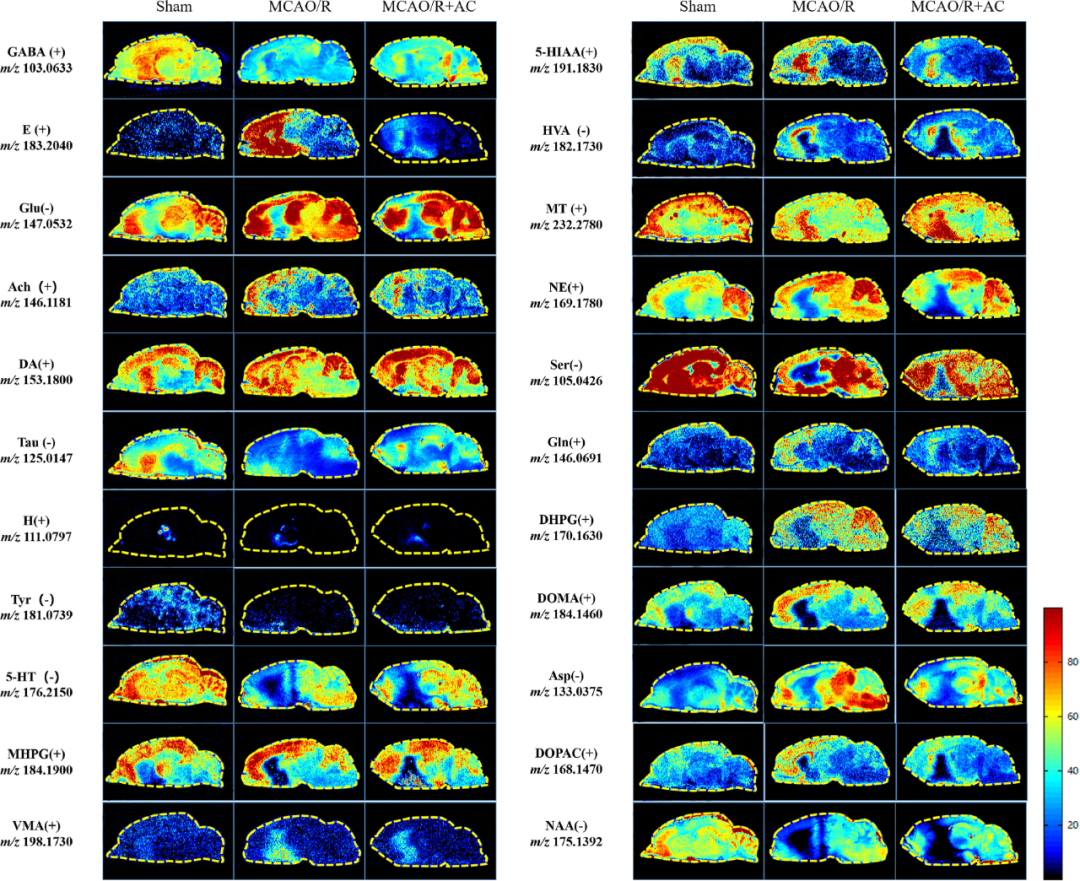
图8 22种神经化学物质及其代谢物
脑组织和血清样本之间代谢组学的相关性以及不同生物基质的代谢组学数据可以提供CIRI诱导代谢紊乱的多维视角。结果显示,CIRI会诱导糖酵解途径的异常激活和代谢物累积,而AC能够下调葡萄糖-6-磷酸(G6P)和磷酸烯醇丙酮酸(PEP)并恢复延胡索酸的信号从而缓解这一现象(图9),而在核酸代谢方面,AC同样能够发挥一定逆转效果(图10)。
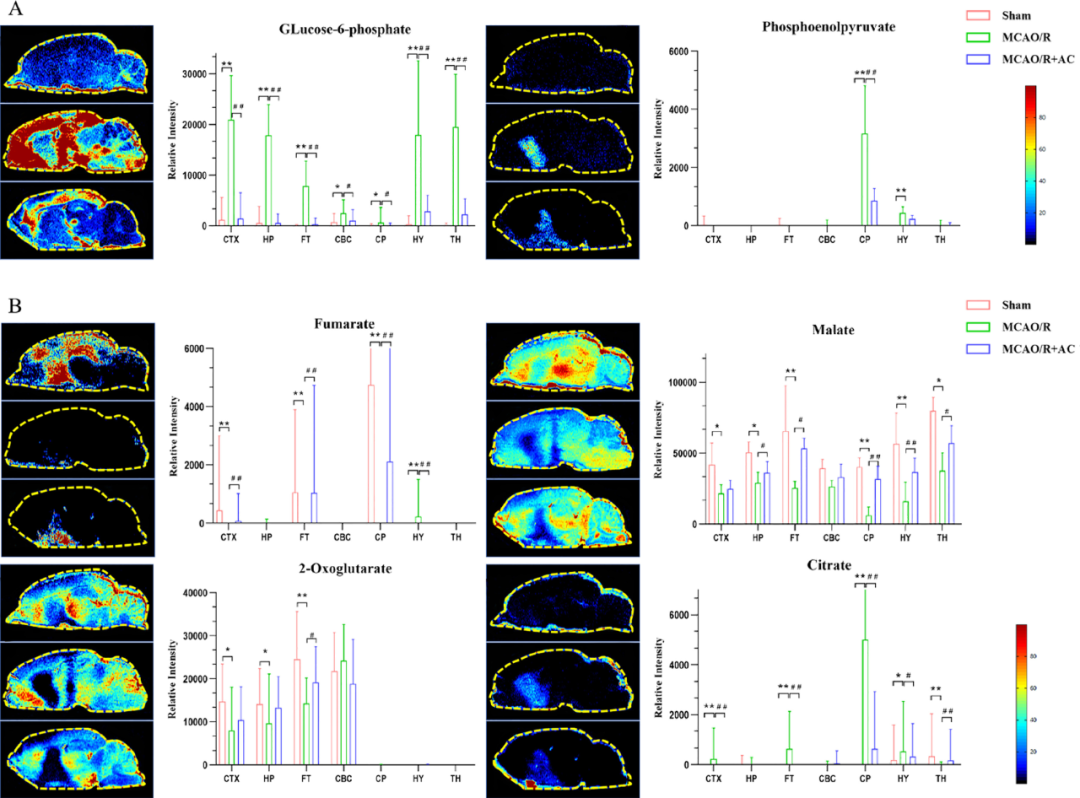
图9 能量代谢紊乱
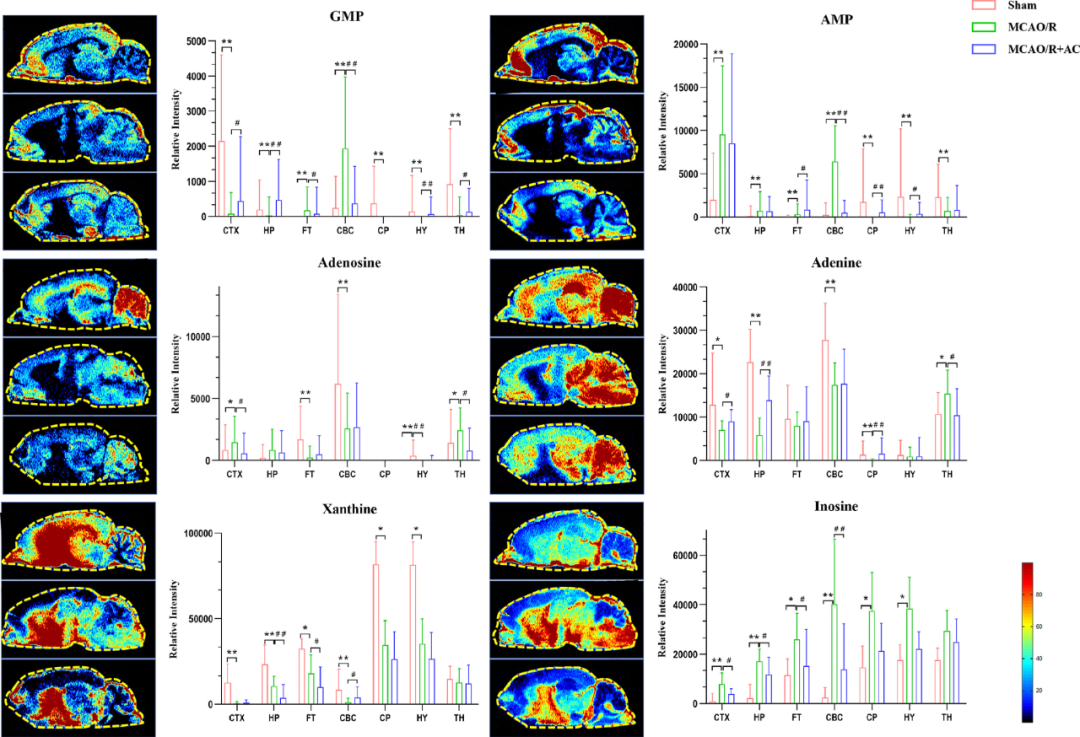
图10 核酸代谢紊乱
除此之外,研究者发现MCAO/R组脑组织中腺嘌呤、L-酪氨酸等信号强度增加,而左旋门冬酰胺酶和烟酰胺水平降低,经AC干预后,这些氨基酸的信号均被逆转,这与血清中所观察到的趋势一致。然而,脂肪酸化合物在血清和组织中则呈现相反趋势。综上可知,血清代谢物作为脑损伤的非侵入性生物标志物的具备一定潜力,并且AC可以多途径促进CIRI所引起代谢紊乱的恢复。
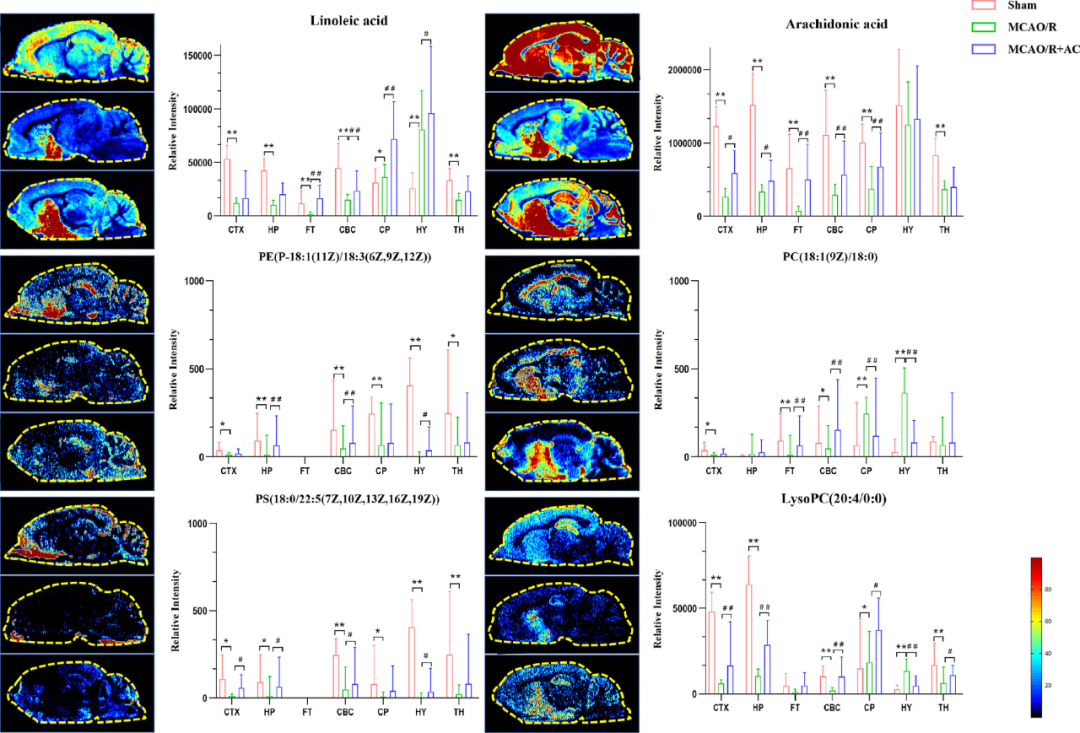
图11 脂代谢紊乱
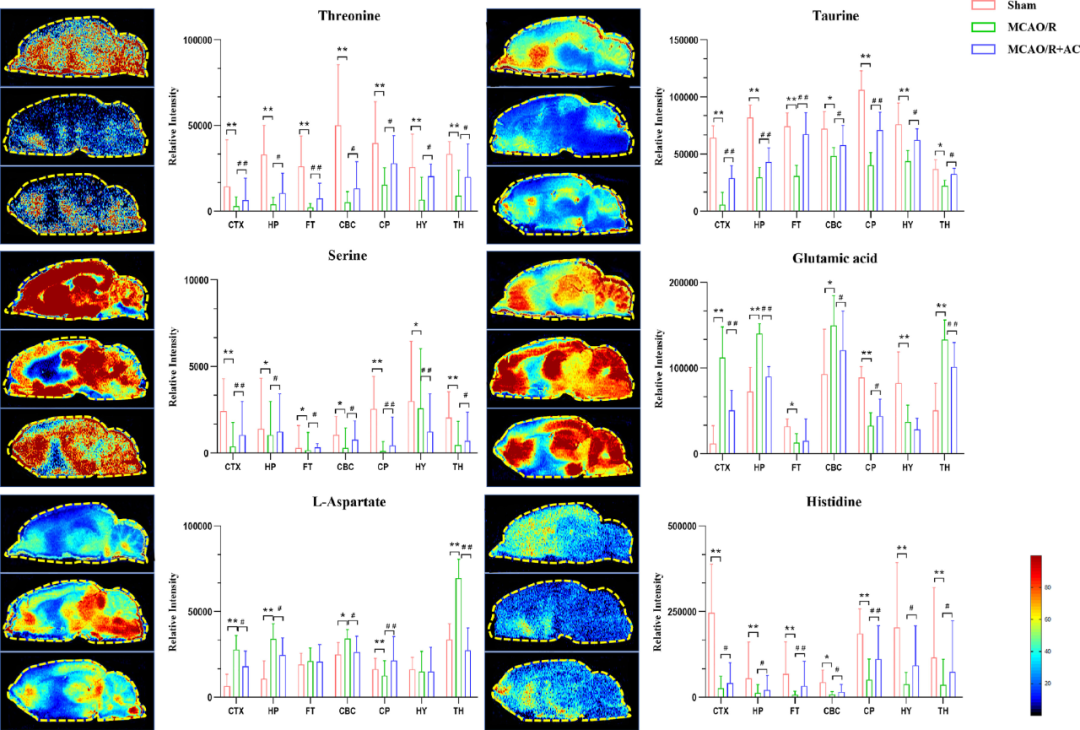
图12 氨基酸代谢紊乱
代谢通路富集分析
研究者基于鉴定出的差异代谢物,进行通路富集和功能分析并构建了一个代谢网络,从而阐明代谢物之间的相互关系及其在生物过程中的作用(图13、14)。结果显示,这些通路涉及氧化应激、细胞死亡等。同时从代谢网络图中可以较为直观地反映出能量代谢的中断,同时部分影响大脑型号传导的关键神经递质也受到了CIRI的影响。
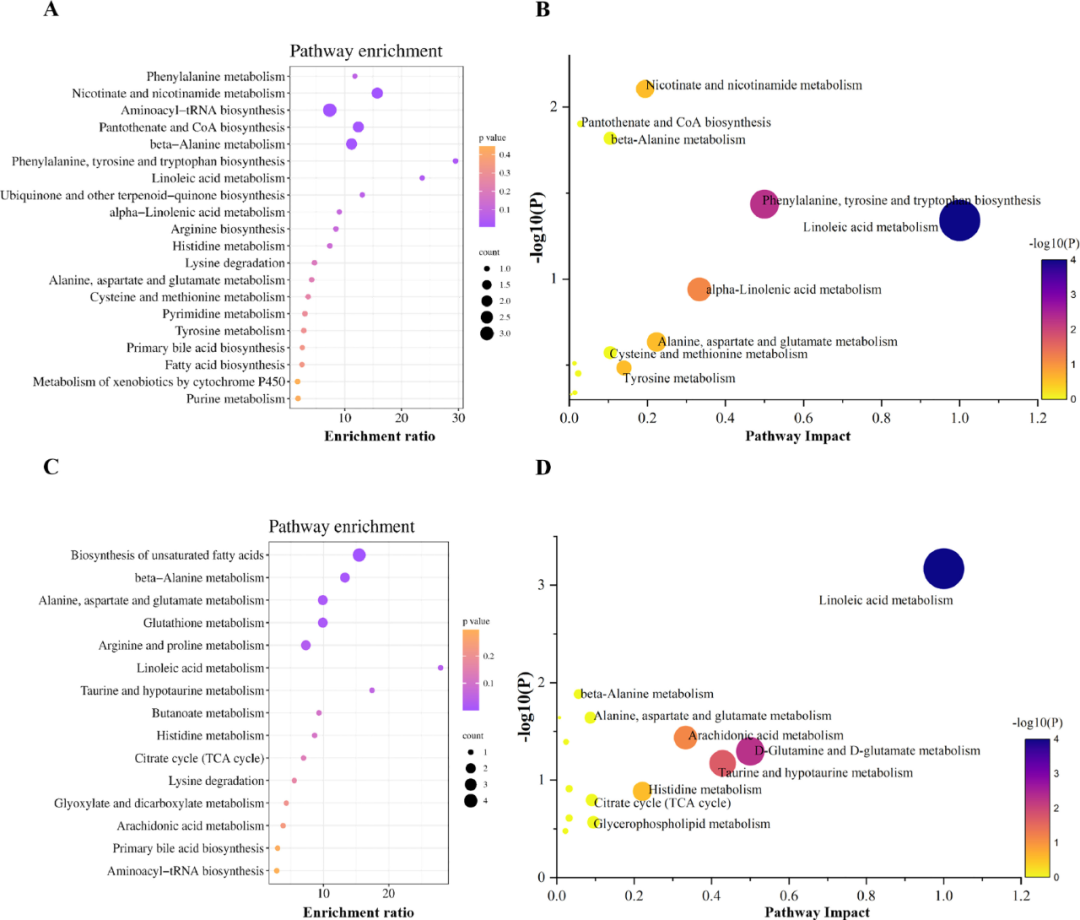
图13 AC治疗CIRI相关的代谢物通路富集分析
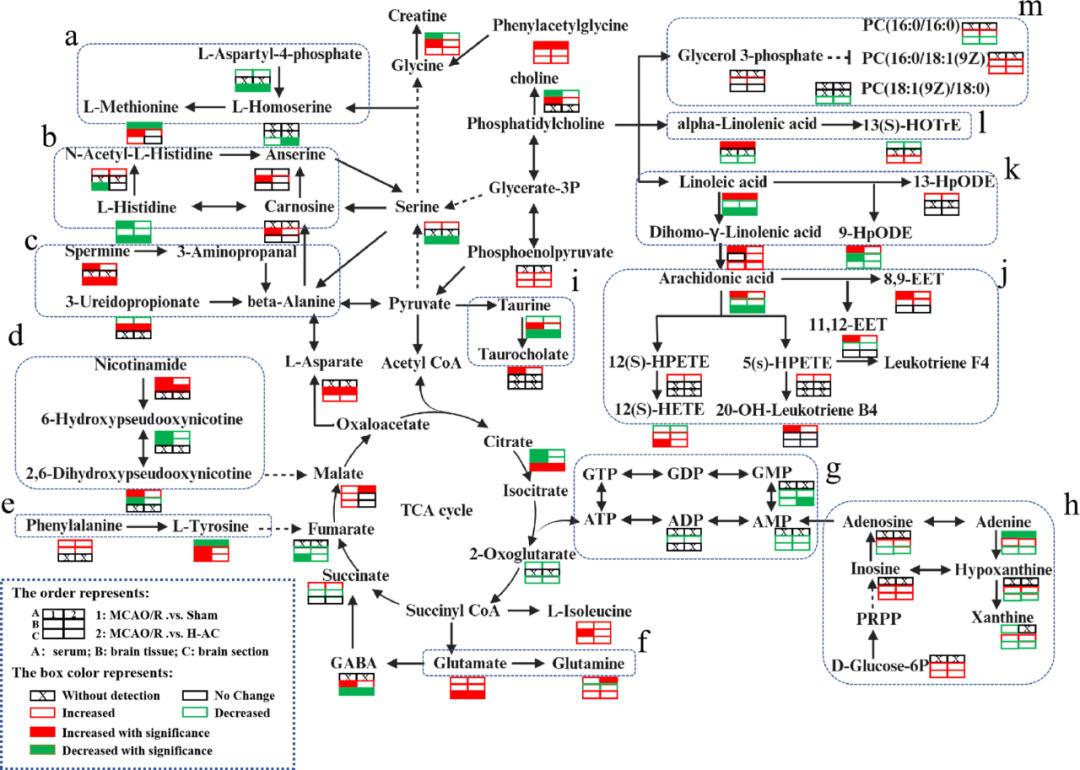
图14 AC治疗CIRI大鼠后的代谢网络
(a:半胱氨酸和蛋氨酸代谢;b:组氨酸代谢;c:β-丙氨酸代谢;d:烟酸和烟酰胺代谢;e:苯丙氨酸、酪氨酸和色氨酸生物合成;f:谷氨酰胺和谷氨酸代谢;g:核酸代谢;h:嘌呤代谢;i:牛磺酸和次牛磺酸代谢;g:花生四烯酸代谢;k:亚油酸代谢;l:α-亚麻酸代谢;m:甘油磷脂代谢)
CIRI组织病理学与代谢组学的相关性分析
研究者进一步探讨了组织病理学与代谢组学之间的关系以加深对发病机制的理解(图7、图15)。CIRI对缺血半球的CTX和皮质下区域造成严重损伤,组织染色可见大量炎症细胞浸润,伴有尼氏小体减少,代谢组学分析显示,CIRI导致ATP合成减少,从而引起CTX中AMP积累,激活A2受体并引发炎症和神经元凋亡,此外,花生四烯酸的上调促进了炎症介质的释放加剧了组织损伤。这一结果与组织学变化的趋势类似,而AC干预后可改善上述情况。
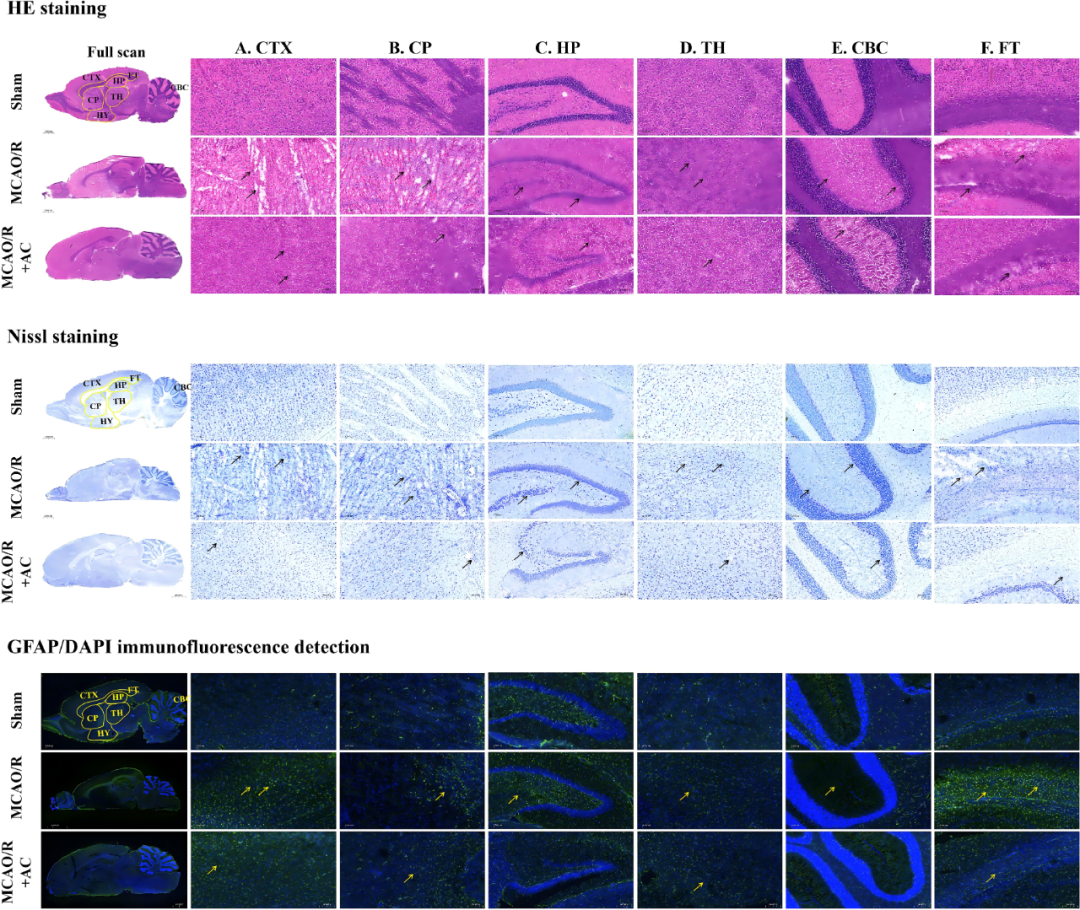
图15 脑微区中神经元、尼氏体和星形胶质细胞的空间变化
结论
AFADESI-MSI这一前沿技术弥合了大脑代谢物空间变化的研究空白,该研究采用LC-MS和AFADESI-MSI综合分析,为CIRI相关的系统和局部代谢重编程提供了详细见解。此外,AC通过逆转代谢紊乱,显着改善了神经功能障碍和BBB损伤,表明其治疗CIRI的巨大潜力。
参考文献:
Zhao, D., Zhang, X., Jin, W. F., Huang, P., Wan, H., & He, Y. (2024). Efficacy of Astragalus membranaceus-Carthamus tinctorius in cerebral ischemia/reperfusion injury: Insights from metabolomics and mass spectrometry imaging. Phytomedicine : international journal of phytotherapy and phytopharmacology, 133, 155881. Advance online publication. https://doi.org/10.1016/j.phymed.2024.155881
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#黄芪# #脑缺血/再灌注损伤#
183