zanubrutinib治疗复发/难治性边缘区淋巴瘤的安全性和有效性:MAGNOLIA研究的最终分析
2023-12-19 淋立尽治 淋立尽治 发表于上海
在这里,我们介绍了MAGNOLIA研究的最终分析,中位随访时间为12个月,以表征泽布替尼在R/R MZL患者中的反应持久性以及长期安全性和耐受性。
研究背景
泽布替尼是一种不可逆的共价BTK抑制剂,旨在确保更高的BTK特异性,从而最大限度地减少表皮生长因子受体和TEC家族激酶的脱靶抑制以及相关毒性。
在这项 2 期 MAGNOLIA 研究的初步分析中,66 例可评估的 R/R MZL 患者,中位随访时间为 15.7 个月,泽布替尼显示出疗效(IRC]评估的总缓解率[ORR]68.2%;完全缓解[CR]25.8%;未达到中位缓解持续时间[DOR] 和中位无进展生存期[PFS])和良好的安全性/耐受性。基于这些早期数据,泽布替尼在美国、加拿大和欧盟获批用于治疗接受过至少1种抗CD20靶向方案的R/R MZL患者。
在这里,我们介绍了MAGNOLIA研究的最终分析,中位随访时间为12个月,以表征泽布替尼在R/R MZL患者中的反应持久性以及长期安全性和耐受性。
纳入标准
符合条件的患者年龄为 ≥18 岁,患有R/R MZL,之前接受过至少 1 种抗 CD20 定向治疗方案,患有可测量的疾病(≥1 个最长直径为>1.5 cm 的淋巴结病变和/或≥1个>1.0 cm 的结外病变)通过CT或MRI,研究调查员认为需要对 MZL 进行全身治疗, ECOG评分为0至2,并且具有足够的骨髓和器官功能。
如果患者之前接受过BTK抑制剂、正在接受强效 CYP3A 抑制剂/诱导剂、有中枢神经系统MZL受累、已知转变为侵袭性淋巴瘤、有临床意义的心血管疾病或有活动性感染,则患者被排除在外。接受抗血小板治疗和/或抗凝剂(包括华法林)的患者符合条件。
研究方法
所有患者均接受口服泽布替尼(160 mg,每日两次),直至疾病进展、出现不可接受的毒性或患者停药。根据非霍奇金淋巴瘤的lugano分类评估疾病反应。在筛选时、第 12、24、36 和 48 周以及此后每 24 周进行一次扫描。筛选时,需要进行骨髓评估,而对于胃肠道受累的患者,胃肠镜镜检查是可选的。
研究终点
主要疗效终点是IRC评估的ORR,定义为达到部分缓解(PR)或CR的最佳总体缓解的患者比例。
次要疗效终点包括研究者评估的ORR、DOR(从第一次PR或CR到疾病进展或死亡的时间[月])、PFS(从泽布替尼首次给药到疾病进展或死亡的时间[月])、和总生存期(OS;从泽布替尼首次给药到死亡的时间 [月])。
使用EORTC QLQ-C30 和EQ-5D-5L评估与健康相关的生活质量。这些患者报告的问卷是在泽布替尼首次给药前、治疗周期 3 结束时完成的,在接下来的 12 个月内每 12 周完成一次,之后每 24 周完成一次。EORTC QLQ-C30 和 EQ-5D-5L 全球量表的范围从 0 到 100,其中 0 代表最差的健康状况/生活质量,100 代表最好的。
安全性评估
从第一个治疗日到最后一次泽布替尼给药后 30 天评估安全性/耐受性,包括监测 AE、临床实验室检查和生命体征。根据与BTK抑制剂类别相关的已知和理论毒性定义特别关注的AE;这些包括出血(小出血和大出血)、高血压、心房颤动和扑动、第二原发性恶性肿瘤(包括皮肤癌)、肿瘤溶解综合征、感染(包括机会性感染)和血细胞减少症(如中性粒细胞减少症、血小板减少症和贫血)。
统计分析
使用疗效分析集进行疗效分析,疗效分析集定义为接受至少1剂泽布替尼且集中确诊为 MZL 的所有参加研究的患者。
使用安全性分析集进行安全性分析,安全性分析集定义为接受至少1剂泽布替尼的所有参加研究的患者。
根据基线特征(包括年龄、疾病亚型和分期、ECOG评分、既往治疗、R/R 状态和疾病体积)对患者亚组的主要疗效终点进行预定义的亚组分析。
研究结果
患者和基线特征
本次最终分析的数据截止日期为 2022 年 5 月 4 日。所有 68 例患者均被纳入安全性分析集,而 66 例 (97.1%) 患者被集中确诊为 MZL,因此被纳入疗效分析集。研究结束时,34例(50.0%)患者仍在接受治疗:31例(50.0%)患者转入长期扩展研究(NCT04170283),3例(4.4%)患者正在接受泽布替尼治疗,但未参加长期扩展研究;34例(5.650.0%)停药。24例(35.3%)患者因研究者评估的疾病进展而停用泽布替尼,5例(7.4%)患者因不良事件停用。
简而言之,中位年龄为70岁(四分位距[IQR],59.5-77.0),19例(27.9%)患者年龄为≥75岁。相同比例的患者有结外和淋巴结MZL亚型(n=26例[各38.2%]; 73.1%[26例中的19例]结外MZL患者有非胃/非皮肤疾病),12例(17.6%)患者有脾MZL,4例(5.9%)同时出现淋巴结和结外病变。既往治疗的中位数为2例(IQR,1.0-3.0),22例(32.4%)患者对最后一次治疗难治;大多数患者 (n = 61 [89.7%]) 接受了化学免疫治疗,而 7 例 (10.3%) 患者接受了利妥昔单抗作为他们唯一的既往治疗。研究随访的中位持续时间为28.0个月(IQR,24.9-30.5),中位治疗持续时间为24.2个月(IQR,7.2-29.3),治疗周期的中位数为26.3(IQR,7.8-31.9)。
疗效
IRC评估的ORR为68.2%,CR 率为 25.8% (n = 17),PR 率为 42.4% (n = 28),与主要分析一致。在所有MZL亚型中均观察到疗效,淋巴结MZL患者的ORR为76.0%,脾MZL患者的ORR为66.7%,结外粘膜相关淋巴组织患者的ORR为64.0%。总体缓解的中位时间为 2.8 个月。总人群的中位CR时间为2.9个月(IQR,2.8-5.5),淋巴结MZL患者为3.0个月(IQR,2.7-3.8),脾MZL患者为6.3个月(IQR,6.3-6.3),结外粘膜相关淋巴组织患者为2.9个月(IQR,2.8-5.3)(表1)。
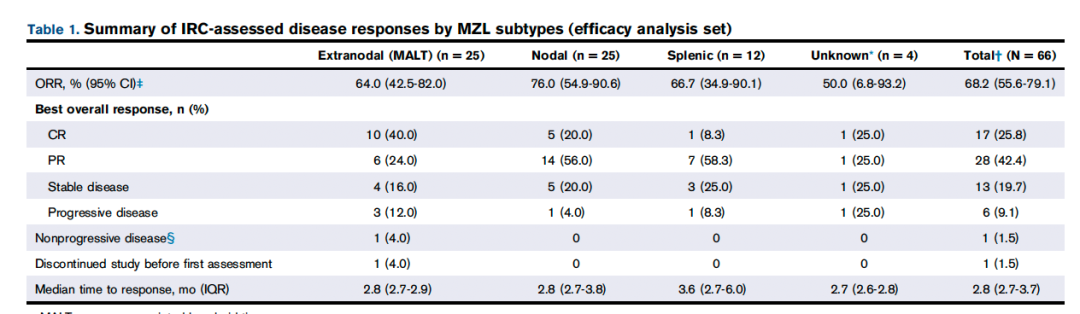
基于CT评估的IRC评估ORR的敏感性分析显示,ORR为66.7%(95%CI,54.0-77.8),CR率为24.2%。研究者评估的ORR略高于IRC评估的ORR(表2)。
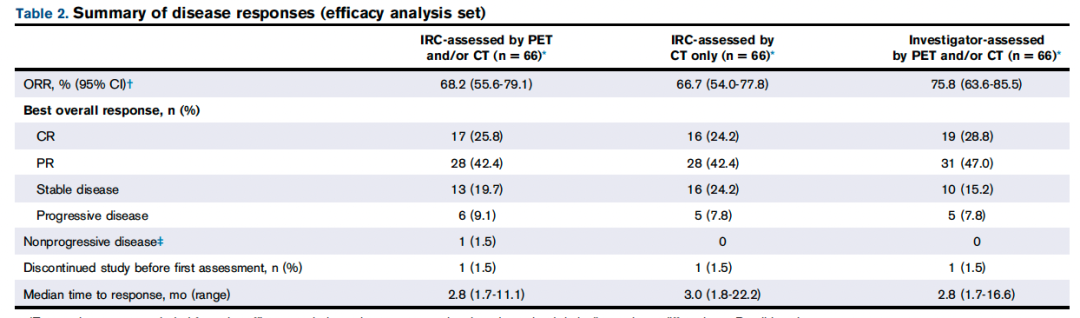
中位随访27.4个月(IQR,16.5-未达到)和23.4个月(IQR,23.8-未达到)时未达到中位PFS和DOR。24个月时,PFS和DOR率分别为70.9%(95%CI,57.2-81.0)和72.9%(95%CI,54.4-84.9)( 图1 A-B)。淋巴结性MZL和结外黏膜相关淋巴组织患者24个月时的PFS率高于脾性MZL患者。在有反应的患者中,78.0% 的淋巴结 MZL 患者和 74.6% 的结外黏膜相关淋巴组织患者在 24 个月时维持了反应。在获得 CR 的患者中,较大比例的患者在 24 个月时无进展且存活(76.5% [13/17] 的患者;PFS率为87.4%),与未达到CR的患者相比(40.8% [20/49];PFS率,64.7%)。估计的24个月OS率为85.9%(95%CI,74.7-92.4)( 图1 C)。结外黏膜相关淋巴组织(91.7%)或脾MZL(91.7%)患者的24个月生存率最高,淋巴结MZL患者的24个月生存率最低。
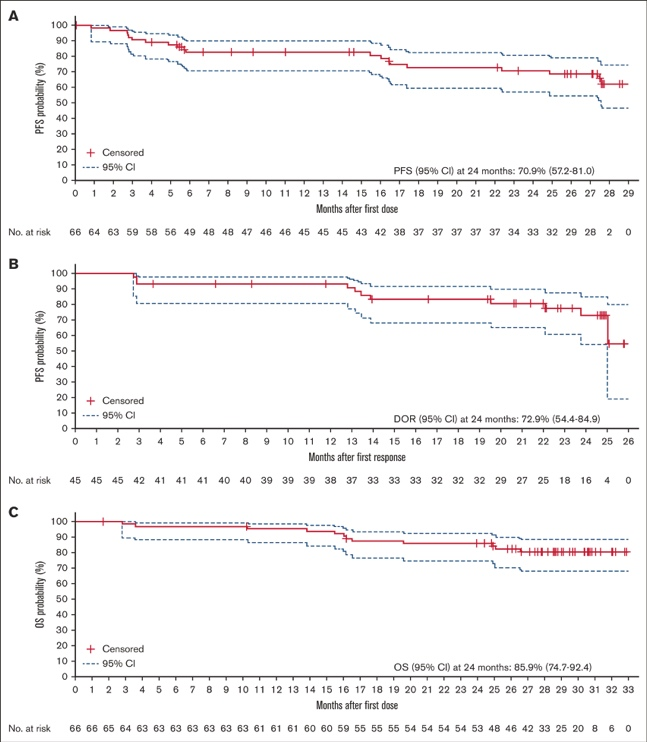
IRC 评估的预先指定亚组的 ORR 如图 2 所示。在几个患者亚组中观察到的反应率高于整个研究人群的反应率,包括那些传统上对治疗反应不佳的患者。19 具体而言,在以下亚组中观察到更高的缓解率:年龄≥75 岁的患者 (94.4%)、男性患者 (83.3%)、自上次抗淋巴瘤治疗以来 >2 年的患者 (79.3%)、复发患者 (72.1%)、至少有 1 个靶病灶的患者 >5 cm (79.2%)、淋巴结 MZL 亚型患者 (76.0%)、IV 期疾病患者 (70.0%)、 既往接受过利妥昔单抗单药治疗的患者 (100.0%),以及既往接受过 RCVP 治疗的患者 (80.0%)。
生物标志物研究
对 17 例接受泽布替尼治疗的患者在基线时进行全外显子组测序。NF-κB通路相关基因突变( MYD88 或 TNFAIP3 突变[n=8])的患者与野生型表型(n=9)的患者相比PFS更长:中位PFS未达到,PFS分别为11.1个月; P = 0.008(HR=0.09;95% CI-0.01-0.52)。2例治疗后疾病进展的患者也发生了 BTK 和 PLCy2 突变。
生活质量
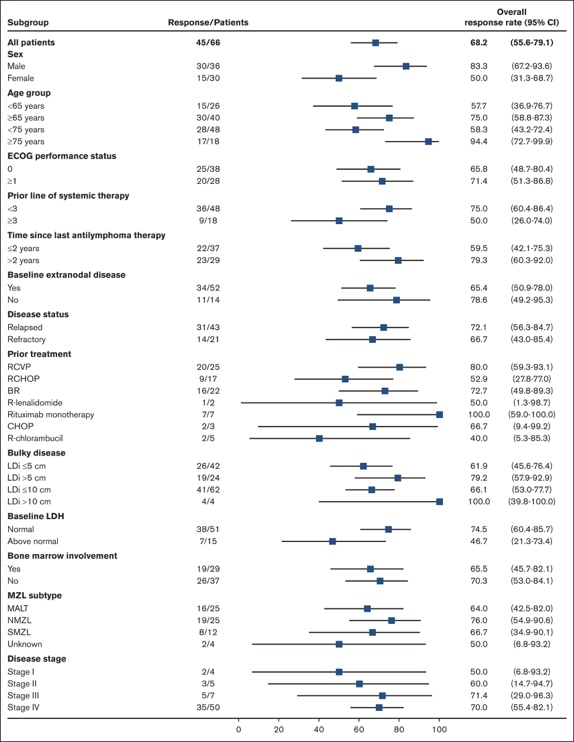
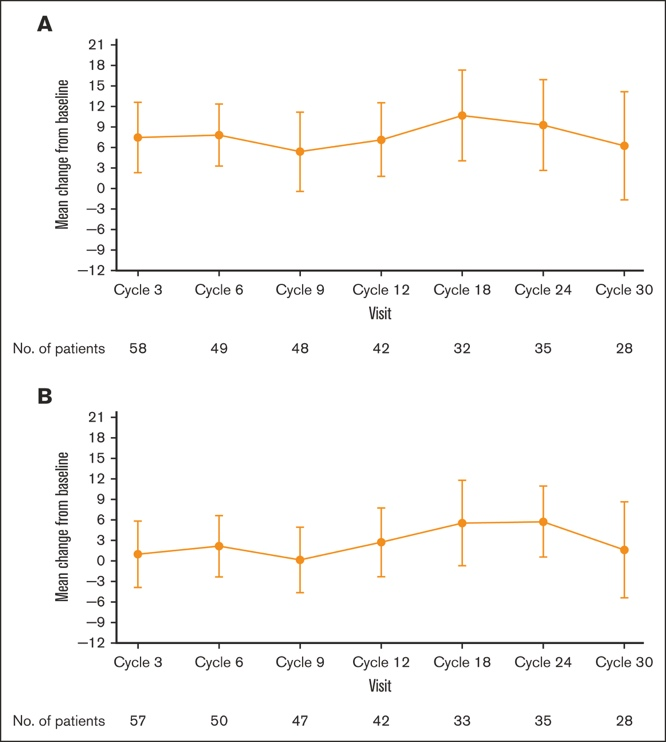
EORTC QLQ-C30 和 EQ-5D-5L 评分表明患者健康状况/生活质量较基线有所改善,这在治疗周期第 3 周期观察到,并在整个研究过程中广泛维持( 图 3 A-B)。两种患者报告问卷的最大改善发生在第 18 至 24 周期(18-24 个月)期间,在此期间,第 18 周期和第 24 周期的平均(标准差)EORTC QLQ-C30 评分分别比基线高 10.7和 9.3分,第 18 周期的平均(标准差)EQ-5D-5L 视觉模拟评分比基线高 5.6分。
安全性/耐受性
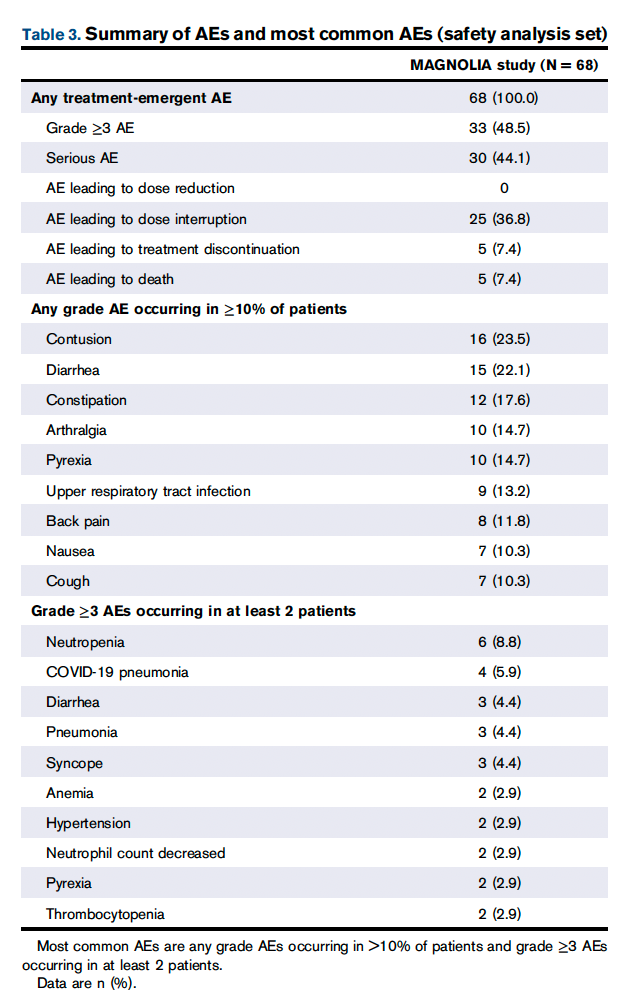
所有患者(n=68)都报告了至少1例任何级别的治疗中出现的AE,无论与治疗的关系如何( 表3 )。33例(48.5%)患者发生≥3级不良事件,中性粒细胞减少/中性粒细胞计数下降(n=8[11.8%])和COVID-19肺炎(n=4[5.9%])发生于≥5%的患者( 表3 )。
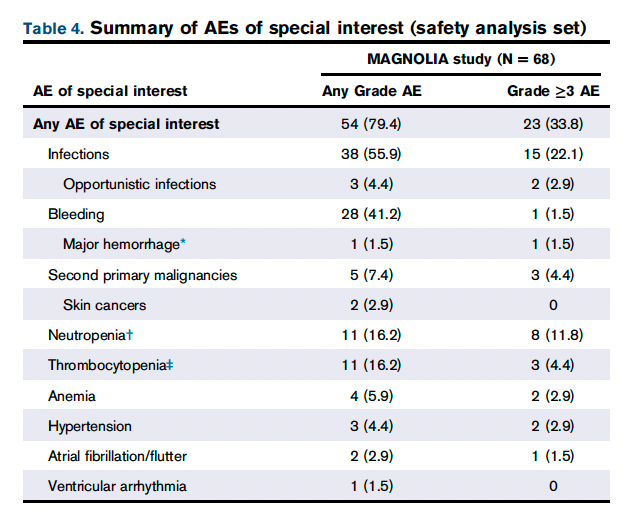
特别关注的 ≥3 级 AE 很少见( 表 4 )。在 >5% 的患者中报告的唯一特异性感染是 COVID-19。1 例患者因双侧肺栓塞同时接受依诺肝素和利伐沙班治疗,发生 3 级消化道出血。一旦出血消退且无复发性出血,患者重新开始使用泽布替尼。据报道,2 例 (2.9%) 患者出现新发 3 级高血压;心房颤动(3 级)、心房扑动(2 级)和室性期前收缩(2 级)各发生 1 例 (1.5%) 患者。心房颤动发生在最后一次泽布替尼给药后 21 天和疾病进展后,患者既往有心房颤动病史。2例(2.9%)报告≥3级贫血,8例(11.8%)出现中性粒细胞减少,3例(4.4%)患者出现血小板减少。贫血、中性粒细胞减少症和血小板减少症(所有级别)的中位发病时间分别为 102.5 天 (IQR,64.0-108.5)、86.0 天 (IQR,45.0-339.0) 和 84.0 天 (IQR,28.0-343.0)。3例(4.4%)患者因中性粒细胞减少而中断剂量,而4例(5.9%)患者接受生长因子支持。血小板减少症不需要输注血小板。没有患者因血细胞减少、心律失常或出血事件而停用泽布替尼。没有关于肿瘤溶解综合征或发热性中性粒细胞减少的报道。
在发生第二原发性恶性肿瘤的5例(7.4%) 患者中,2例(2.9%)发展为皮肤癌(均有皮肤癌既往史),1例(1.5%)膀胱癌/前列腺癌复发,1例(1.5%)已有甲状腺肿块随后被诊断为甲状腺状癌,1例(1.5%)既往接受过烷化剂治疗的患者发展为急性髓系白血病。
30例(44.1%)患者报告了严重的不良事件;>1例患者发生的不良事件包括COVID-19肺炎(n=4[5.9%])、肺炎(n=3[4.4%])、发热(n=3[4.4%])、晕厥(n=2[2.9%])和跌倒(n=2[2.9%])。25例(36.8%)患者因不良事件而中断治疗。治疗中断的中位持续时间为 22.0 天 (IQR, 6-53),导致治疗中断的最常见 AE 是 COVID-19 肺炎 (n = 4 [5.9%]) 和中性粒细胞减少症 (n = 3 [4.4%])。
5 例(7.4%)患者因 AE(均为致命性)而停止治疗,包括2例(2.9%)COVID-19 肺炎、有冠状动脉疾病病史的患者心肌梗死、既往接触过烷化剂的患者出现急性髓系白血病,以及诊断为复发性膀胱癌/前列腺癌的患者根治性膀胱切除术后脓毒性脑病。
研究结论
MAGNOLIA研究的最终分析表明,在R/R MZL患者中,泽布替尼可提供持久的疾病控制,并具有良好的安全性。与主要发现相比,在更长的治疗时间和随访后,没有额外的迟发性毒性,也没有观察到新的安全信号。泽布替尼最近获批,为复发/难治性MZL患者提供了新的治疗选择。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#边缘区淋巴瘤# #泽布替尼#
74