最全综述:弥漫性胃癌的分子特征和新兴靶向疗法
2024-11-17 苏州绘真医学 苏州绘真医学 发表于上海
本文综述弥漫性胃癌(DGC),介绍其与肠型胃癌(IGC)的差异、分子图谱、遗传特征、发病机制及临床管理等,对比当前胃癌疗法在 DGC 中的效果,着重阐述 DGC 新兴疗法及相关通路靶向治疗的前景。
弥漫性胃癌(DGC)约占胃癌诊断的三分之一,与肠型胃癌(IGC)相比,它是一种更具临床侵袭性的疾病,与腹膜转移和较差的生存率相关。过去对 DGC 发病机制的了解相对有限。多组学研究,特别是癌症基因组图谱(TCGA)研究,更好地将胃腺癌分为不同分子亚型。DGC 具有独特的分子特征,包括 CDH1、RHOA 突变和 CLDN18-ARHGAP26 融合。以这些分子改变为特征的 DGC 临床前模型提供了关于发病机制和信号通路异常的信息。目前批准的胃癌疗法通常对 DGC 患者的临床获益较少。根据最近的 II/III 期临床试验,基于 Claudin 18.2 和 FGFR2b 的靶向疗法令人兴奋,这些疗法利用了在 DGC 人群中富集的独特生物标志物。有多种靶向 Claudin 18.2 和 FGFR2b 的疗法处于临床前和临床开发的不同阶段。此外,在几个 DGC 模型中,通过靶向黏着斑激酶(FAK)和 Hippo 通路,在利用独特的治疗敏感性方面取得了临床前进展。这些临床前和临床进展代表了 DGC 治疗的前景。
研究背景
胃癌是全球第五大常见癌症和第四大癌症死亡原因。传统上,胃腺癌根据 Laurén 分类进行分类,分为弥漫型、肠型和混合型三种主要的组织学亚型,分别约占病例的 30%、50% 和 20%。弥漫性胃癌(DGC)和肠型胃癌(IGC)存在许多不同的临床病理特征(表 1)。DGC 的组织学特征是细胞分化不良、黏附性差,并且经常存在印戒细胞(图 1a、b)。相比之下,IGC 的组织学特征是管状或腺体结构,看起来类似于起源于肠道的腺癌(图 1c)。临床上,与 IGC 相比,DGC 预后较差,腹膜扩散风险较高,DGC 在年轻患者和女性中更普遍(表 1)。在过去几十年中 IGC 的发病率有所下降,而 DGC 的发病率一直在上升。

表1
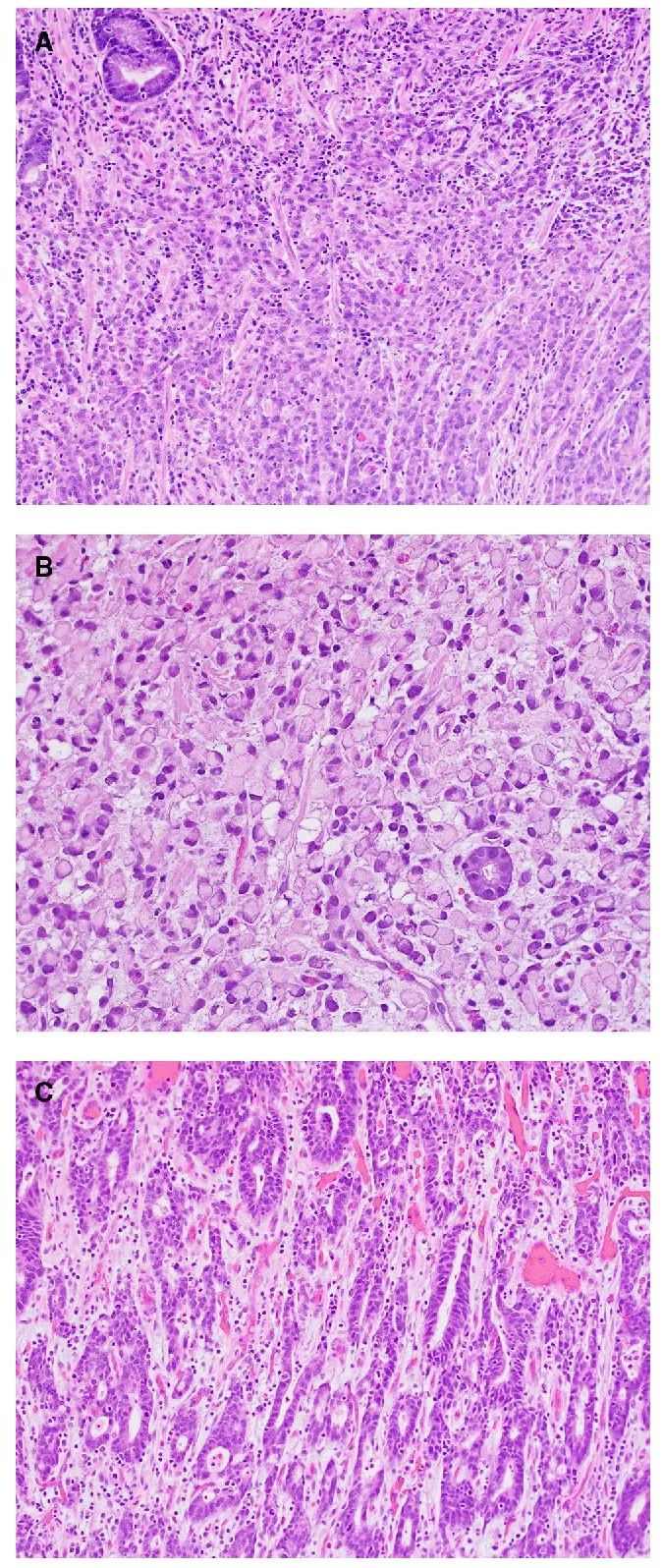

图1
胃癌的传统危险因素包括幽门螺杆菌感染、吸烟、肥胖和酗酒;然而,这些因素对 DGC vs IGC 的相对风险存在显著差异(表 1)。幽门螺杆菌感染发生 IGC 的风险远高于 DGC,而吸烟和肥胖发生 IGC 而不是 DGC 的风险较高。大量饮酒(每天 >4 杯)与 IGC 和 DGC 风险轻度增加相关,IGC 亚型的效应量更大。值得注意的是,DGC 的发病率存在重要的种族差异,与非西班牙裔白人相比,亚裔、西班牙裔白人和美洲原住民人群中 DGC 比例更高。
DGC 是一种相对罕见但临床上更具侵袭性的胃癌亚型,在该患者群体中存在大量未满足的需求。本综述的目的是强调 DGC 的主要分子和遗传改变,讨论目前批准的可能不足以满足 DGC 人群的胃癌疗法,并强调几种可能为 DGC 患者带来巨大临床获益的有前途的治疗方法和可靶向分子通路。
弥漫性胃癌(DGC)的遗传和分子图谱
分子分类
胃癌首个大型下一代测序(NGS)研究是癌症基因组图谱(TCGA)全面研究,分析了 295 例早期胃癌患者。该研究确定了胃癌的四种主要亚型,包括 Epstein-Barr 病毒阳性(EBV)、微卫星不稳定性(MSI)、染色体不稳定性(CIN)和基因组稳定性(GS)。DGC 在 GS 队列中显著富集,73% 的病例被归类为 DGC。在 GS 队列中,CDH1 突变(37%)、RHOA 突变(15%)和 CLDN18-ARHGAP26 融合(15%)富集。临床上,GS 胃癌患者从辅助化疗中获益最少。
亚洲癌症研究组(ACRG)对300例胃全切除术或次全切除术后的患者进行了类似的胃癌NGS研究。该研究确定了四种亚型:MSI、微卫星稳定/TP53 活性(MSS/TP53+)、微卫星稳定/TP53−(MSS/TP53−)和微卫星稳定/上皮-间充质转化(MSS/EMT)。MSS/EMT 队列的 DGC 比例最高,超过 80%,总生存期最差,当应用于其他大型数据集(包括 TCGA)时,这种情况被复制。MSS/EMT 队列的复发率和腹膜播散率也较高。在突变方面,MSS/EMT 队列的特征是体细胞 TP53(33%)和 ARID1A(13.9%)突变以及 CCNE1 扩增(12.2%)。MSS/EMT 组和 GS 组之间存在显著差异,包括 MSS/EMT 组的 CDH1 突变率显著较低,仅为 2.8%。在 ACRG 队列中,除 MSS/EMT 外,在其他所有亚型中也观察到 DGC,这与 TCGA 中 DGC 在 GS 亚型中优先聚集不同。
Oh 等人的研究纳入了 93 例接受胃切除术的患者,使用基因表达数据进行了无监督分层聚类分析,确定了两种表型——间充质和上皮。富含 DGC 组织学的间充质表型的特征是基因组完整性高、EMT 促进通路增加、转化生长因子(TGF)-β 和 hedgehog 通路上调、E-钙粘蛋白和 α-钙粘蛋白降低、化疗耐药和临床结局较差。生存分析在多个大型胃癌队列中得到了验证。
Lei 等人的研究使用 248 例胃腺癌患者的基因表达数据进行了无监督分层聚类分析。确定了 3 种主要亚型:间充质、增殖和代谢。间充质亚型的特征是高水平的 EMT 和癌症干细胞通路、低 E-钙粘蛋白、低拷贝数变异和对磷脂酰肌醇 3-激酶(PI3K)抑制剂的敏感性。此外,与增殖和代谢亚型相比,弥漫型组织学在间充质亚型中高度富集。
Ho 等人创建了间充质亚型胃癌(Mes-GC)的综合分类,合并 DGC 的组织病理学特征、间充质亚型的转录组学特征和 GS 胃癌的基因组特征。TCGA、ACRG、Oh 等人和 Lei 等人的数据集进行了最近的模板预测和差异基因表达分析,开发 993 个基因共识基因特征。Mes-GC 肿瘤富含弥漫型组织学,基因变异少,对化疗和免疫治疗反应差。对于 Mes-GC 肿瘤,识别了转录增强子激活因子结构域 1(TEAD1)作为致癌转录程序的主要调节因子。
此外,提出了几种 DGC 分子亚型。Ge 等人对 84 例接受胃全切除术或次全切除术的 DGC 患者的配对肿瘤和附近正常组织进行了详细的蛋白质组学分析。研究人员确立了三个蛋白质簇,称为 PX1、PX2 和 PX3。PX1 富含细胞周期相关过程,PX2 富含细胞周期相关过程和 EMT,PX3 富含免疫应答通路。PX1 和 PX2 队列获益于辅助化疗,而 PX3 则没有。进一步的分析表明,这种临床获益与基因变异无关。Kim 等人利用 RNA 测序鉴定了 150 个胃组织样本(包括 107 个 DGC)的分子特征。DGC 的不同亚型为肠样(INT)和核心弥漫型(COD)。INT 亚型具有与 TCGA、MSI 和 EBV 亚型重叠的分子特征,对免疫检查点抑制反应较高。COD 亚型预后较差,对辅助化疗的反应较高,与 TCGA GS 亚型的分子特征重叠,以胰岛素样生长因子 1(IGF1)和嗜神经素和 PC-酯酶结构域家族成员 2(NXPE1)表达增加为特征。
这些分子分类突出了胃癌和 DGC 的异质性。目前有研究正在探索靶向 DGC 中最富集的通路。
信号通路异常
最常见的 DGC 特有的突变是 CDH1、RHOA 及其调节因子突变。生成了几个具有这些通路改变的体内 DGC 模型(图 2)。
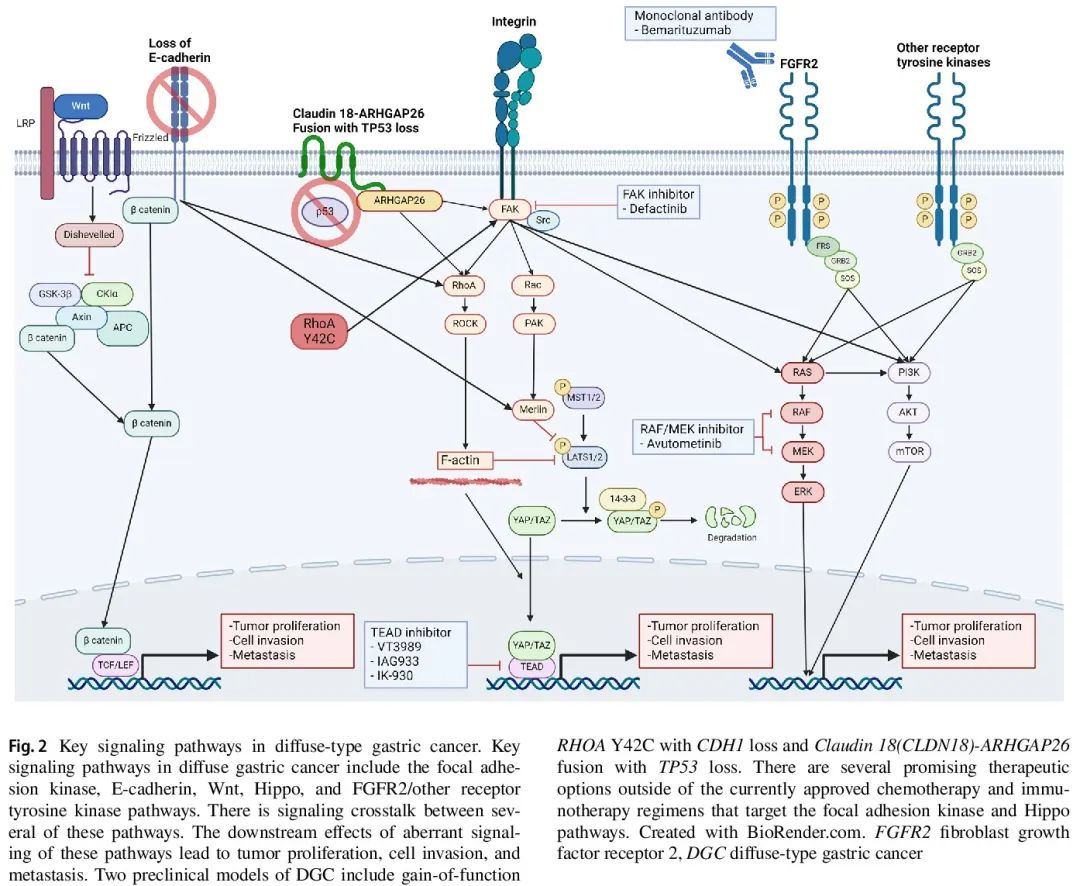
图2
CDH1 是一种抑癌基因,编码上皮钙粘蛋白,一种参与细胞间黏附、极性维持和细胞信号转导的关键跨膜糖蛋白。在胃癌中 CDH1 功能缺失导致细胞黏附缺失、接触抑制降低和细胞迁移改变,从而导致肿瘤侵袭和转移。如图 2 所示,Hippo、Wnt 和 Rho GTP 酶通路存在显著的相互信号转导。散发性DGC中最常见的基因变异是使CDH1失活的突变或甲基化。在遗传性弥漫性胃癌(HDGC)中,最常见的变异是胚系 CDH1 突变。
RHOA 是一种编码 Ras 同源家族成员 A 的基因,Ras 同源家族成员 A 是 GTP 酶 Rho 家族中的一个小 GTP 酶,参与肌动蛋白组织、细胞迁移和细胞周期信号传导。RhoA 通路的异常信号转导可进一步导致对失巢凋亡、肿瘤迁移和侵袭的抗性以及化疗耐药。关于 RHOA 功能获得vs功能缺失突变,仍然存在争议,但这可能取决于突变。最常见的 RHOA 突变是 RHOA Y42C,有强烈证据证明功能获得状态。RHOA 的关键下游靶点包括 Rho 激酶(ROCK),这是一种丝氨酸/苏氨酸激酶,导致影响肌动蛋白细胞骨架重组的进一步信号传导,从而导致随后的细胞迁移、侵袭和转移(图 2)。CDH1 缺失和 RHOA Y42C 突变的 DGC 临床前模型在体外和体内诱导 DGC。
RhoA 信号通路关键调节因子的突变也可能导致 DGC。最常见的基因变异是紧密连接蛋白 Claudin 18(CLDN18)和 Rho GTP 酶激活蛋白(ARHGAP)(尤其是 ARHGAP26)之间的融合。CLDN18-ARHGAP 融合的发生独立于 CDH1 和 RHOA 突变,并且具有 DGC 特征性黏附性较差模式。这种互斥性提示,CLDN18-ARHGAP 融合导致细胞黏附、迁移和信号转导失调,其方式类似于致病性 CDH1 和 RHOA 突变(图 2)。CLDN18-ARHGAP 融合是胃癌特有的,在早发性胃癌中富集,与较高比例的印戒、较晚期疾病、较多转移和对化疗反应差有关。在功能上,CLDN18-ARHGAP26融合与野生型 CLDN18(一种关键的紧密连接蛋白)破坏引起的上皮完整性缺失和细胞侵袭有关。CLDN18-ARHGAP26 融合和 TP53 缺失的 DGC 临床前模型在体外和体内诱导 DGC。
这些分子改变导致多种信号通路激活和依赖,是潜在靶向治疗的独特机会,将在“弥漫性胃癌的新兴治疗方法”部分进一步讨论。
遗传性弥漫性胃癌(HDGC)
HDGC的介绍和相关基因突变
HDGC是一种常染色体显性遗传性癌症综合征,其特征是存在E-钙粘蛋白基因CDH1胚系突变,导致DGC和乳腺小叶癌的风险增加。CTNNA1、BRCA2、ATM、PALB2、SDHB、STK11 和 MSR1 胚系突变也可能导致 HDGC。先前估计,HDGC 导致男性患胃癌的终生风险为 70%,女性为 56%,但由于确定偏倚,这一风险可能被高估了。最近的研究估计,男性患胃癌的终生风险约为 40%,女性约为 30%。总体而言,估计 HDGC 占所有胃癌病例的 1-3%。
肿瘤发生发展机制
在大多数 HDGC 病例中,肿瘤发生的潜在机制包括启动子高甲基化、CDH1 体细胞突变或杂合性缺失导致野生型 CDH1 失活,从而导致细胞极性缺失。前体病变是黏膜内印戒癌,局限于固有层。这些前体病变在胃远端三分之一和体窦移行区富集,提示潜在的表观遗传关系。单独 CDH1 缺失不足以发展为晚期 DGC,需要下游事件,例如感染或其他环境因素引起的慢性炎症。EMT 可能介导从早期到晚期 HDGC 的进展。也可能新获得 TP53 或 RHOA 突变,但疾病进展的总体机制仍不清楚。
临床管理
2020 年国际胃癌联合协会(IGCLC)发布的标准推荐进行基因检测(表 2)。对于有致病性或疑似致病性CDH1突变和有一级或二级亲属患DGC的患者,由于发生DGC的终生风险较高,推荐进行预防性全胃切除术(PTG)。考虑到早发性疾病的可能性,建议在 20-30 岁之间进行该手术。虽然这种手术可能挽救生命,但可能会有严重的术后并发症和一些长期不良反应,包括体重减轻、吸收不良、营养缺乏和骨质疏松症。鉴于显著的并发症,关于 PTG 存在争议。

表2
对于符合PTG条件但拒绝的患者,或符合IGCLC算法的其他标准的患者,推荐进行内镜监测。这种监测可以根据 Cambridge 或 Bethesda 方案进行,包括对胃的所有区域进行随机活检。内镜监测的一个问题是检测到的早期前体病变的可变行为,以及病变可能在两次内镜监测之间显著进展。然而,最近的一项大型前瞻性队列研究发现,拒绝 PTG 但接受内镜监测的患者肿瘤发病率较低,提示这种策略是一种可接受的替代方案。尽管如此,目前没有针对该患者群体的其他预防性疗法,这代表了一个巨大的未满足需求。
胃癌的当前全身疗法
以下各节详细介绍了美国国家综合癌症网络(NCCN)指南目前推荐的胃癌一线治疗和不同机制的后线治疗。重点介绍了导致这些治疗获批的几项 III 期临床试验。包括了这些关键临床试验基于组织学的亚组生存分析(如果有)(表 2)。这些亚组分析可能没有功效提供特定组织学获益或无获益的明确证据,但可以提供对这些具有里程碑意义的临床试验的一些见解(表 3)。
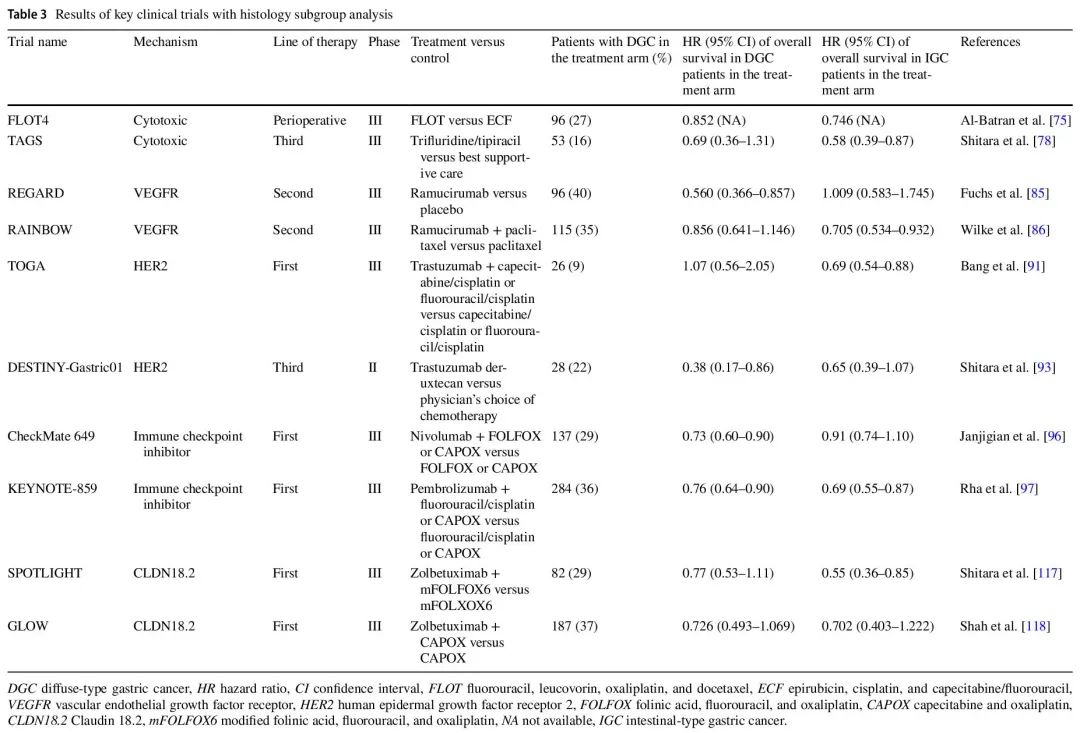
表3
化疗
使用氟嘧啶类和铂类药物这些细胞毒性药物进行全身化疗是局部和晚期胃癌治疗的基础。一项荟萃分析汇总了33篇胃癌新辅助化疗、辅助化疗或姑息性化疗相关研究,发现在所有三种治疗中,IGC的总生存期均优于DGC。这项研究包括常用的疗法,包括基于铂类和氟嘧啶类药物、伊立替康和基于紫衫类药物的化疗方案。
根据FLOT4试验,目前可切除局部晚期胃或胃食管腺癌的标准治疗是围手术期氟尿嘧啶、亚叶酸钙、奥沙利铂和多西他赛(FLOT)化疗。该 II/III 期试验比较了围手术期 FLOT(术前 4 个周期和术后 4 个周期)与围手术期表柔比星、顺铂和卡培他滨/氟尿嘧啶(ECF)[术前 3 个周期和术后 3 个周期],后者是先前的标准治疗。与 DGC 队列相比,IGC 队列在 FLOT 新辅助治疗部分后病理完全缓解率显著更高。最终试验结果发现,FLOT 提高了总生存期,IGC 的生存获益最大。
三氟尿苷/替匹嘧啶(TAS-102)是一种口服细胞毒性化疗药物,可掺入 DNA 以抑制 DNA 合成。III 期 TAGS 试验比较了三氟尿苷/替匹嘧啶vs最佳支持治疗用于既往接受过至少两种化疗方案的转移性胃或胃食管腺癌患者。总生存率有所提高,主要在IGC中观察到获益,与DGC(HR 0.69,95%CI 0.36-1.31)相比,风险比(HR)为0.58(95%置信区间[CI] 0.39-0.87)。
总体而言,在各种临床环境中,化疗对 DGC 的益处似乎较低。
血管内皮生长因子受体(VEGFR)靶向疗法
在多种恶性肿瘤(包括胃癌)中,血管生成是生长和转移的关键调节因子。血管内皮生长因子(VEGF)和 VEGF 受体(VEGFR)是血管生成的关键调节因子,已得到了大量治疗开发。在胃癌中,较高的 VEGF 和 VEGFR 水平与较差的预后相关。雷莫芦单抗是一种与 VEGFR-2 结合并阻断 VEGF 配体激活该通路的单克隆抗体。III 期REGARD试验比较了雷莫芦单抗vs安慰剂用于一线化疗进展的晚期胃或胃食管腺癌。雷莫芦单抗组的总生存期有微小但显著的改善,中位总生存期为 5.2 个月,而安慰剂组为 3.8 个月。基于组织学的进一步亚组分析中,与 IGC(HR 1.009,95% CI 0.583–1.745)相比,生存获益仅限于 DGC(HR 0.560,95% CI 0.366–0.857)。
III 期RAINBOW试验比较了雷莫芦单抗联合紫杉醇vs单用紫杉醇治疗一线化疗进展的晚期胃或胃食管腺癌。雷莫芦单抗联合紫杉醇组的总生存期较优,中位总生存期为 9.6 个月,而单用紫杉醇的中位总生存期为 7.4 个月。在基于组织学的进一步亚组分析中,与 DGC(HR 0.856,95% CI 0.641-1.145)相比,生存获益仅限于 IGC(HR 0.705,95% CI 0.534-0.932)。获益仅限于 IGC 的一个潜在原因是 DGC 中 VEGF-A 扩增的发生率较低。根据RAINBOW和REGARD试验的结果,与雷莫芦单抗单药治疗相比,雷莫芦单抗和紫杉醇联合治疗是较优的二线治疗。
人表皮生长因子受体2(HER2)靶向疗法
人表皮生长因子受体 2(HER2)通路与细胞增殖、迁移和分化有关,在包括胃癌在内的几种恶性肿瘤中过表达。曲妥珠单抗可以靶向 HER2,诱导抗体依赖性细胞毒性(ADCC)并抑制 HER2 信号传导。
III 期曲妥珠单抗治疗胃癌(TOGA)试验比较了曲妥珠单抗联合化疗vs单独化疗一线治疗HER2阳性晚期胃或胃食管腺癌。HER2 阳性定义为免疫组化(IHC)为 3+ 或荧光原位杂交阳性。曲妥珠单抗组的总生存期获益较优,但在基于组织学的进一步亚组分析中,与 DGC(HR 1.07,95% CI 0.56-2.05)相比,总生存期获益仅限于 IGC 队列(HR 0.69,95% CI 0.54-0.88)。
德曲妥珠单抗是一种抗体药物偶联物(ADC),由抗 HER2 抗体和细胞毒性拓扑异构酶 I 抑制剂偶联而成。II 期DESTINY-Gastric01试验比较了德曲妥珠单抗与化疗治疗HER2阳性胃或胃食管腺癌患者,这些患者既往至少接受过2种治疗(包括曲妥珠单抗)且进展。德曲妥珠单抗带来总生存期获益,但在基于组织学的进一步亚组分析中,与 IGC(HR 0.65,95% CI 0.39-1.07)相比,总生存期获益仅限于 DGC 队列(HR 0.38,95% CI 0.17-0.86)。
因此,当生物标志物阳性时,HER2 靶向疗法在胃癌的治疗中非常有价值;然而,由于 HER2 阳性和扩增的发生率较低,可能从这些治疗中获益的 DGC 患者数量可能较少。
免疫检查点抑制剂
免疫检查点抑制剂,例如程序性细胞死亡蛋白 1(PD-1)抑制剂,如纳武利尤单抗和帕博利珠单抗,是激活免疫系统的抗肿瘤疗法,在包括胃癌在内的多种恶性肿瘤中显示出显著益处。
III 期CheckMate 649试验比较了纳武利尤单抗联合化疗与单独化疗作为HER-2阴性晚期胃、胃食管和食管腺癌的一线治疗。加用纳武利尤单抗后观察到总生存期获益,特别是在程序性细胞死亡配体-1(PD-L1)联合阳性分数(CPS)≥ 5 的主要终点人群中。基于组织学的亚组分析发现,IGC(HR 0.73,95% CI 0.60-0.90)具有总生存期获益,而 DGC 没有(HR 0.91,95% CI 0.74-1.10)。然而,当按 PD-L1 CPS ≥5 分层时,未观察到 IGC(HR 0.69,95% CI 0.53–0.90)和 DGC(HR 0.73,95% CI 0.56–0.97)总生存期获益的差异。值得注意的是,与 IGC(347/539 例患者,64.4%)相比,DGC(278/527 例患者,52.7%)PD-L1 CPS ≥ 5 的患者比例较低。
III 期KEYNOTE-859试验比较了帕博利珠单抗联合化疗与单独化疗作为HER2阴性晚期胃或胃食管腺癌的一线治疗。然而,仅在 PD-L1 CPS ≥ 1 的患者中观察到生存获益,其中 PD-L1 CPS ≥ 10 的患者获益最大。基于组织学对该试验进行亚组分析,发现 IGC(HR 0.81,95% CI 0.67-0.98)和 DGC(HR 0.76,95% CI 0.64-0.90)均获益。在 PD-L1 CPS ≥10 患者中,基于组织学的进一步亚组分析发现 DGC 具有总生存期获益(HR 0.57,95% CI 0.42-0.78),而 IGC 没有(HR 0.77,95% CI 0.56-1.01)。然而,DGC 中 PD-L1 CPS ≥10 的患者比例(191/619,30.8%)低于 IGC(210/557,37.7%)。III 期KEYNOTE-811试验比较了帕博利珠单抗联合曲妥珠单抗和化疗vs曲妥珠单抗和化疗作为HER2阳性晚期胃或胃食管腺癌的一线治疗。帕博利珠单抗组的无进展生存期较优,在 IGC 中观察到生存获益(HR 0.73,95% CI 0.57-0.92),在 DGC 中未观察到(HR 0.71,95% CI 0.47-1.07)。
鉴于 PD-L1 CPS ≥ 1 的治疗意义,其他研究回顾性分析了各种队列,包括 PD-L1 CPS ≥ 1 定义的 PD-L1 阳性 ACRG 队列。IGC 中 PD-L1 阳性的患者比例较高,为 64.7%,而 DGC 为 54.2%,尽管根据卡方检验没有统计学意义,p 值为 0.1624。另一项大型胃癌队列研究发现,IGC 肿瘤细胞 PD-L1 阳性率较高,为 29.2%,而 DGC 为 6.2%(卡方检验,p 值为 <0.001),但 IGC 免疫细胞 PD-L1 阳性率为 37.5%,而 DGC 为 30.3%(卡方检验,p 值为 0.089)。
MSI-H 状态是一个关键标志物,也可以预测对免疫检查点抑制剂的反应。基于 II 期 KEYNOTE-158 试验,帕博利珠单抗单药治疗获得美国食品药品监督管理局(FDA)批准,用于 MSI-H 晚期泛癌种的二线治疗。在该试验中,MSI-H 晚期胃癌患者的客观缓解率为 31%,完全缓解率为 9.5%,部分缓解率为 21.4%;与 IGC 相比,DGC 的 MSI-H 发生率较低。
因此,对于 DGC 患者,有几个指标预测目前批准的免疫检查点抑制剂的获益较低。
弥漫性胃癌的新兴疗法
以下部分重点介绍了最有前途的可靶向蛋白质和通路。靶向某些受体(如 VEGFR 和 HER2)的某些靶向疗法在胃癌中取得成功,而靶向其他通路的几种疗法未取得成功,包括依维莫司靶向哺乳动物雷帕霉素靶点(mTOR),西妥昔单抗靶向表皮生长因子受体(EGFR),以及rilotumumab 和 onartuzumab 靶向肝细胞生长因子受体(MET)。尽管如此,最近几项成功的临床试验使人们对其中一些较新的靶点产生了乐观情绪。
Claudin 18.2
CLDN18 是上皮细胞中的一种紧密连接蛋白,在维持屏障功能和细胞极性方面起关键作用。CLDN18.2 是 CLDN18 的剪接亚型,在短寿命胃上皮细胞中短暂表达,在胃癌恶性转化过程中,细胞极性缺失,导致 CLDN18.2 暴露和抗体可及性。CLDN18.2 表达可能只是某些胃癌恶性转化的副产品,而不是其发病机制,这与 CLDN18.2/ARHGAP 融合不同。几项研究发现,与 IGC 相比,DGC 中 CLDN18.2 表达率更高。
Zolbetuximab(佐妥昔单抗)是一种first-in-class嵌合免疫球蛋白(Ig)G1 单克隆抗体,靶向并与 CLDN18.2 结合,诱导 ADCC 和补体依赖性细胞毒性。根据 II 期 FAST 研究,一线 zolbetuximab 联合化疗对晚期胃/胃食管腺癌的临床获益仅见于 CLDN18.2 表达较高的患者,尤其是在 ≥70% 的肿瘤细胞中 CLDN18.2 中等至强烈表达的患者中。随后探索 zolbetuximab 联合化疗治疗 HER2 阴性晚期胃/胃食管腺癌的 III 期试验使用了更高的 CLDN18.2 表达阈值:≥75% 的肿瘤细胞具有中等至强的 CLDN18 膜染色。
III 期SPOTLIGHT试验比较了zolbetuximab联合改良亚叶酸钙、氟尿嘧啶和奥沙利铂(mFOLFOX6)vs 单独mFOLFOX6治疗CLDN18.2阳性、HER2阴性的晚期胃/胃食管腺癌。zolbetuximab 联合治疗组的总生存期和无进展生存期较优。基于组织学对该试验进行亚组分析,发现 IGC(HR 0.55,95% CI 0.36–0.85)具有总生存期获益,而 DGC 没有(HR 0.77,95% CI 0.653–1.11)。该试验中 DGC 患者的比例(199/565,35.2%)高于 IGC(136/565,24.1%)。III 期GLOW试验比较了zolbetuximab联合卡培他滨和奥沙利铂(CAPOX)vs 单独CAPOX一线治疗CLDN18.2阳性、HER2阴性晚期胃或胃食管腺癌。zolbetuximab 联合治疗组的总生存期和无进展生存期较优。基于组织学对该试验进行亚组分析,发现 IGC(HR 0.702,95% CI 0.403-1.222)和 DGC(HR 0.726,95% CI 0.493-1.069)具有总生存期获益的趋势。该试验中 DGC 患者的比例(187/507,36.9%)高于 IGC(77/507,15.2%)。zolbetuximab 治疗相关不良反应包括恶心、呕吐和食欲下降。
这些研究促使进一步开发 CLDN18.2 靶向疗法,特别是那些可能在较低 CLDN18.2 表达水平下有效的疗法,因为 zolbetuximab 获益需要高阈值。利用 CLDN18.2 的疗法正在开发中,通过不同药物机制,包括 ADC、嵌合抗原受体(CAR)T 细胞和双特异性抗体(图 3)。其中一些疗法可能利用旁观者效应,可能导致非CLDN18.2表达的肿瘤细胞被杀死。
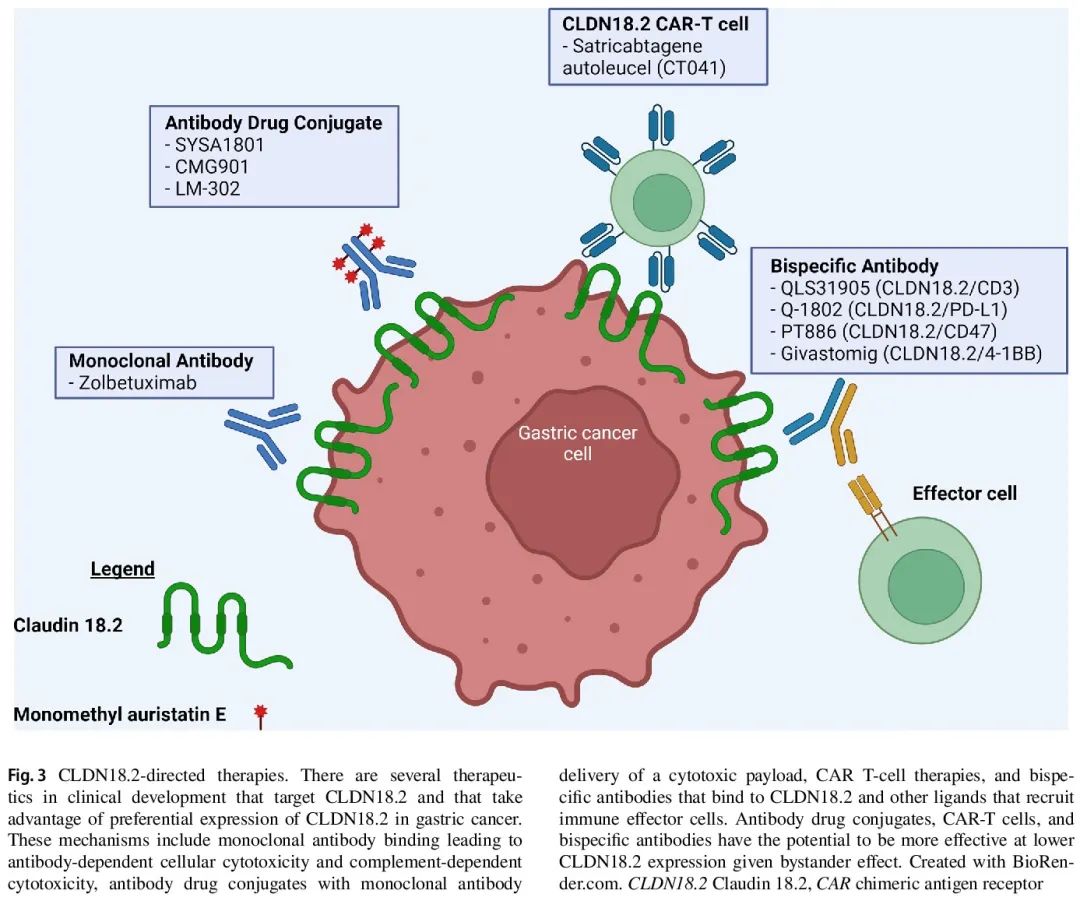
图3
ADC 将单克隆抗体与细胞毒性有效载荷连接,为感兴趣的特定细胞提供更有针对性的细胞毒性治疗。多种靶向 CLDN18.2 的 ADC 具有甲基奥瑞他汀E(MMAE)细胞毒性有效载荷,包括 SYSA1801、CMG901 和 LM-302。这些药物在早期试验中显示出有希望的结果,毒性可控。这些试验的剂量扩展要素包括 CLDN18.2表达患者(40%以上的肿瘤细胞IHC染色强度≥2+)。其他几种 ADC 正在开发中或处于早期试验阶段。
CAR T 细胞是经过工程改造的 T 细胞,表达与目标抗原结合的受体。CAR T 细胞疗法大大改善了血液系统恶性肿瘤的治疗,但迄今为止对实体瘤的益处有限。CT041(satricabtagene autoleucel)是一种 CAR T 细胞疗法,具有人源化抗 CLDN18.2 单链可变片段、CD8α 铰链区、CD28 共刺激结构域和 CD3ζ 信号结构域。一项正在进行的 CT041 中国 I 期试验的中期结果显示,在既往接受过多线治疗的 CLDN18.2 阳性胃癌患者(DGC 占比高)中,客观缓解率为 57.1%,6 个月总生存率为 81.2%。48.6% 的患者具有低或中等 CLDN18.2 表达(分别定义为 < 40% 或任意比例 IHC染色强度 1+ 和 40-69% 强度 ≥ 2+)。在美国的一项 Ib/IIb 期研究中,CT041 在晚期 CLDN18.2 阳性胃癌中的客观缓解率为 42.9%,中位缓解持续时间为 6.9 个月。其他 CAR T 细胞疗法正在开发中,具有不同的特征,例如它们的共刺激结构域。
双特异性抗体经过工程改造,可以结合两个邻近不同细胞之间或同一细胞膜上的两个不同表位。这种结合可导致同时或连续通路激活。有许多潜在的组合可以介导胃癌的抗肿瘤功效。双特异性 T 细胞接合剂将靶向肿瘤特异性抗原的抗体与激活靶向表位附近 T 细胞的抗体连接起来。QLS31905是一种CLDN18.2/CD3双特异性抗体,将T细胞表面CD-3募集到CDN18.2,已进行了I期试验,用于既往接受过多线治疗的晚期CLDN18.2阳性肿瘤(定义为 CLDN18.2 ≥1%)。在接受每周一次 200 μg/kg 或更高的患者中,胃癌疾病稳定率较高,尤其是在中等或高 CLDN18.2 表达的患者中。Q-1802 是一种 CLDN18.2/PD-L1 双特异性抗体,除了介导 ADCC 和抗体依赖性细胞介导的吞噬作用(ADCP)外,还可募集表达 PD-L1 的细胞,如 T 细胞、巨噬细胞和自然杀伤细胞。一项 I 期研究探索了 Q-1802 用于晚期胃肠道恶性肿瘤,中期结果显示,9 例 CLDN18.2 阳性患者中有 2 例部分缓解和 4 例疾病稳定。PT886 是一种 CLDN18.2/CD47 双特异性抗体,可与 CD47 结合,增加巨噬细胞介导的吞噬活性,并利用 IgG1 增强 ADCC 和 ADCP。目前,PT886治疗CLDN18.2阳性晚期胃、胃食管和胰腺腺癌的I 期剂量递增和扩展试验正在进行中。Givastomig 是一种 CLDN18.2/4-1BB 双特异性抗体,与 CD137 结合,诱导肿瘤坏死因子(TNF)α 介导的 CD8+ T 细胞刺激、自然杀伤细胞增殖和干扰素γ产生,以 CLDN18.2 依赖性方式进行。Givastomig 用于 CLDN18.2 阳性癌症的 I 期剂量递增试验中已显示出初步疗效,在 18 例胃癌患者中有 4 例部分缓解和 2 例疾病稳定。
还有其他 CLDN18.2 靶向疗法正在开发中。鉴于 DGC 中 CLDN18.2 表达的比例较高,CLDN18.2 靶向疗法很有希望为该人群提供临床获益。
成纤维细胞生长因子受体2(FGFR2)
在几种恶性肿瘤中,成纤维细胞生长因子受体(FGFR)通路刺激细胞增殖、血管生成和转化。该通路由四种跨膜酪氨酸激酶受体(FGFR1-4)介导。在一部分胃癌中,FGFR2 基因扩增、FGFR2 突变、FGFR2 融合和 FGFR2b 剪接变体过表达导致 FGFR2 通路改变。下游丝裂原活化蛋白激酶(MAPK)和 PI3K 通路激活(图 2)。FGFR2基因扩增存在于约4-9%的胃癌,FGFR2b过表达存在于约30%的胃癌。这些 FGFR2 改变在 DGC 中发生率较高,与较差的临床结果相关。
Bemarituzumab(贝玛妥珠单抗)是一种非岩藻糖基化单克隆抗体,靶向 FGFR2b 受体,阻断 FGFR2b 信号传导,并激活 FcγRIIIa/CD16a,增强 ADCC。II 期FIGHT试验比较了bemarituzumab联合化疗(mFOLFOX6)与单独mFOLFOX6用于HER2阴性、FGFR2b选择的晚期胃或胃食管腺癌。在该试验中,FGFR2b 过表达定义为 IHC 显示超过 0% 的肿瘤细胞染色强度 ≥ 2+ 或循环肿瘤 DNA 显示 FGFR2 基因扩增。在该试验的最终临床分析中,bemarituzumab 在整个队列中有改善无进展生存期和总生存期的趋势。在对 ≥ 10% 的肿瘤细胞 FGFR2b 过表达的患者进行的亚组分析中,无进展生存期和总生存期均有显著改善,中位生存期为 24.7 个月(95% CI 14.2-30.1 个月)与 11.1 个月(95% CI 8.4-13.8 个月)相比显著。没有按组织学进行亚组分析。一项更大规模的 III 期试验正在进行中,仅包括 IHC 显示 ≥ 10% 的肿瘤细胞 FGFR2b 过表达的患者。
还有几项临床试验利用酪氨酸激酶抑制剂靶向胃癌患者中的 FGFR2 改变,包括福巴替尼(NCT04604132)、厄达替尼(NCT02699606)、英菲格拉替尼(NCT05019794)和 derazantinib(NCT04604132)。这些试验的完整结果尚未公布。
总体而言,这些发现强调了靶向 FGFR2 改变作为 DGC 中一种有前途的治疗策略的潜力,正在进行的临床试验有望进一步阐明其疗效。
黏着斑激酶(FAK)通路
黏着斑激酶(FAK)是一种非受体酪氨酸激酶和激酶非依赖性支架,参与调节细胞迁移、生长因子信号传导和细胞存活。异常的 FAK 信号传导存在于许多恶性肿瘤中(包括胃癌),与细胞增殖、侵袭、转移、机械转导、EMT、免疫抑制微环境和耐药性有关。磷酸化 FAK 是 FAK 信号转导的标志物,是局限性胃癌的不良预后标志物,估计存在于 ~30-40% 的 DGC 中。一项研究评估了手术样本,发现与 IGC 样本相比,DGC 样本中磷酸化 FAK 更高。
一个具有 CDH1 缺失和 RHOA Y42C 突变的 DGC 临床前模型发现,FAK 激活和依赖性增加,进一步诱导 PI3K/AKT 和 YAP/TAZ 通路(图 2)。FAK 抑制剂 defactinib 或 PF-573228 单药治疗减少了体外和体内生长。使用该DGC模型的临床前研究观察到FAK抑制剂联合哌柏西利(细胞周期蛋白依赖性激酶4/6抑制剂)或VS-6766(快速加速纤维肉瘤[RAF]/MAPK激酶[MAPK]抑制剂,avutometinib)的协同作用。这些联合方案的选择基于先前的协同评估和先前在其他疾病模型中识别的 FAK 抑制剂单药治疗的适应性耐药机制。同样,MEK 抑制可导致 FAK 信号传导的适应性耐药机制。
多种FAK抑制剂已在临床试验中进行了评估,包括defactinib、ifebemtinib(IN10018)、GSK2256098、康太替尼(conteltinib,CT-707)和APG-2449。从机制上讲,这些 FAK 抑制剂是 5′三磷酸腺苷(ATP)竞争性抑制剂。Defactinib 是一种 ATP 竞争性、可逆的 FAK 和富含脯氨酸的酪氨酸激酶-2(Pyk2)抑制剂。在临床试验中,FAK 抑制剂单药治疗疗效较低,可能是由于固有或获得性耐药。Avutometinib 是一种first-in-class RAF/MEK 抑制剂,通过上游 RAF 阻断 MEK 和 MEK 代偿再激活机制。defactinib 和 avutometinib 联合疗法正被探索用于多种其他实体瘤,包括非小细胞肺癌(NCT04620330)、甲状腺癌(NCT06007924)、女性生殖道中肾癌(NCT05787561)、胰腺癌(NCT05669482)和低级别浆液性卵巢癌(NCT04625270)。defactinib 和 avutometinib治疗复发性低级别浆液性卵巢癌,以及 defactinib 和 avutometinib联合吉西他滨和白蛋白结合型紫杉醇治疗胰腺癌的 Ib/II 期临床试验显示了有希望的临床疗效。该联合疗法总体耐受性良好,但 3 级或更高级别的不良反应包括肌酸磷酸激酶升高、疲劳和皮疹。一项 defactinib 和 avutometinib 用于一线全身治疗后进展的转移性 DGC 的临床试验最近开始招募,这是首个专门招募 DGC 组织学(NCT06487221)个体的临床试验。鉴于临床前数据和其他临床试验中总体耐受性良好,该联合疗法可能对 DGC 有希望。
另一个 CLDN18-ARHGAP26 融合与 TP53 突变驱动的 DGC 临床前模型发现 RHOA 激活以及下游 FAK 和 YAP/TEAD 通路激活(图 2)。FAK 抑制剂 defactinib 或 PF-573228 单药治疗是有益的。defactinib 和 TEAD 抑制剂 VT103 联合治疗显示出协同益处,阻止体外和体内生长。
因此,对于 DGC 患者,尤其是携带 RHOA Y42C 突变和 CLDN18-ARHGAP26 融合的患者,FAK 抑制剂与靶向其他耐药代偿机制的联合疗法可能是一种有前途的治疗策略。
Hippo信号通路
Hippo 信号通路是器官大小和组织稳态的关键调节因子,其失调与多种恶性肿瘤(包括胃癌)的发生有关。Hippo 通路激活导致通过激酶介导的磷酸化级联抑制其末端效应子 Yes 相关蛋白(YAP)和 PDZ 结合基序的转录共激活因子(TAZ)。Hippo 通路中上游调节因子失活导致 YAP/TAZ 核定位及与 TEAD 1-4 结合,从而介导对肿瘤发生、增殖和存活至关重要的几种通路。
YAP/TAZ 过表达与胃癌转移增加、进展和预后较差有关。同样,YAP/TAZ 上游负调节因子(如大型抑癌基因激酶 1(LATS1)或哺乳动物 STE20 样蛋白激酶 1/2(MST1/2))失活,与类似较差的临床结局有关。在 TCGA 数据库中,14% 的胃癌存在 TEAD 改变,TEAD1-4 过表达与胃癌临床预后不良相关,并且与间充质亚型胃癌有关。
在胃癌中,药理学上,Hippo 通路可通过多种机制靶向,包括靶向 YAP/TAZ-TEAD 复合物、抑制 YAP/TAZ 核定位、靶向上游调节通路以及抑制 TEAD 棕榈酰化或蛋白质-蛋白质相互作用。
维替泊芬(VP)是一种苯并卟啉衍生物,可通过抑制 FAT 非典型钙粘蛋白 1(FAT1)和靶向胃癌干细胞,抑制 YAP/TAZ-TEAD 复合物,在体外和体内减缓胃癌生长。CA-3 是一种 YAP 抑制剂,可调节 YAP/TEAD 转录活性,降低 YAP 表达。靶向转录调节因子(如退化样家族成员 4(VGLL4))的模拟药物也显示出有希望的疗效。VGLL4 与 YAP 竞争,通过 Tondu(TDU 结构域)与 TEAD 结合,作为 YAP 拮抗剂发挥作用。Super-TDU 是一种 VGLL4 模拟肽,可在体外和体内减少胃癌生长。Striatin-3(STRN3)是蛋白磷酸酶 2A(PP2A)的调节亚基,可招募 MST1/2 并导致去磷酸化,从而导致下游 YAP 激活。STRN3 衍生的 Hippo 激活肽(SHAP)是一种选择性肽抑制剂,可破坏 STRN3-PP2A 相互作用并阻止 YAP/TAZ 核定位,在体内抑制胃癌生长。操作肌动蛋白细胞骨架和机械转导系统可能导致 YAP/TAZ 信号转导异常。在前面提到的 CDH1 缺失和 RHOA Y42C 突变的 DGC 临床前模型中,RHOA 介导的 FAK 激活诱导 YAP/TAZ 通路激活,FAK 抑制剂有益。
鉴于TEAD1-4需要保守半胱氨酸处的自棕榈酰化来起作用,许多抑制剂设计为共价和非共价阻断TEAD自棕榈酰化。共价抑制剂包括 TED-347(TEAD4-YAP 相互作用)、DC-TEADin02(TEAD4 选择性)和 K-975(泛 TEAD)。非共价抑制剂包括 VT103(TEAD1 选择性)。这些 TEAD 抑制剂和其他靶向 Hippo 通路其他方面的疗法已在几个 DGC 临床前模型中显示出疗效。
具有 CLDN18-ARHGAP26 融合和 TP53 缺失的 DGC 临床前模型发现 RHOA 激活以及下游 FAK 和 YAP/TEAD 通路激活(图 2)。使用 FAK 抑制剂 defactinib 或 PF-573228 单药治疗是有益的。defactinib 和 TEAD1 抑制剂 VT103 联合治疗在阻止体外和体内生长方面显示出协同益处。基于四个大型数据集,先前提到的 MesGC 共识表型被认为是 DGC 的统一表型,TEAD1 被确定为致癌转录程序的主要调节因子。用 VP、CA3 或 TED-347 抑制 YAP/TEAD 显著降低了 MesGC 细胞系体外生长。
Tanaka 等人分析了 98 例有恶性腹水的胃癌的多组学数据,恶性腹水是一种与 DGC 密切相关的疾病。通过基因表达谱的分层聚类,识别了 EMT 和非 EMT 两个不同集群,这两者均存在大量 MAPK 通路改变。EMT 组存在 YAP、TAZ、TEAD1、TEAD2 和 TEAD4 过表达。K-975 用于 EMT 细胞系和体内模型。体外有与 TEAD1 表达水平成正比的显著肿瘤生长抑制。鉴于 MAPK 基因变异的高发生率和先前证据表明 YAP/TAZ-TEAD 激活是 MEK 抑制剂耐药机制,在 EMT 胃癌细胞系中进行了 MEK1/2 抑制剂比美替尼和 K-975 联合治疗,并在 TEAD1 高表达的细胞系中显示出协同效应。
大多数靶向 Hippo 通路不同方面的疗法尚未进入临床试验。一项脂质体 VP 治疗 EGFR 突变复发性高级别胶质母细胞瘤的 I/II 期临床试验(NCT04590664)正在进行中。ION537 是一种靶向 YAP mRNA 的反义寡核苷酸,一项 I 期临床试验评估了其用于晚期实体瘤(NCT04659096)。目前临床试验中的 TEAD 抑制剂包括 IAG933(NCT04857372)、IK-930(NCT05228015)和 VT3989(NCT04665206)。IAG933 是一种泛 TEAD 抑制剂,通过空间阻断几种共激活因子直接靶向 YAP-TEAD 蛋白-蛋白质相互作用。临床前研究表明,IAG933 联合 RTK 抑制剂在各种恶性肿瘤(包括胃癌)的体外模型显示出益处。一项 I 期临床试验正在探索 IAG933 用于晚期间皮瘤,血管内皮瘤,NF2/LATS1/LATS2 突变或功能性 YAP/TAZ 融合患者(NCT04857372)。IK-930是一种靶向棕榈酰化的TEAD1抑制剂,一项临床试验正评估其用于治疗具有NF2突变或YAP/TAZ融合的晚期恶性肿瘤,恶性胸膜间皮瘤或上皮样血管内皮瘤。VT3989 是一种靶向棕榈酰化的 TEAD 抑制剂,在恶性间皮瘤和具有NF2 突变或 YAP/TAZ 基因变异的其他肿瘤中显示出有希望的 I 期临床试验数据。临床获益率为 57%(疾病稳定或部分缓解),不良反应包括可逆性白蛋白尿、蛋白尿和外周水肿,无剂量限制性毒性。尚未报道参加这些试验的潜在胃癌患者的临床反应。
在临床上,靶向 Hippo 通路的药物目前处于开发的早期阶段,但鉴于 YAP/TEAD 激活在胃癌和几种特别侵袭性的 DGC 临床前模型中发挥关键作用,仍有很大的前景。
总 结
DGC 是胃癌的一种临床侵袭性亚型,与 IGC 亚型相比,对许多目前获批的临床治疗的反应较差。令人担忧的是,年轻人群、女性和少数族裔的 DGC 发病率不断上升。多组学研究更好地将胃腺癌分为不同的分子亚型,识别了 DGC 的独特分子改变,特别是 CDH1 和 RHOA 突变以及 CLDN18-ARHGAP26 融合。具有这些改变的 DGC 临床前模型为发病机制和信号通路异常的关键机制提供了额外的见解,并通过靶向 FAK 和 Hippo 通路识别了潜在的治疗敏感性。首个使用 FAK 抑制剂和 MAPK 抑制剂靶向治疗 DGC 的临床试验正在进行中。我们乐观地期待靶向这些通路的其他类似药物将进入临床试验领域。
基于 CLDN18.2 和 FGFR2b 的疗法令人兴奋,因为最近有希望的临床试验显示 DGC 和 IGC 的临床获益。基于 CLDN18.2 的疗法用途特别广泛,可利用多种治疗机制,包括 ADC、双特异性抗体和 CAR T 细胞,可能在 CLDN18.2 阳性水平较低时具有较高的效果。这些疗法处于临床前和临床开发的不同阶段,鉴于生物标志物阳性率较高,可能对 DGC 患者较有效。这些临床前和临床进展代表了 DGC 治疗的前景。
参考文献:
Wu, L.W., Jang, S.J., Shapiro, C. et al. Diffuse Gastric Cancer: A Comprehensive Review of Molecular Features and Emerging Therapeutics. Targ Oncol (2024). https://doi.org/10.1007/s11523-024-01097-2

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















弥漫性胃癌的分子特征和新兴靶向疗法
22
#靶向治疗# #弥漫性胃癌#
23