【协和医学杂志】我国霉菌感染流行病学分析:多中心回顾性研究
2023-09-06 协和医学杂志 协和医学杂志 发表于加利福尼亚
本研究基于中国医院侵袭性真菌病监测网,对不同地区代表性参与单位的霉菌感染患者资料进行回顾性研究,分析我国霉菌感染的流行病学现状,以期为临床治疗霉菌感染提供数据参考。
随着激素、免疫抑制剂、广谱抗菌药物的广泛使用,以及肿瘤及免疫缺陷患者人数的不断增加,侵袭性真菌病已成为严重威胁人类健康的疾病,在全球范围内每年真菌感染导致的死亡人数已超过150万[1]。
世界卫生组织于2022年10月25日首次发布了构成公共健康风险的19种真菌病原体清单,其中包括烟曲霉、毛霉目、镰刀菌属和赛多孢霉等多种霉菌[2]。霉菌感染发生率呈逐年上升趋势,为医疗系统和患者带来了沉重负担[3],而目前国内多数实验室尚不具备霉菌检测能力,霉菌感染流行病学数据相关报道较少,导致临床诊疗缺乏参考依据[4]
因此,本研究基于中国医院侵袭性真菌病监测网,对不同地区代表性参与单位的霉菌感染患者资料进行回顾性研究,分析我国霉菌感染的流行病学现状,以期为临床治疗霉菌感染提供数据参考。
1 资料与方法
1.1 研究对象
选取2019年1月—2022年6月,中国医院侵袭性真菌病监测网中19家单位的霉菌监测数据(所在地区包括北京、上海、重庆、河北省、山西省、辽宁省、吉林省、黑龙江省、安徽省、福建省、山东省、河南省、湖北省、湖南省、广东省、四川省、内蒙古自治区和广西壮族自治区),对各单位的霉菌感染患者资料进行菌种构成及临床感染情况等流行病学特征分析。
本研究已通过北京协和医院伦理审查委员会审批(审批号:S-263),并豁免患者知情同意。
1.2 研究方法
由各参与单位通过WHONET软件导出微生物实验室霉菌分离数据及霉菌感染患者相关临床信息,并汇总至中心实验室(北京协和医院检验科)进行统一数据处理及分析,采用WHONET软件对患者的性别、年龄、科室、标本类型和菌种等字段统一相应代码,并剔除同一患者同一部位重复分离出的相同病原体及浅表病原真菌(如毛癣菌属、小孢子菌属及表皮癣菌属等)。
1.3 统计学处理
采用WHONET 5.6软件进行数据处理和统计分析。计算霉菌感染患者的年龄、性别及科室分布构成比;计算不同菌种整体构成比和在不同类型标本中的构成比等。
2 结果
2.1 一般资料
共纳入16285例霉菌感染患者,其中男性(62.1%)多于女性(37.9%)。以老年患者为主,年龄中位数为60岁,年龄≥61岁患者占比49.3%(8023/16285)。主要分布于内科、ICU和外科,其中内科患者占比最高(表1)。
表1 16 285例霉菌感染患者一般临床资料[n(%)]
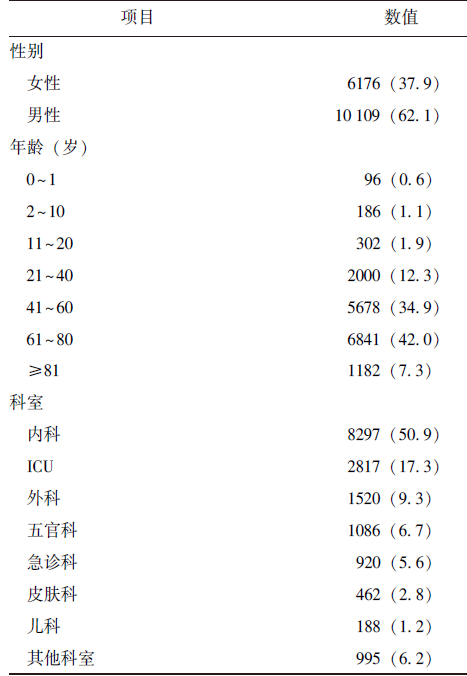
不同内科科室患者占比如下:
2.2 霉菌菌种构成及标本分布情况
16 285株霉菌中,以曲霉属占比最高为84.8%(13806/16285);标本类型以下呼吸道标本为主,占比81.7%(13305/16285)(表2)。
表2 16 285株霉菌菌种构成及标本分布[n(%)]
2.2.1 曲霉属菌种构成及标本分布情况
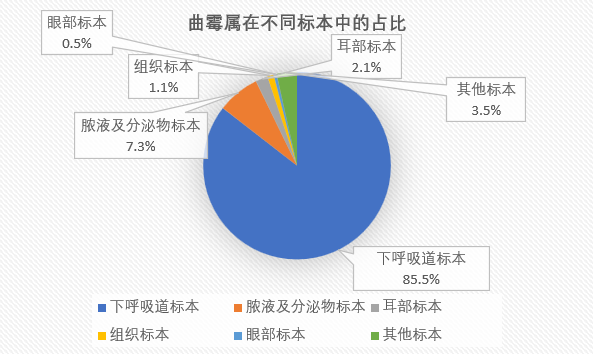
曲霉属共13806株,其菌种构成情况见表3。
表3 曲霉属菌种构成[n(%)]
曲霉属在不同标本中的占比如下:
2.2.2 毛霉目种属构成及标本分布情况
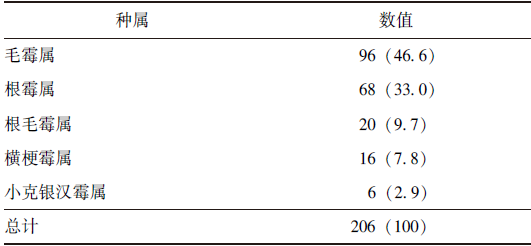
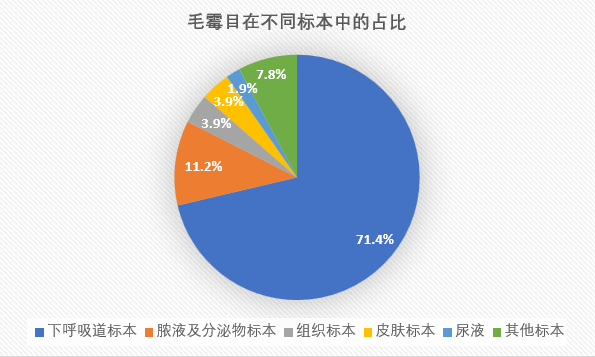
毛霉目共206株,种属构成情况见表4。
表4 毛霉目种属构成[n(%)]
毛霉目在不同标本中的占比如下:
2.2.3 镰刀菌属标本分布情况
镰刀菌属共493株,在不同标本中的占比分别为:脓液及分泌物标本27.4%(135/493),眼部标本22.9%(113/493),下呼吸道标本22.1%(109/493),皮肤标本13.8%(68/493),组织标本4.7%(23/493),血液标本1.8%(9/493),其他标本7.3%(36/493)。
2.2.4 赛多孢霉标本分布情况
赛多孢霉共57株,在不同标本中的占比分别为:下呼吸道标本61.4%(35/57),脓液及分泌物标本15.8%(9/57),组织标本8.8%(5/57),血液标本3.5%(2/57),其他标本10.5%(6/57)。
2.3 霉菌引起的常见感染性疾病菌种分布
2.3.1 下呼吸道感染霉菌菌种分布
下呼吸道感染霉菌共13305株,其中曲霉属占比88.7%(11806/13305),包括烟曲霉、黄曲霉、黑曲霉、土曲霉、构巢曲霉、杂色曲霉和其他曲霉属等;毛霉目占比1.1%(147/13305),包括毛霉属、根霉属、横梗霉属、根毛霉属、小克银汉霉属(图1)。
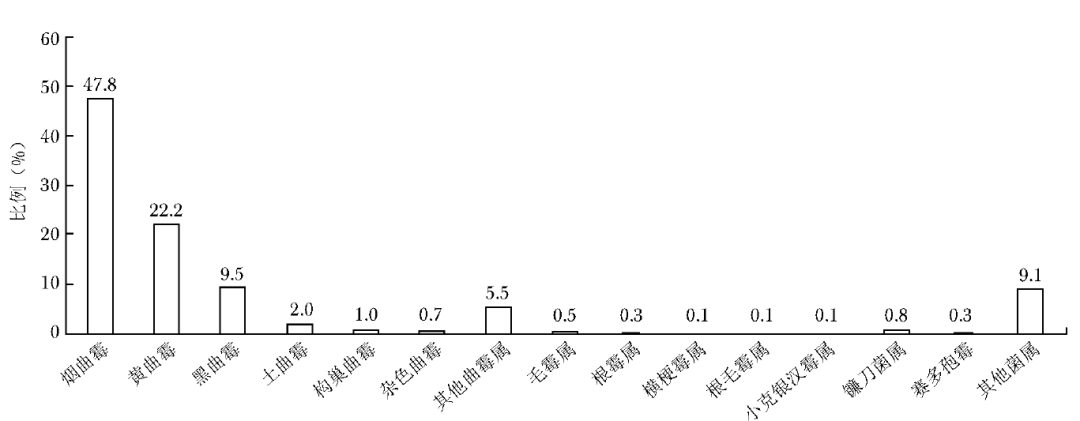
图1 下呼吸道感染霉菌菌种分布图
2.3.2 耳部感染霉菌菌种分布
耳部感染霉菌共300株,曲霉属占比高达98.7%(296/300),其中最常见菌种为土曲霉,其次为黄曲霉及黑曲霉,烟曲霉及其他曲霉占比较低(图2)。
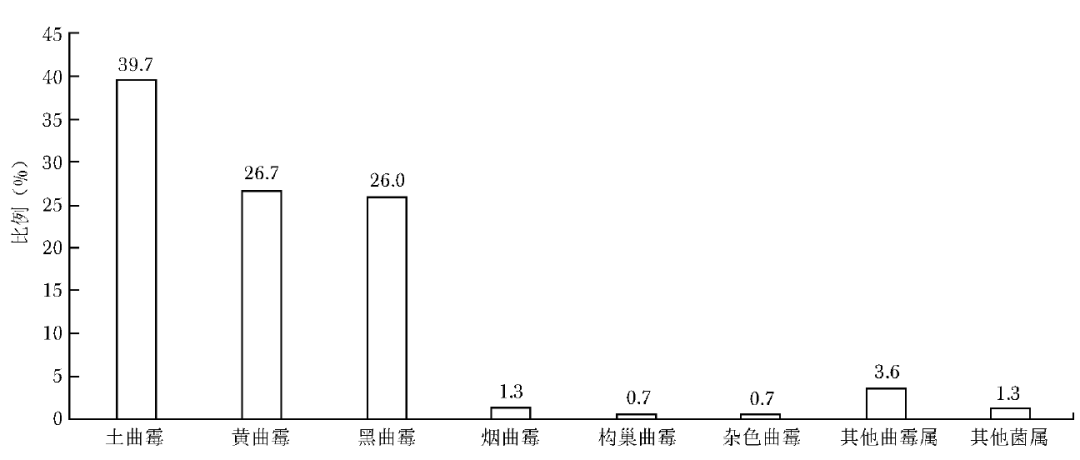
图2 耳部感染霉菌菌种分布图
2.3.3 眼部感染霉菌菌种分布
眼部感染霉菌共207株,其中镰刀菌属占比最高,其次是曲霉属,其中以烟曲霉最常见(图3)。
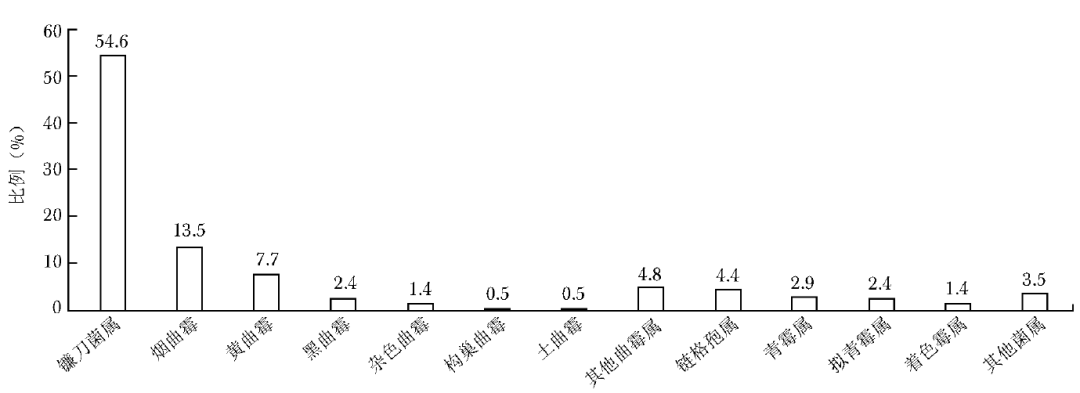
图3 眼部感染霉菌菌种分布图
3 讨论
本研究对国内多家参与单位的霉菌感染患者资料进行分析,获得国内霉菌感染的流行病学数据。结果显示,男性患者比例高于女性,这与目前已有报道结果一致,但具体原因尚不清楚[5-6]。患者以老年人为主,多数患者存在基础疾病或免疫抑制,因此,霉菌感染的高发人群包括接受医疗干预者、因治疗相关疾病或基础疾病而导致免疫抑制者、患有细菌或病毒混合感染者及通过环境暴露导致感染的免疫功能正常者等[7]。
本研究对霉菌菌种进行分析,结果显示曲霉属、青霉属、镰刀菌属、毛霉目和赛多孢霉占比较高。一项针对亚洲5个国家的侵袭性霉菌感染回顾性分析结果显示,常见种属包括曲霉属(71.6%)、毛霉目(10.2%)、镰刀菌属(2.3%)、其他种属(8.0%)及混合感染(8.0%)[8],曲霉属占比与本研究结果相似,为临床分离最常见的霉菌。
而本研究中毛霉目分离比例(1.3%)明显低于上述研究结果,一项关于中国大陆地区毛霉菌病的回顾性研究结果表明仅55.1%的病例获得微生物检测阳性结果,明显低于其他国家,可能原因是取材困难及真菌实验室检测能力不足[8-10]。
随着COVID-19疫情不断蔓延和扩散,合并肺毛霉菌病的发生率也明显增加,如未在早期进行诊断及治疗,死亡率可高达80%,因此国内真菌实验室应提高真菌感染的检测能力,这对于COVID-19 患者的临床综合管理具有重要意义[11]。除曲霉属及毛霉目外,镰刀菌属及赛多孢霉也是临床需要关注的霉菌。镰刀菌属不仅可引起角膜炎,也会导致皮肤及伤口感染、肺炎、真菌血症和播散性感染等,感染类型主要取决于患者自身的免疫状态,多数实验室常规检测仅鉴定至属水平,而通过基因检测可将镰刀菌属分为7个复合群[12]。
一项针对我国中原地区真菌性角膜炎分离的镰刀菌属基因型检测结果显示,以腐皮镰刀菌种复合体最多,赤霉菌种复合体和尖孢镰刀菌复合体次之[13]。国内赛多孢霉检出率偏低,一项回顾性分析提示其常见部位为眼、肺、颅内、鼻窦、皮肤、关节等,感染类型以创伤后局部感染为主,其他类型包括溺水后感染、免疫功能明显受损后感染及呼吸道内定植感染等,临床以尖端赛多孢霉感染为主[14-15]。
本研究对于霉菌引起的常见感染性疾病菌种分布进行分析发现,虽然霉菌菌种中最常见的是曲霉属,但不同感染部位的霉菌菌种存在差异,呼吸道分离出的菌种以曲霉属为主,最常见于烟曲霉,其与黄曲霉、黑曲霉和土曲霉的占比与其他研究结果相似[16]。肺部分离出的毛霉目种属以毛霉属和根霉属为主,其次为横梗霉属和根毛霉属,这与国内外其他相关研究结果一致[9,17]。
耳部分离出的菌种以土曲霉较常见(39.7%),而烟曲霉占比偏低(1.3%)。国内一项多中心研究显示,耳部分离出的菌种中黑曲霉占比最高(36.2%)、土曲霉(15.9%)及黄曲霉(11.6%)次之、烟曲霉最低(2.9%)[18],而伊朗一项研究表明耳部感染菌种依次为黑曲霉(65.1%)、黄曲霉(21.7%)、烟曲霉(9.3%)及土曲霉(1.3%)[19]。不同国家和地区所报道的耳部霉菌感染菌种构成比存在明显差异,因此对于临床真菌感染的经验性诊疗应参考本地区流行病学数据。眼部分离出的菌种以镰刀菌属为主,曲霉属次之,链格孢属占比较低,该结果与中国东南地区关于真菌性角膜炎的研究结果相似[20]。
本研究局限性:霉菌数据由不同单位提供,因此未能对菌种进行复核鉴定,部分菌种如镰刀菌属及赛多孢霉仅分析至属的水平。基于真菌监测网将开展中国霉菌感染的主动监测项目,旨在提供更加精准的霉菌流行病学数据,为临床诊疗提供重要的监测数据。
参考文献
[1]Bongomin F, Gago S, Oladele RO, et al. Global and Multi-National Prevalence of Fungal Diseases:Estimate Precision[J]. J Fungi (Basel), 2017, 3: 57.
[2]WHO fungal priority pathogens list to guide research, development and public health action[M]. World Health Organization, 2022.
[3]von Lilienfeld-Toal M, Wagener J, Einsele H, et al. Inva-sive Fungal Infection[J]. Dtsch Arztebl Int, 2019, 116: 271-278.
[4]Wang H, Wang Y, Yang QW, et al. A national survey on fungal infection diagnostic capacity in the clinical mycology laboratories of tertiary care hospitals in China[J]. J Microbiol Immunol Infect, 2020, 53: 845-853.
[5]Xiao M, Chen SC, Kong F, et al. China Hospital Invasive Fungal Surveillance Net (CHIF-NET) Study Group. Five-year China Hospital Invasive Fungal Surveillance Net (CHIF-NET) study of invasive fungal infections caused by noncandidal yeasts: species distribution and azole susceptibility[J]. Infect Drug Resist, 2018, 11:1659-1667.
[6]Wang Q, Cai X, Li Y, et al. Molecular identification, antifungal susceptibility, and resistance mechanisms of patho-genic yeasts from the China antifungal resistance surveillance trial (CARST-fungi) study[J]. Front Microbiol, 2022, 13:1006375.
[7]Firacative C. Invasive fungal disease in humans: are we aware of the real impact?[J]. Mem Inst Oswaldo Cruz, 2020, 115: e200430.
[8]Rotjanapan P, Chen YC, Chakrabarti A, et al. Epidemio-logy and clinical characteristics of invasive mould infections: A multicenter, retrospective analysis in five Asian countries[J]. Medical Mycol, 2018, 56: 186-196.
[9]Wei L, Zhu P, Chen X, et al. Mucormycosis in China: A Systematic Review of Case Reports[J]. Mycopathologia, 2022, 187: 1-14.
[10]Vallabhaneni S, Benedict K, Derado G, et al. Trends in Hospitalizations Related to Invasive Aspergillosis and Mucormycosis in the United States, 2000—2013[J]. Open Forum Infect Dis, 2017, 4: ofw268.
[11]Krishna V, Bansal N, Morjaria J, et al. COVID-19-Associated Pulmonary Mucormycosis[J]. J Fungi, 2022, 8: 711.
[12]Song Y, Liu X, Yang Z, et al. Molecular and MALDI-ToF MS differentiation and antifungal susceptibility of prevalent clinical Fusarium species in China[J]. Mycoses, 2021, 64: 1261-1271.
[13]孙声桃,吕奇学,韩雷,等. 我国中原地区653株真菌性角膜炎分离镰刀菌的基因型及药物敏感性[J]. 中华眼科杂志, 2015, 51: 660-667.
[14]杨之辉,余进,李若瑜. 中国大陆地区赛多孢霉感染流行现状的回顾性分析 [J]. 中国真菌学杂志, 2019, 14: 183-188, 192.
[15]Chen M, Zhu X, Cong Y, et al. Genotypic diversity and antifungal susceptibility of Scedosporium species from clinical settings in China[J]. Mycoses, 2022, 65: 1159-1169.
[16]Paulussen C, Hallsworth JE, álvarez-Pérez S, et al. Ecology of aspergillosis: insights into the pathogenic potency of Aspergillus fumigatus and some other Aspergillus species[J]. Microb Biotechnol, 2017, 10: 296-322.
[17]Jeong W, Keighley C, Wolfe R, et al. The epidemiology and clinical manifestations of mucormycosis: a systematic review and meta-analysis of case reports[J]. Clin Microbiol Infec, 2019, 25:26-34.
[18]Jing R, Yang WH, Xiao M, et al. Species identification and antifungal susceptibility testing of Aspergillus strains isolated from patients with otomycosis in northern China[J]. J Microbiol Immunol Infect, 2022, 55: 282-290.
[19]Gharaghani M, Seifi Z, Zarei Mahmoudabadi A. Otomycosis in Iran: A Review[J]. Mycopathologia, 2015, 179: 415-424.
[20]Lin Y, Zhang J, Han X, et al. A retrospective study of the spectrum of fungal keratitis in southeastern China[J]. Ann Palliat Med, 2021, 10: 9480-9487.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








