CAR-NK细胞免疫疗法简述
2024-12-06 聊聊血液 聊聊血液 发表于陕西省
本文介绍 CAR-NK 细胞疗法在肿瘤免疫治疗中的潜力、优势,阐述其面临体内持久性、免疫抑制微环境等挑战及对应策略,列举多方面相关参考文献。
嵌合抗原受体 (CAR)-T 细胞疗法改变了血液恶性肿瘤的治疗格局,但考虑到与制备自体细胞产品相关的可靠时间和成本限制,以及管理相关毒性风险(如细胞因子释放综合征和神经毒性)的固有挑战,人们对 “现货型”异基因治疗也越来越感兴趣。其中自然杀伤 (NK) 细胞是 CAR 工程中一种特别有前景的异基因疗法,其利用其固有的生殖细胞系编码受体和抗体依赖性细胞毒性 (ADCC),NK细胞可以有效靶向杀死癌细胞,而无需预先启动,因此可以克服抗原逃逸机制,同时将移植物抗宿主病的风险降至最低。
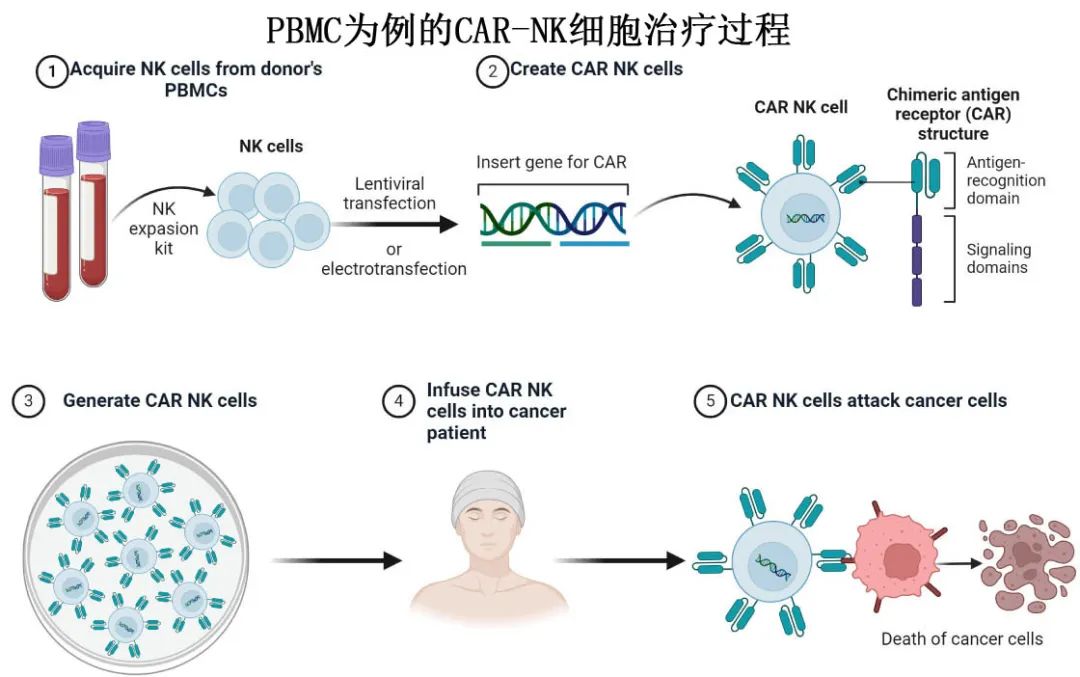
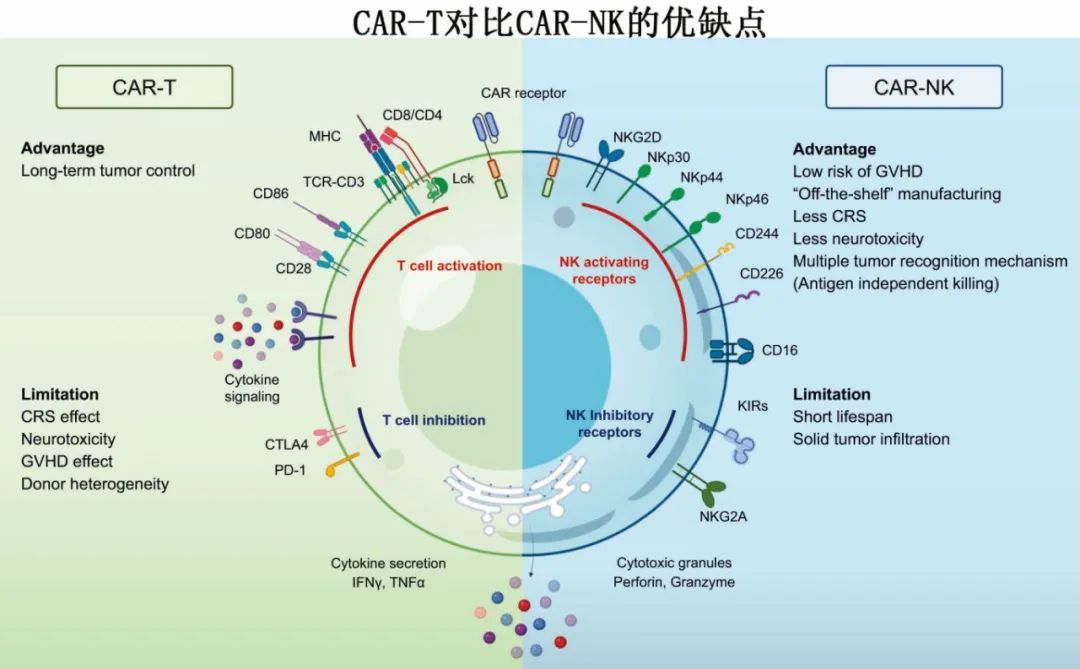
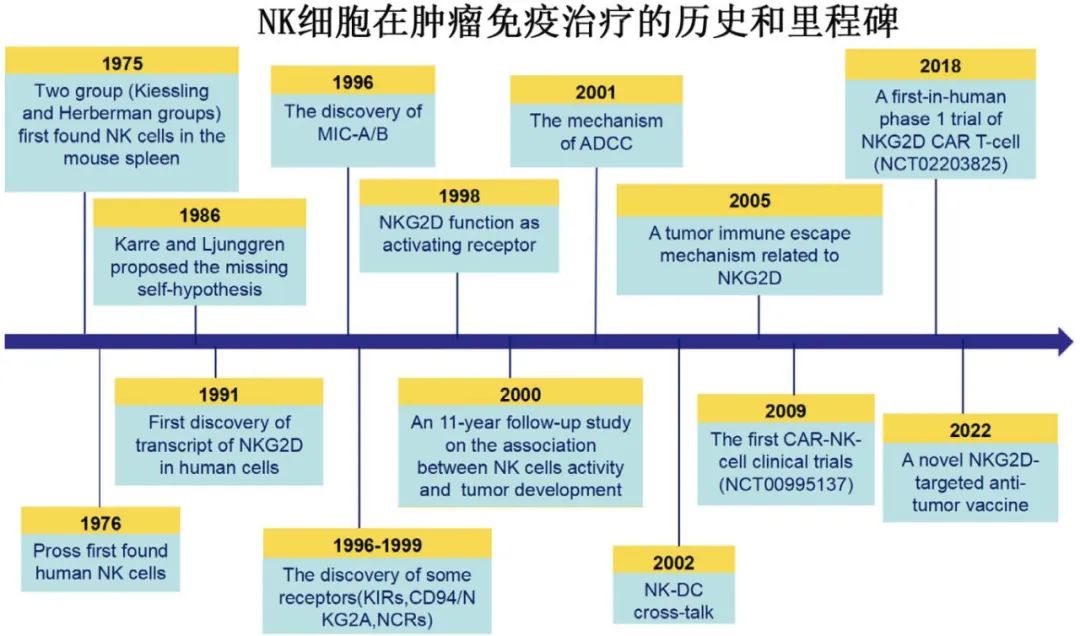
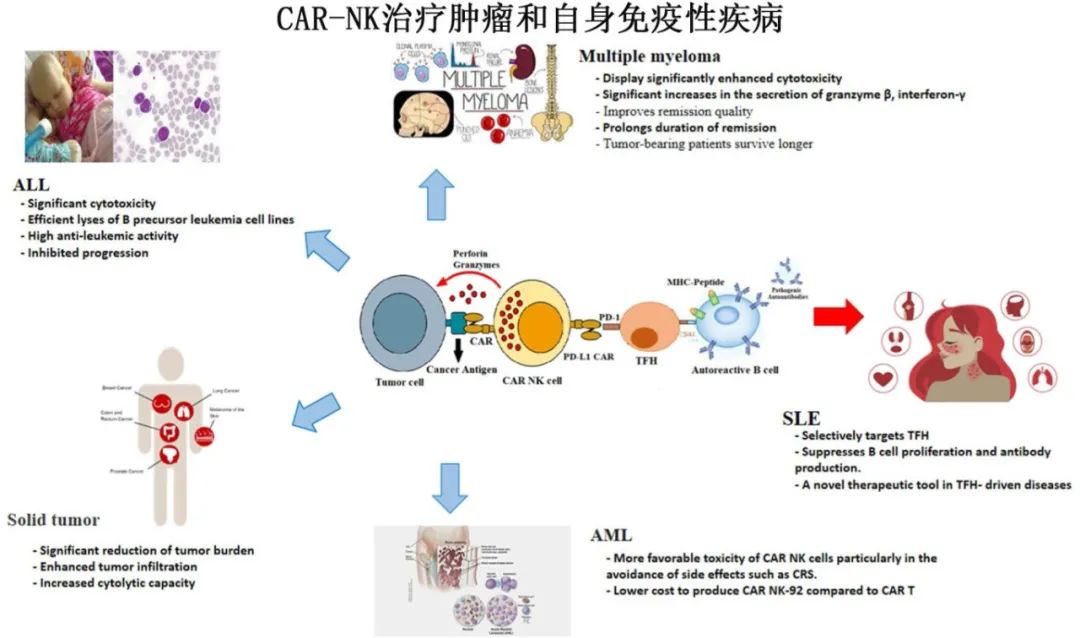
异基因CAR-NK 细胞已在临床试验中显示良好前景,证明其可行性、安全性和疗效,包括急性淋巴细胞白血病、急性髓系白血病、多发性骨髓瘤、实体瘤、自身免疫性疾病等。
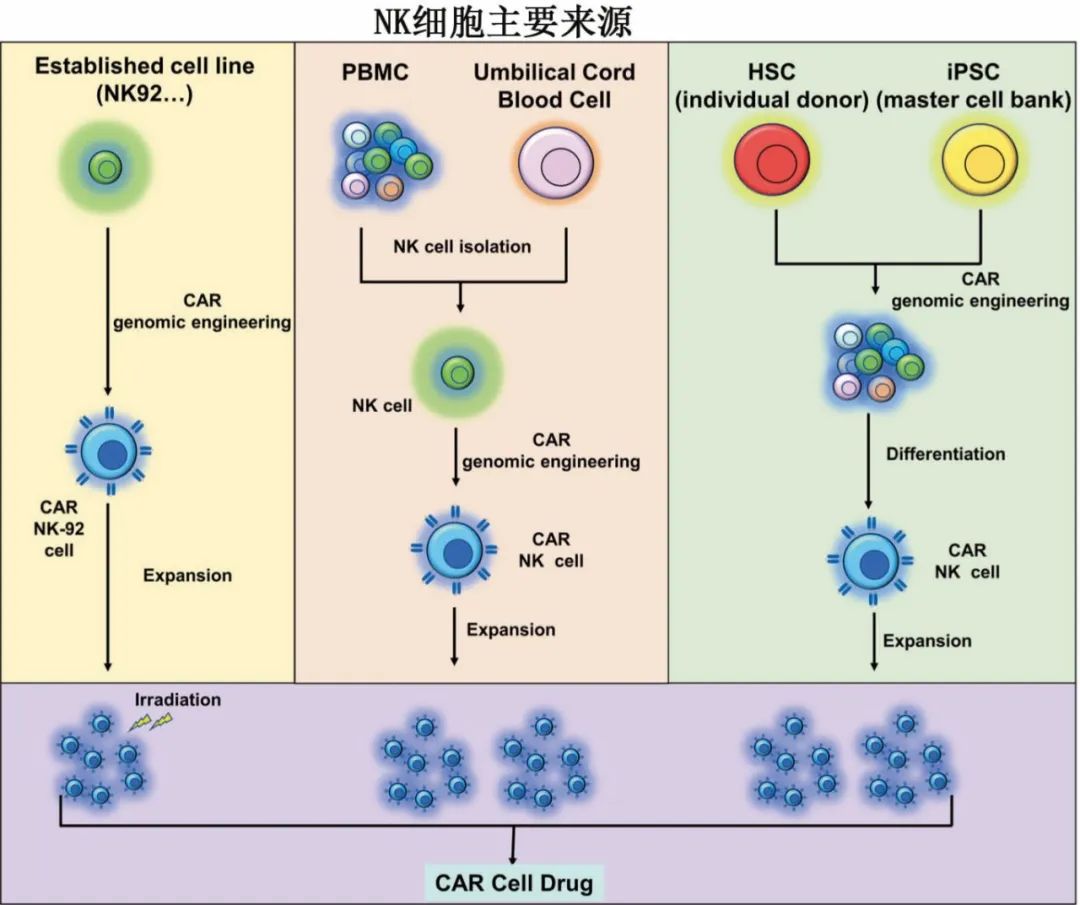
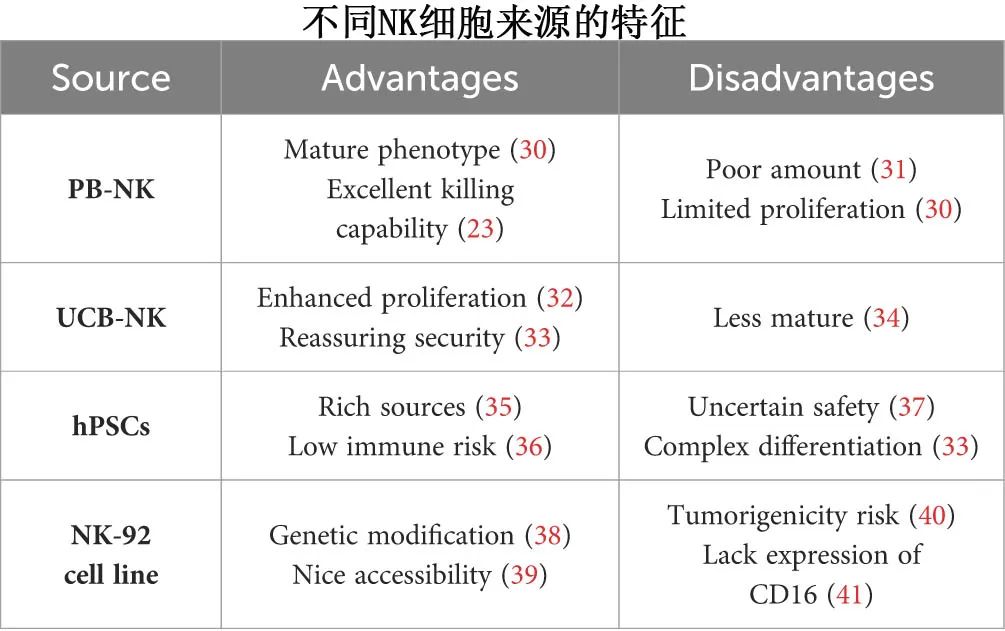
用于 CAR-NK 细胞工程的 NK 细胞来源包括外周血(PB)、脐带血(UCB)、已建立的NK细胞系(特别是NK-92细胞系)和人类多能干细胞(hPSC,包括诱导多能干细胞iPSC)。与T细胞相比,这种更广泛的潜在来源使NK细胞更容易获得,每种来源都具有不同的特征,但关于理想NK细胞来源仍有争议。
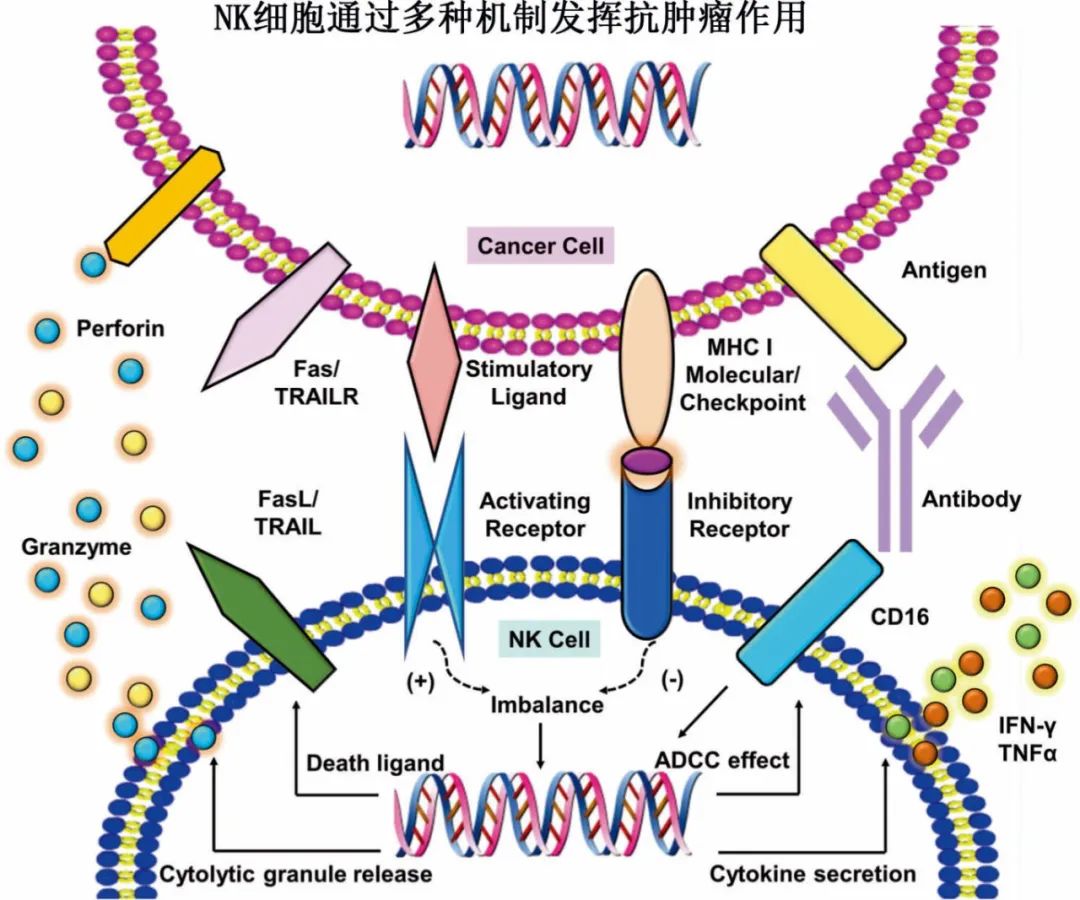
活化的 NK 细胞采用多种机制消除靶细胞:①释放穿孔素和颗粒酶,导致靶细胞溶解或凋亡;促进 FasL 表达,诱导细胞凋亡;释放肿瘤坏死因子 (TNF)-α、干扰素 (IFN)-γ、粒细胞巨噬细胞集落刺激因子 (GM-CSF)、和趋化因子(如CCL1、CCL2、CCL3、CCL4、CCL5、CXCL8)募集并激活其他效应免疫细胞;抗体依赖性细胞介导的细胞毒性 (ADCC)。
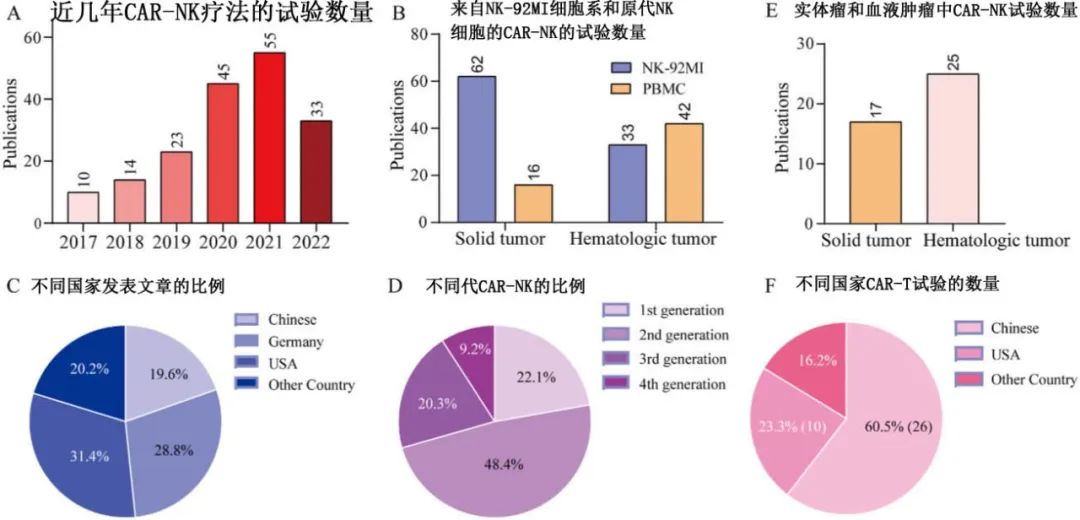
CAR-NK是近年来应用研究和临床医学实践中最先进的研究领域,其在肿瘤免疫治疗中的临床应用越来越显示出巨大的潜力,临床前和临床研究数据也日益增长,尤其是中国声音越来越突出。
CAR-NK细胞疗法也面临许多挑战,包括体内持久性有限和免疫抑制肿瘤微环境(TME)、靶抗原丢失等,特别是在实体瘤和髓系恶性肿瘤中。相关挑战和策略如下:

•NK细胞在缺乏细胞因子支持的情况下寿命短,导致体内持久性有限。克服该挑战的努力包括基因工程,如细胞因子装甲(特别是结合IL-15和IL-21转基因),以提高NK细胞的存活率、持久性和抗肿瘤功效。IL-15细胞因子装甲已经改变了CAR-NK细胞在肿瘤治疗中的临床应用,有效克服非工程NK细胞的短寿命,从而提高持久性和体内增殖。由IL-12/ 15/18激活的细胞因子诱导的记忆样NK细胞是增强NK细胞效应功能和持久性的一种有希望的策略,导致NK细胞命运的多样化,包括具有独特的记忆样NK细胞群。
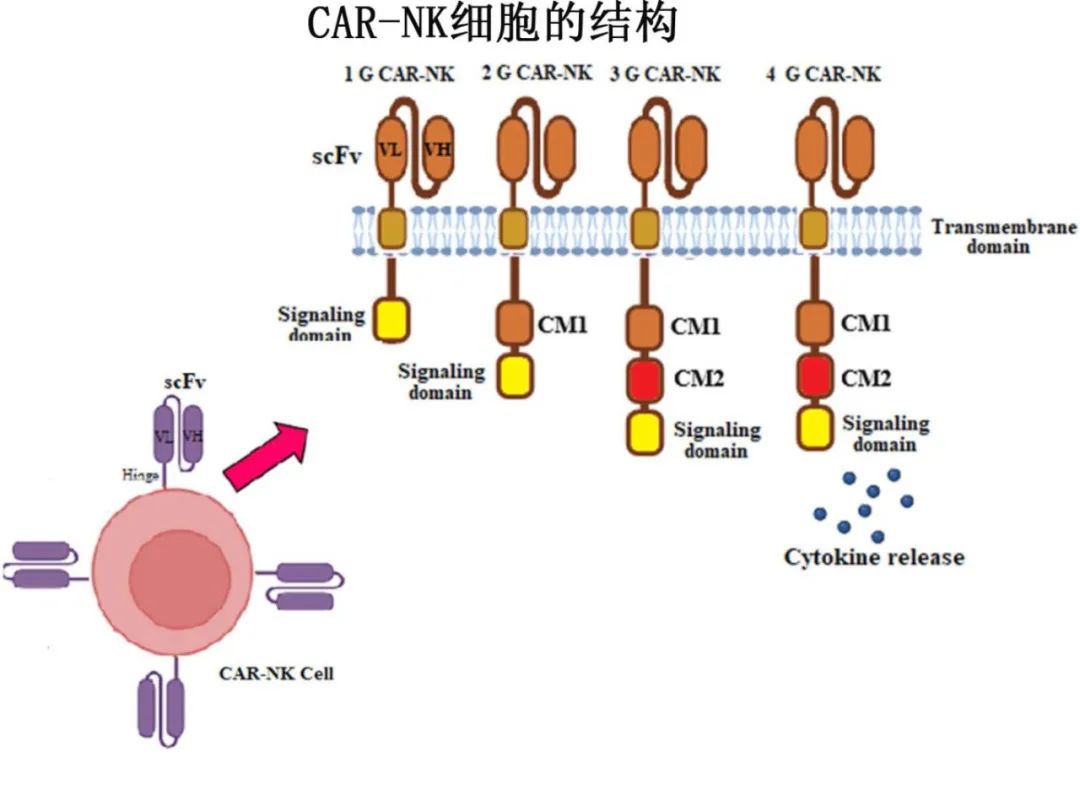
•CAR设计。CAR的结构优化对于增强其治疗潜力和反应的持久性至关重要。为了利用NK细胞靶向多种肿瘤抗原的能力,新的设计将NK细胞受体(如NKG2D)整合到CAR结构中。其他增强功能包括识别最佳跨膜结构域和包含NK细胞特异性适配器分子,如DNAM-1和2B4,以提高疗效。将T细胞中心的CD28共刺激结构域整合到cd70导向的CAR-NK细胞中会产生优越的细胞毒性。还开发了包含PDZ结合基元的15种CAR设计,以增强NK细胞和T细胞中的突触形成,从而改善各种肿瘤模型中的效应功能并延长生存期。
•免疫抑制性肿瘤微环境对T细胞和NK细胞过继疗法的有效性提出重大挑战,导致免疫检查点上调和细胞衰竭。缺氧、营养剥夺、乳酸酸中毒等因素和转化生长因子(TGF)-β等免疫抑制细胞因子,以及髓源性抑制细胞和调节性T细胞等抑制性细胞类型,都导致严重的免疫抑制TME。为了抵消这些不良影响,正在探索创新策略来破坏免疫抑制性通路,包括基因编辑。例如使用CRISPR基因编辑敲除CISH基因可抑制细胞内细胞因子检查点CIS,从而增强CAR-NK细胞的持久性和抗肿瘤活性。其他有希望的方法包括TGFBR2敲除和检查点抑制,例如用阻断单抗系monalizumab靶向NKG2A或通过基因敲除。基于 CRISPR 的功能筛选的早期报告已经确定CAR-NK细胞功能的关键抑制因子,如钙通道CALHM2。
•on-target off-tumour效应对许多靶点来说都是重要挑战,特别是在实体肿瘤中。为了优化CAR-NK细胞功能和提高安全性,开发了逻辑门控策略。CAR-NK细胞可以通过胞浆作用获得靶抗原表达,从而导致自相残杀。正如B细胞淋巴瘤和实体瘤模型所显示,该问题可以通过用抑制性基于KIR的CAR来改造CAR-NK细胞来解决。其他增强CAR-NK细胞安全性的努力包括整合安全开关,如诱导型caspase 9系统,该系统可以通过药物激活来触发转导细胞的凋亡,以应对潜在的不良反应。
•确定最佳的肿瘤抗原靶向仍是推进细胞治疗的重大挑战。人们正在探索CAR-NK细胞的创新多靶向方法,以提高抗原识别并克服肿瘤进展过程中抗原丢失等挑战。包括双靶向方法、基于天然受体和配体的CAR以及可切换CAR设计在内的策略旨在增强肿瘤特异性。此外,正在探索NK细胞的T细胞受体工程,使NK细胞能够识别和靶向表达特定肽-主要组织相容性复合体(MHC)复合物的肿瘤,从而扩大其靶向能力,包括细胞内抗原。
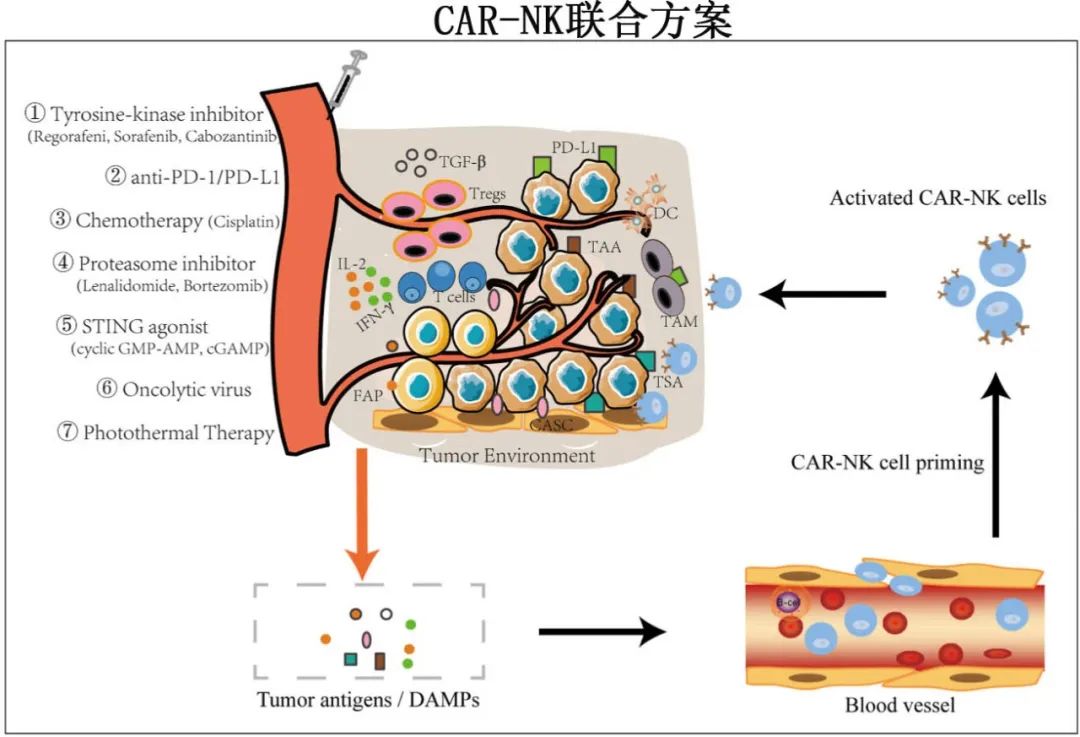
•此外,肿瘤免疫抑制性微环境和NK细胞受体/配体基团谱的改变可严重抑制CAR-NK细胞的功能。因此,根据不同的肿瘤类型和不同患者的个体特点,合理有效地将CAR-NK细胞治疗与其他免疫治疗方法、放疗、化疗相结合,重塑肿瘤微环境或纠正NK细胞受体/配体基团谱的偏差,不仅可以提高CAR-NK细胞的抗肿瘤活性,还可以增强肿瘤细胞的敏感性,从而达到更好的治疗效果。
参考文献
1.Rafei H, Rezvani K.Advances and challenges in chimeric antigen receptor-natural killer cell immunotherapy for cancer. Br J Haematol. 2024;00:1–4. https://doi.org/10.1111/bjh.19939
2.Zhang, B., Yang, M., Zhang, W. et al. Chimeric antigen receptor-based natural killer cell immunotherapy in cancer: from bench to bedside. Cell Death Dis 15, 50 (2024). https://doi.org/10.1038/s41419-024-06438-7
3.Li J,Hu H,Lian K,et al. CAR-NK cells in combination therapy against cancer: A potential paradigm. Heliyon. 2024 Feb 29;10(5):e27196. doi: 10.1016/j.heliyon.2024.e27196.
4.Yang R, Yang Y, Liu R, Wang Y, Yang R and He A (2024) Advances in CAR-NK cell therapy for hematological malignancies.Front. Immunol. 15:1414264.doi: 10.3389/fimmu.2024.1414264
5. Hassan, S.H., Alshahrani, M.Y., Saleh, R.O. et al. A new vision of the efficacy of both CAR-NK and CAR-T cells in treating cancers and autoimmune diseases. Med Oncol 41, 127 (2024). https://doi.org/10.1007/s12032-024-02362-0
6. Romero, D. Promising early results with CAR NK cells. Nat Rev Clin Oncol 21, 168 (2024). https://doi.org/10.1038/s41571-024-00866-2
7.Peng, L., Sferruzza, G., Yang, L. et al. CAR-T and CAR-NK as cellular cancer immunotherapy for solid tumors. Cell Mol Immunol 21, 1089–1108 (2024). https://doi.org/10.1038/s41423-024-01207-0
8. Wang DR, Dou LY, Sui LH, Xue Y, Xu S. Natural killer cells in cancer immunotherapy. MedComm. 2024; 5:e626. https://doi.org/10.1002/mco2.626
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#肿瘤免疫治疗# #CAR-NK#
12