三阴性乳腺癌患者新辅助治疗后7个月内,结合病理评估和ctDNA检测可识别更高危亚组
2024-04-09 苏州绘真医学 苏州绘真医学 发表于上海
研究者提出,通过结合组织反应和敏感的ctDNA检测,可以识别接受新辅助治疗方案的高危早期TNBC患者亚组。
通过液体活检进行循环肿瘤DNA(ctDNA)检测是组织活检的一种新兴替代方法,但其在三阴性乳腺癌(TNBC)治疗反应监测和预后方面的潜力尚未完全了解。在本研究中,研究者在TNBC患者中使用癌症基因panel确定了ctDNA中可检出的可干预突变的发生率,这些患者在纳入研究时未复发。对主要治疗完成后7个月内收集的130例TNBC患者的血浆DNA进行测序并对变异进行验证,结果显示7.7%的患者使用热点panel有可检测到的残留病变。在接受新辅助治疗的患者中,研究者观察到一种趋势,即在治疗完成后7个月内病理缓解不完全且ctDNA阳性的患者无进展生存期缩短的风险要高得多。研究者提出,通过结合组织反应和敏感的ctDNA检测,可以识别接受新辅助治疗方案的高危早期TNBC患者亚组。
研究背景
乳腺癌是全球最常诊断的癌症,占女性新诊断癌症的近25%,占女性癌症死亡的15.5%。三阴性乳腺癌(TNBC)约占新诊断乳腺癌的15-20%,与其他癌症类型相比,TNBC的预后较差,疾病进展较早。监测TNBC患者疾病进展和对治疗反应的能力将为医师提供一个宝贵的工具,帮助个体化治疗和改善患者结局。循环肿瘤DNA(ctDNA)检测是替代组织活检方法的一种新兴无创方法,因为它只需要血液样本,因此可以在不同的时间点采集,而对患者的不适最小。ctDNA可在所有阶段疾病患者的血液中发现,并携带实体瘤的许多特征。因此,ctDNA可用于筛查和早期检测、疾病监测、复发预测和肿瘤特征分析,从而指导实体癌的治疗顺序。目前,对于治疗完成后无症状的患者,不常规使用影像学技术评估远处复发。此外,肺癌和结直肠癌的ctDNA监测已被证明可在影像学表现出现前数月提示疾病复发。因此,常规ctDNA监测可能是一种有用的方法,可以通过早期治疗的微小残留疾病检测来可靠地识别有侵袭性疾病进展风险的患者。不同研究的ctDNA检测方法各不相同,通常依赖于个性化的突变谱,这对检测方法的可扩展性和普遍适用性提出了挑战。早期研究已提示TNBC患者的ctDNA预后信号,但检出率和结局关联因具体研究级别或临床试验的实施情况以及患者的临床分期而异。研究者将靶向突变热点ctDNA测序panel(专为可行的治疗指导而设计)应用于早期TNBC(包括临床无疾病患者),显示在完成初始治疗后7个月进行的ctDNA评估,可能识别出复发风险高的TNBC患者亚组。
研究结果
队列描述:
研究者在130例非转移性TNBC参与者组成的队列中收集了在完成主要治疗后7个月内的血浆,利用临床上可操作的ctDNA panel检测了ctDNA突变,在样本采集时无临床进展。该队列包括64名接受NAT(新辅助治疗)后手术的参与者和66名接受手术后ADJ(辅助治疗)的参与者(图1b,c)。参与者诊断时的中位年龄为54岁,并且在NAT和ADJ参与者之间相似(图1)。同样,在接受NAT和ADJ治疗的参与者中,肿瘤分级和临床基因变异检出率相似。在8例ADJ和13例NAT参与者中,检测到的变异包括BRCA突变。从最后一次治疗(化疗或手术)日期到治疗后测序样本的中位随访时间间隔为1.8个月,NAT和ADJ参与者之间无显著差异。治疗完成后,中位临床随访时间为25个月,范围为1-53个月。同样,在NAT和ADJ治疗的参与者之间,疾病进展或死亡率、治疗完成与复发之间的时间间隔、以及治疗完成与疾病进展或死亡之间的时间没有统计学差异,尽管接受NAT的参与者总体上进展较快。在ADJ参与者中,淋巴血管侵犯的比例(21%)高于NAT(9%)。NAT和ADJ参与者的淋巴结状态差异有统计学意义,55%的NAT参与者有阳性的节点状态,相比之下,27%的ADJ参与者有阳性的节点状态(图1)。虽然所有NAT和ADJ参与者中有一半在就诊时患T2期肿瘤,但NAT参与者的肿瘤分期(34%的NAT参与者为T3或T4期)往往高于ADJ参与者(42%的参与者为T1期)。同样,ADJ参与者的肿瘤往往比接受NAT的参与者小(图1)。NAT和ADJ参与者的化疗方案有差异,9例(14%)NAT参与者接受了含铂化疗,而仅1例ADJ参与者接受了含铂治疗。此外,与NAT相比,ADJ参与者接受双联治疗的人数较多。队列中大多数(87%)参与者接受了局部区域放疗。然而,与ADJ组相比,NAT组未接受上述治疗的参与者较少(分别为4例和12例)。24名(38%)NAT参与者在新辅助治疗后达到病理完全缓解(pCR)。在40例未获得pCR的NAT参与者中,13例在术后接受了额外的卡培他滨辅助治疗(图1b)。除化疗、手术和放疗外,5例参与者接受了唑来膦酸治疗,4例ADJ参与者和7例NAT参与者接受了激素治疗:早期乳腺癌诊断为ER+疾病、多灶性ER+ /ER-疾病、边缘性ER+或表型转换的疾病。
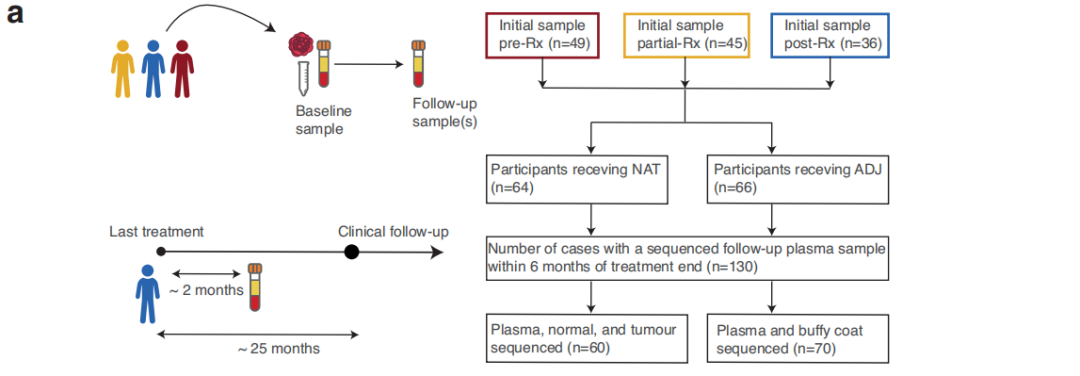
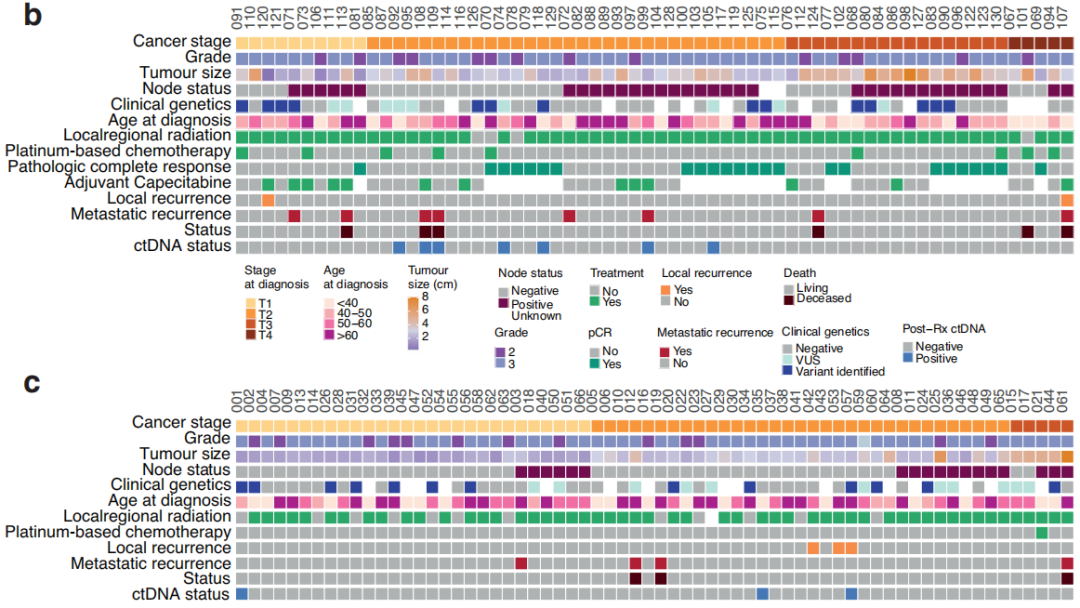
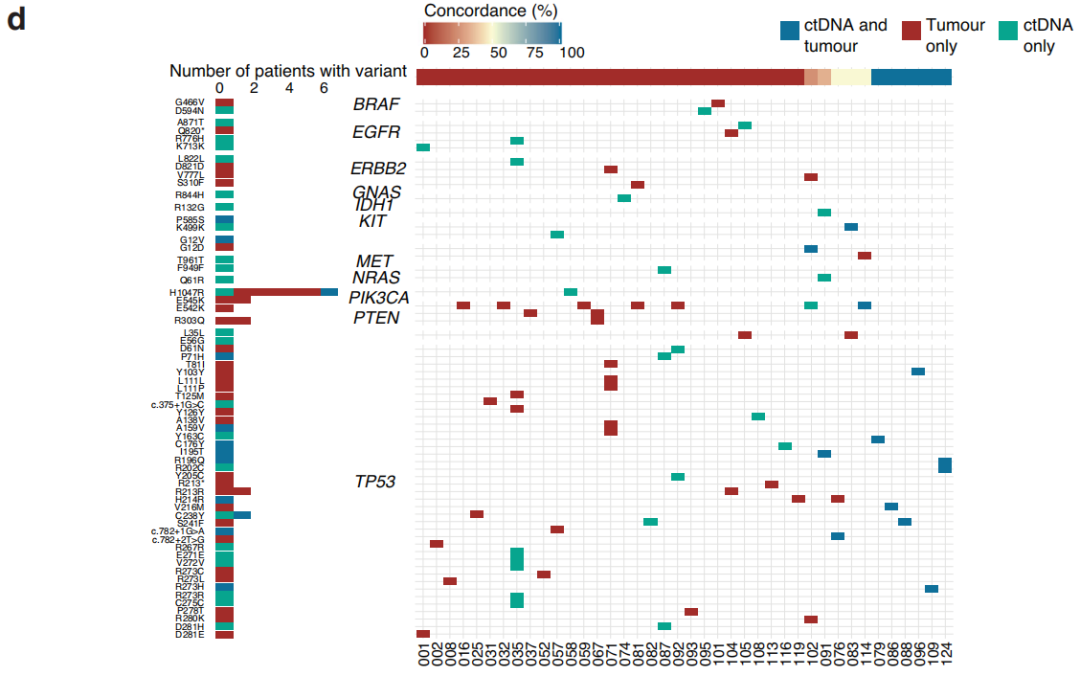

图1
检测可干预的ctDNA变异:
首先,研究者通过概率评分>0.7(随机森林确定的检测概率)确定了48个可检测到的ctDNA变异,建立了用于特定突变检测的变异丰度(VAF)范围,这些变异经ddPCR检测进行验证。这48个变异的VAF范围为0.1%-78.4%,分布在8个基因中,包含24种不同的突变。共有14个变异被证实,而另外34个变异未被ddPCR检测到。确认的变异(真阳性)存在于3个基因中,即PIK3CA、TP53和KRAS,panel评估的中位VAF为1.1%(VAF范围:0.5-78.4%)。假阳性的中位VAF为0.7%(VAF范围:0.1-19.4%)。研究者利用这些结果建立了VAF≥1%的变异筛选标准,用于后续分析。所有真阳性均被纳入下游分析,所有假阳性均被排除。
符合筛选标准的变异分布在14个基因中,仅在正常样本中检出POLE和MAP2K2变异,代表可能的胚系变异。研究者在全部130例参与者中比较了血沉棕黄层(buffy coat)和ctDNA变异,以识别和排除胚系变异。在血沉棕黄层中仅检出5个变异,其中只有1个(TP53 R248G,VAF ~1%)与参与者特异性血浆样本一致。克隆性造血(CH)可导致ctDNA基因分型的假阳性。因此,研究者比较了来自60例参与者的唾液、淋巴细胞、血浆和FFPE肿瘤DNA的变异,以识别潜在CH。研究者将CH突变定义为在血浆中检出的与血沉棕黄层一致但与唾液不一致的任何变异。在这60例患者组成的这一亚组中检测到的93个变异中,没有一个是上述定义的CH突变。事实上,在这一队列中,在血沉棕黄层样本中只检测到1个变异,即可能的同义良性胚系突变EGFR R836R(rs2229066)。
排除可能的胚系变异后,研究者在60例参与者的匹配FFPE肿瘤和血浆样本中分析了检出的变异的一致性。在肿瘤和血浆中共检测到72个变异:36个仅在肿瘤样本中检测到,24个仅在血浆中检测到,12个变异同时存在于两者中。在具有匹配的肿瘤和血浆样本的60例参与者中,41例在至少一个样本中可检出变异,其中11例在两个样本中均可检出变异体(图1d)。其中,6例参与者有100%肿瘤-血浆一致性,检测到的所有变异在TP53热点(图1d)。在有血浆和/或肿瘤变异的参与者中,24例有TP53突变,包括12个一致变异中的9个、71%的仅血浆变异和51%的仅肿瘤变异(图1d)。其次最常见的肿瘤变异基因是PIK3CA。在12个一致变异中,肿瘤样本中的VAF高于ctDNA,肿瘤和血浆变异的中位VAF分别为32.9%和1.6%。最常见的实体瘤突变是PIK3CA H1047R,该突变在6例参与者的肿瘤样本中检出,并且是在超过 1 名参与者中发现的仅2种血浆变异中的一种(每种变异均在2名参与者中检测到)(图1d)。之前有报道称,在接受NAT治疗的TNBC参与者中,这种致病错义突变与较低的病理学完全缓解相关。在本队列中,血浆和肿瘤变异的分布反映了先前报道的TNBC中体细胞 SNVs(单核苷酸变异)的人群频率。
治疗后的ctDNA变异:
在130例参与者中,有10例(7.7%)在治疗后7个月随访时的血浆中检出了可干预热点突变,其中包括7例NAT和3例ADJ患者(图1b,c)。有治疗后ctDNA的4例参与者随后被诊断为复发。在治疗后样本中检测到的突变分布为6个基因的13个变异:4例参与者的6个TP53变异,3例参与者的3个EGFR变异,以及ERB2、GNAS、KIT和PIK3CA各1个变异(图2a)。在治疗后参与者ctDNA中检出的6个TP53变异中,有2个是预计具有高度功能影响的内含子变异,另外3个是预计具有中度功能影响的错义变异体(图2a)。TP53变异的中位VAF(2.76%)高于GNAS(2.1% VAF)、EGFR(中位1.4% VAF)、ERB2(1.0% VAF)、KIT(1.3% VAF)和PIK3CA(0.6% VAF)变异。此外,在预计具有高功能影响的TP53内含子变异中,VAFs超过10%(图2a)。在出现复发和治疗后ctDNA的4例参与者中,3例有TP53变异。
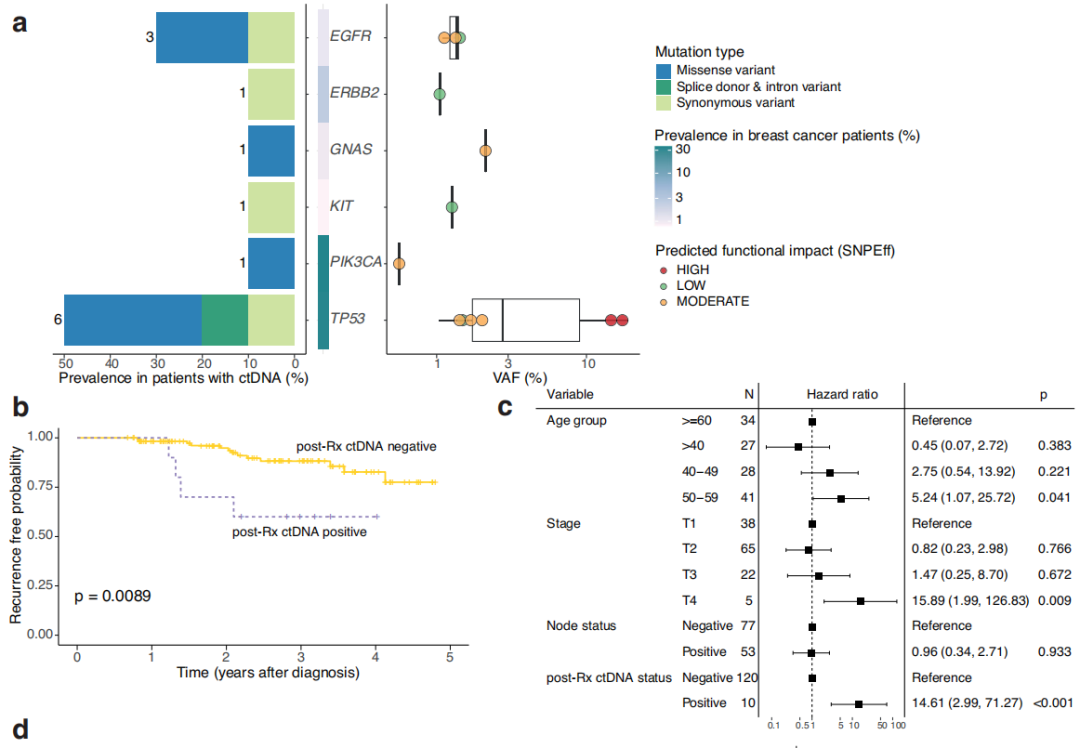
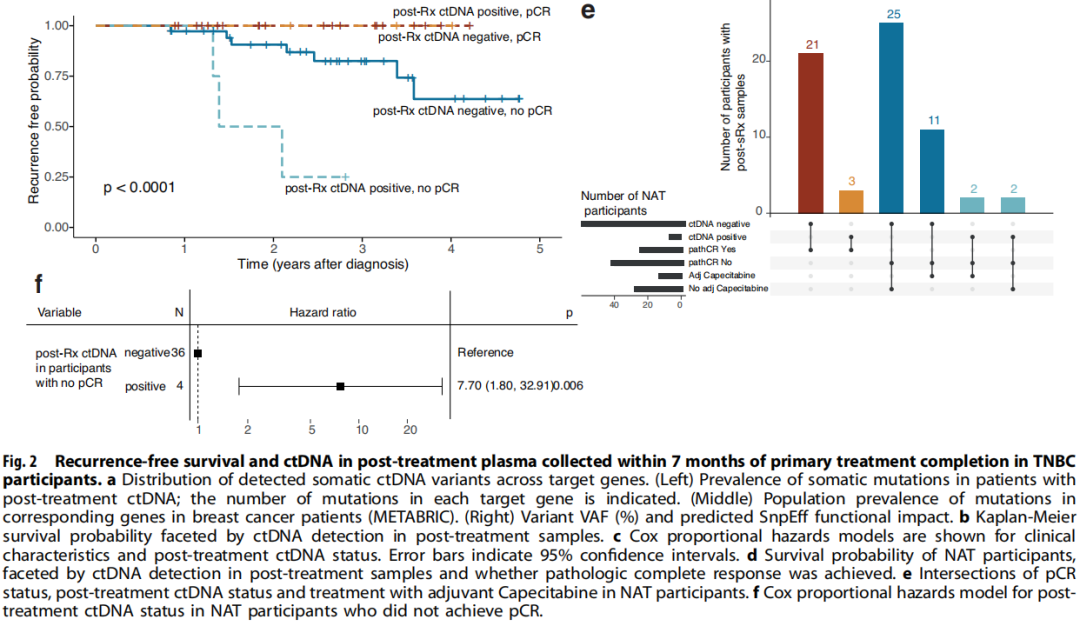
图2
复发和生存率与早期治疗后ctDNA相关:
然后,研究者研究了能否通过治疗完成后7个月内存在ctDNA突变来识别治疗完成后发生临床进展的患者。以临床进展为终点的Cox比例风险分析表明,在TNBC参与者中,治疗后即刻的ctDNA阳性状态与较短的无复发生存期相关(图2b)。多变量分析显示,诊断时的年龄、肿瘤分期、淋巴结状态和治疗后ctDNA的存在与参与者的生存和/或复发结局相关(治疗后ctDNA风险比(HR):14.61,CI 2.99-71.27,p<0.001,图2c)。此外,两个协变量,特别是T4期肿瘤(HR:15.89,CI 1.99-126.83,p=0.009)和50-59岁的诊断年龄(HR:5.243,CI 1.07-25.72,p=0.041)与参与者的结局相关(图2c)。由于NAT后达到pCR已被证明是总生存期和无事件生存期改善的指标,并且在本研究中,有治疗后ctDNA的10例参与者中有7例接受了NAT,因此研究者研究了ctDNA状态可否作为参与者结局的另一个预后指标。达到pCR的参与者的无进展生存期(PFS)不受ctDNA状态的影响(图2d)。对于NAT后未达到pCR的参与者,当治疗后检测到ctDNA时,PFS较差(HR:7.70,CI 1.80-32.91,p=0.006),40例未达到pCR的参与者中有4例在治疗后检测到ctDNA(图2d-f)。此外,13例参与者在对NAT不完全应答后接受了另外的卡培他滨治疗,其中2例的治疗后ctDNA为阳性(图1b和2e)。不完全缓解后的卡培他滨治疗与PFS增加不相关,但这些数字非常小。对一名未达到pCR但可检出ctDNA的参与者(108)的连续血浆样本进行的ctDNA监测表明,尽管在诊断时未检出ctDNA,但在NAT和手术后可检出可能具有致病性的TP53变异,并且在转移性复发诊断之前的后续时间点观察到较高的VAF。另一名未达到pCR的NAT参与者(109)也观察到类似的模式,该参与者在本研究中被确定为治疗后ctDNA阳性(图1b)。虽然在参与者109的第一个治疗后样本中未检出ctDNA,但在治疗完成后7个月,即转移性复发诊断前几个月,检测到致病性TP53变异R273H,并且在转移性复发诊断后不久收集的血浆中再次检测到VAF较高。这些观察结果突出表明,监测ctDNA不仅可以应用于治疗的不同阶段,而且可以应用于随访期间,以评估残留疾病负荷并识别复发风险较高的患者。
尽管治疗后样本的ctDNA检出率不同,但NAT和ADJ参与者的无复发生存期无差异。ctDNA检测结果的差异不是疗效的标志物,因为NAT和ADJ参与者的总生存期相似。在ADJ组中,治疗后ctDNA检测结果与PFS降低不相关。然而,鉴于ctDNA的检出率低,因此任何关联的显著性均提示存在相关性,不应用于推断患者预后。在本队列中,4例参与者(3例NAT和1例ADJ)在治疗后6个月内(63-134天,治疗后中位102天)出现疾病进展。研究者在1例癌症快速复发的NAT参与者和另外9例参与者中检测到了治疗后的ctDNA,其中3例随后发生了疾病进展。这一观察结果提示,主要治疗完成后的ctDNA检测可能对快速复发癌症以及治疗完成后超过6个月发生临床进展的TNBC疾病提供信息,需要进一步研究。
讨 论
病理完全缓解和ctDNA状态均已被证明可预测治疗后的生存率。虽然达到pCR仍然是告知疾病根除情况和预测NAT后长期生存的金标准,但在持续治疗期间ctDNA检测也已被证明比单独检测pCR状态更能预测生存。在NAT的不同时间点和术前从高危早期乳腺癌患者采集的血浆样本中,使用患者特异性检测试剂盒检测ctDNA,结果表明NAT后检测到ctDNA与较差的结局相关。同样,TNBC患者在NAT后采用靶向基因测序和患者特异性ddPCR检测相结合的ctDNA检测与较高的复发风险相关,并可预测转移性复发。相反,在NAT的不同阶段,ctDNA清除与无复发生存期相关,即使患者未达到pCR。值得注意的是,研究者观察到,在NAT参与者中,在治疗完成后7个月内和复发前,如果同时未达到pCR和治疗后ctDNA状态阳性可能表明TNBC疾病进展比仅未达到pCR的更早,原因是残留疾病负荷较高和/或本质上更具侵袭性的生物学状态。检测治疗后ctDNA的能力取决于几个因素,包括肿瘤比例低、治疗期间的ctDNA动态变化,以及关键的是使用的ctDNA检测。本文使用的检测是经过临床验证的“现成”靶向panel检测,设计用于特定的疾病管理目的,即检测血浆和组织中可干预的突变。作为一种靶向晚期疾病的泛癌症检测方法,该方法可能遗漏了大量对TNBC监测具有重要意义的突变,以及任何患者的特异性变异。最近一项专门纳入残留病变负荷阳性患者(本研究包括无病和残留病变阳性参与者)的研究报告,在治疗6个月内,总体ctDNA检出率较高(33%的患者),但强调了治疗后ctDNA与RCB评分为>0且pCR不完全的独立预后价值。除了总体研究人群疾病负荷的差异外,较高的检出率可能反映了panel的大小和阈值(3-40%或>60% VAF,相比于当前研究中的1-40% VAF),以及大多数样本未进行胚系测序。在当前研究中,治疗结束时复发或有临床明显疾病的患者被排除。此外,研究者对匹配的血沉棕黄层样本进行了广泛的ddPCR和平行测序的正交验证。最近利用帕博利珠单抗干预组的中高危TNBC进行了基于ddPCR的监测,这些工作强调了早期入组和敏感检测的必要性,从而指导早期干预。仅包括血沉棕黄层阴性和肿瘤样本阳性的检测,ctDNA在27%的患者中检出。然而,绝大多数(>70%)在ctDNA检测阳性时发生了转移,这使得检测率更符合研究者在治疗后、进展前血浆样本分析中观察到的结果,并表明需要对更早期的时间点进行更频繁的监测。这些研究凸显了ctDNA作为生物标志物的动态特性,可以更好地预测预后。与此一致,最近出现的一套将ctDNA用于不同癌症的指南建议对乳腺癌患者进行纵向ctDNA监测,以帮助识别复发风险高的患者。然而,在接受NAT治疗的TNBC患者中,采用大规模平行突变富集结合双链测序的方法检测出的低频突变和肿瘤分数估算表明,ctDNA信号低于现有检测的检测限,这表明需要具有高灵敏度和特异性的检测方法。在未来的研究中,更敏感的方法(包括从血浆全基因组测序中分析大量突变)结合使用更大的血浆量,甚至多参数检测可能具有更大的实施潜力。
ctDNA测序方法是一个正在进行的研究领域,ctDNA检测法的潜在临床适用性必须平衡基因组覆盖率、成本、可扩展性、检测法的灵敏度和特异性以及检测法所处的临床阶段。出于本研究的目的,研究者使用了一种UID标记的靶向扩增子测序方法来检测癌症中一系列可干预的SNVs。对于TNBC等癌症,除了非特异性TP53突变之外,不存在特定“定义疾病”的SNVs,基于捕获或低通量全基因组测序方法可能是ctDNA检测的更好方法,因为它们提供了关于拷贝数变化和大结构重排的数据。
ctDNA正在许多类型的肿瘤中成功用于评估复发,并试图确定可能从新型靶向药物或其他干预措施中获益的人群。本研究表明,新辅助治疗后未达到pCR且可检测到ctDNA的参与者发生了快速复发和非常差的结局。在主要治疗完成后的多个时间点,未来使用全基因组分析方法的工作将用于识别复发风险高的患者,以及哪些患者应被纳入个体化治疗早期干预试验。此外,有必要对治疗后ctDNA检测与复发诊断之间的前置时间进行系统分析。综上所述,这些观察结果提示,在不完全pCR的TNBC患者中,血浆残留病变检测方法结合pCR有可能识别出进展风险较高的患者,这些患者应接受晚期二线治疗的评估。
参考文献:
Zaikova, Elena et al. “Circulating tumour mutation detection in triple-negative breast cancer as an adjunct to tissue response assessment.” NPJ breast cancer vol. 10,1 3. 5 Jan. 2024, doi:10.1038/s41523-023-00607-1

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#乳腺癌# #ctDNA检测#
79