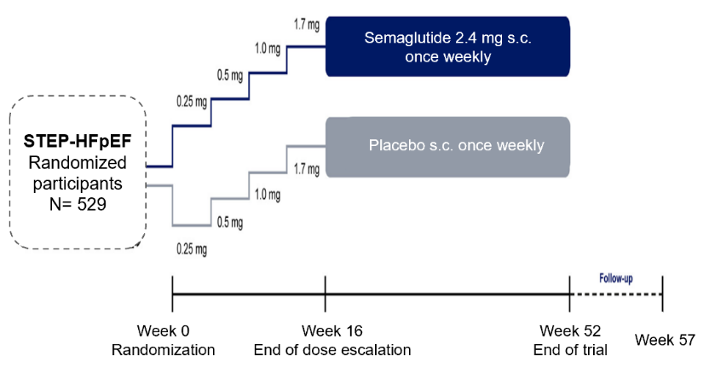
STEP HFpEF研究 ESC 2023丨HOT LINE 1 STEP-HFpEF是一项国际多中心、双盲、随机对照的3期临床试验(NCT04788511),旨在评估一周一次司美格鲁肽(2.4 mg)或安慰剂对射血分数保留型心力衰竭(HFpEF)伴体重指数(BMI)≥30 kg/m²成年患者在标准护理下的疗效和安全性。试验开始于2021年03月16日,完成于2023年04月18日,13个国家83家医学中心529例患者参与,治疗时长52周,随后再进行5周随访(图1)。 入组患者同时要求纽约心脏病学会(NYHA)分级为Ⅱ-Ⅳ级,LVEF≥45%;排除初筛前90天自主报告体重变化偏高(≥5 kg)及入组前3个月记录或所检测糖化血红蛋白(HbA1c)≥48 mmol/mol(6.5%)的患者。主要研究终点为自基线至治疗52周时堪萨斯城心肌病问卷临床总评分(KCCQ-CSS)变化和体重变化;次要终点指标包括患者总体临床获益、6分钟步行距离测试(6MWD)和C反应蛋白水平。入组患者基线特征显示,白种人占95.8%,女性占56.1%;LVEF≥50%的患者占75%,另有25%患者的射血分数轻度降低;平均BMI约为37 kg/m²,大部分患者合并有高血压、冠心病或心房颤动。患者NT-proBNP平均水平偏高为452.4 pg/ml,大部分患者在接受β受体阻滞剂、利尿剂治疗,约1/3的患者在接受盐皮质激素受体拮抗剂治疗。 图1. STEP-HFpEF研究设计[1] NOAH-AFNET 6研究 ESC 2023丨HOT LINE 1 具有心房感知功能的心脏置入式电子装置通过连续监测可检出房性快速性心律失常,也被称为心房高频事件(AHRE),包括房性心动过速、房扑和房颤。由德国房颤联盟(AFNET)和欧洲心脏病学会(ESC)联合发起的NOAH-AFNET 6研究是一项国际多中心、双盲的随机化Ⅲb期临床试验(NCT02618577),开始于2016年2月,完成于2022年12月31日,旨在评价非维生素K拮抗剂口服抗凝药(NOAC)艾多沙班,相比阿司匹林或无抗栓情况下仅予常规护理,在降低AHRE患者卒中、心血管死亡及大出血风险上的优效性。入组AHRE患者并未确诊AF,也无当前指南或共识认为需口服抗凝药的适应症,年龄≥65岁,且至少有1项卒中风险因素。研究设计如图2。 主要研究终点为卒中、体循环栓塞或心血管死亡复合事件的首次发生,所有事件均由独立委员会评估。次要终点除包括主要终点各组分外,还包括全因死亡、国际血栓和止血国际协会(ISTH)定义的大出血,以及相比基线治疗第12和24个月时生活质量量表EQ-5D、Karnofsky功能状态评分、mEHRA症状分级等的变化。研究还评价了艾多沙班抗凝治疗的成本效益。基于AHRE患者不良事件风险比(估计值)0.68,及约需27个月完成患者招募与随访时间≥12个月的条件预设,研究计划纳入3400例患者,实际入组2608例患者。 图2. NOAH-AFNET 6研究设计[2] COP-AF研究 ESC 2023丨HOT LINE 1 围术期房颤(PAF)和术后心肌损伤(MINS)是接受非心脏手术患者的常见并发症,炎症被认为参与其病理机制。秋水仙碱是一种具有强大抗炎作用的经济适用药。国际性、盲法、随机化、安慰剂对照的临床试验COP-AF(NCT03310125)旨在评估术后短期使用秋水仙碱预防PAF的疗效。研究开始于2018年02月14日,完成于2023年07月26日,在11个国家共40家医学中心的参与下,入组3200例患者。受试者按1:1随机分组,接受秋水仙碱或安慰剂治疗(0.5 mg,BID),首次给药限制在术后4小时之内,治疗期10天,随访至第14天(图3)。 主要研究目标为验证秋水仙碱治疗第14天时(相比安慰剂)是否降低患者联合终点事件发生率。其中联合终点事件定义为围术期房颤(包括房扑)的发生,特别是导致心绞痛、心力衰竭或症状性低血压的房颤,及需要使用抗心律失常药物或电复律治疗的房颤。次要联合终点事件为术后至治疗第14天期间,所发生的任何心肌梗死或心肌缺血导致的肌钙蛋白水平升高。患者入组要求年龄≥55岁,确定将接受非心脏胸外科手术的患者,排除了既往AF病史患者及正在使用秋水仙碱药物或存在秋水仙碱禁忌症的患者。 图3. COP-AF研究设计[3] 参考文献:
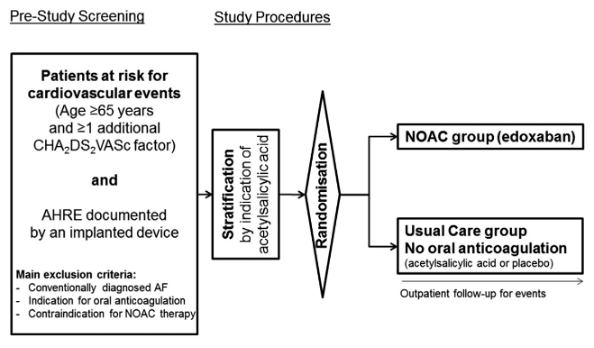
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
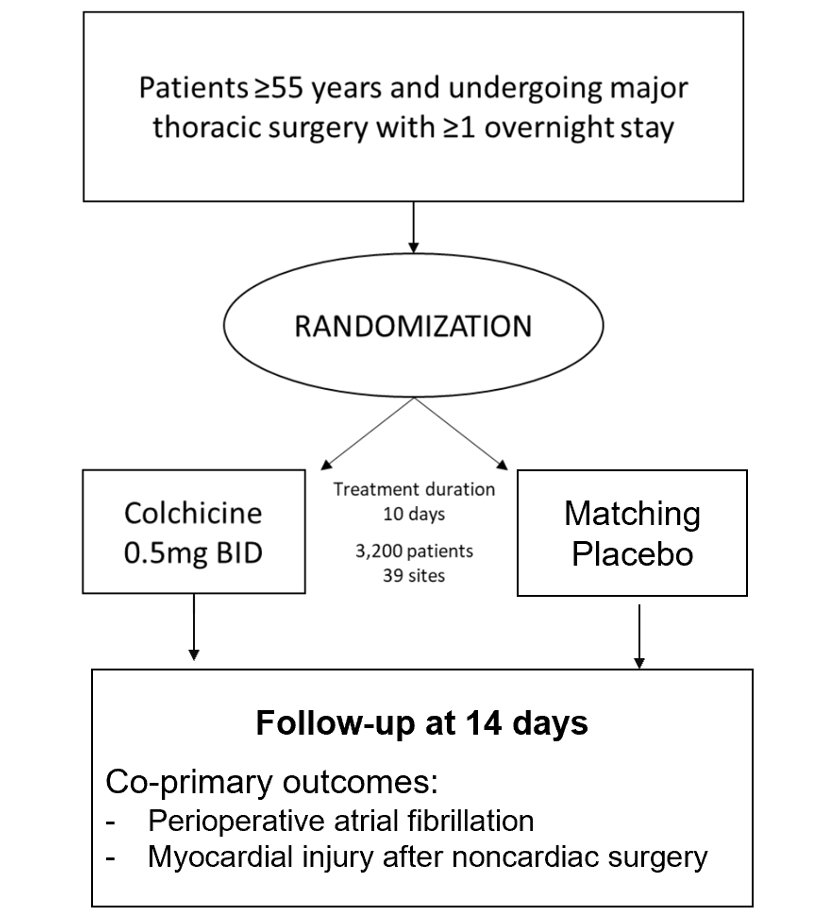
在此留言







