VA-ECMO治疗急性心肌梗死相关心源性休克的新进展
2024-04-26 重症医学 重症医学 发表于上海
心源性休克(Cardiogenic shock,CS)是严重心功能障碍导致组织灌注和氧输送不足从而导致多器官功能衰竭的一种重要临床综合征。
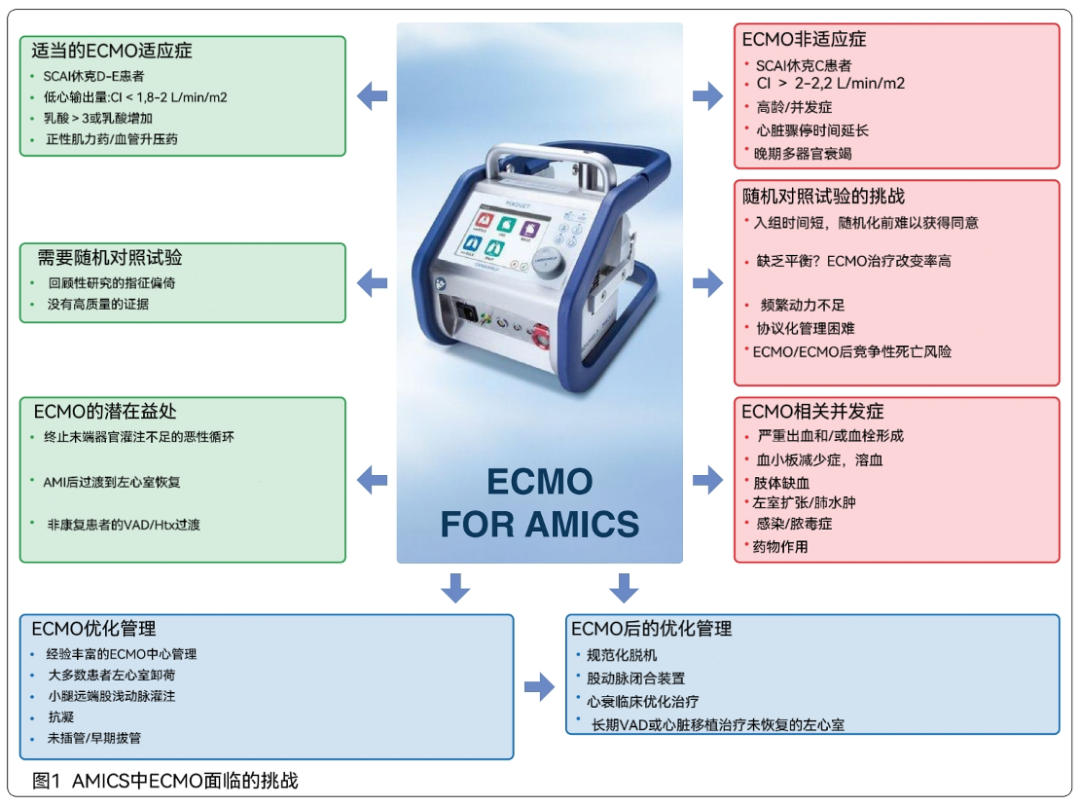
心源性休克(Cardiogenic shock,CS)是严重心功能障碍导致组织灌注和氧输送不足从而导致多器官功能衰竭的一种重要临床综合征。其诊断标准包括低灌注和低血压,较少使用心脏指数降低和/或左心室血流压力升高。CS的主要原因是急性心肌梗死(AMICS),发生在6-10%的AMI病例中,尽管目前治疗方式采用了现代血运重建术,但死亡率仍高达40-50%。且其死亡率随着CS的加重而增加(心血管造影和介入学会(SCAI)D–E期)。传统治疗的有限的成功率导致了临时机械循环支持(tMCS)的使用增加,如静脉-动脉体外膜肺氧合(VA-ECMO)或IMPELLA经瓣膜主动脉微轴泵。尽管目前缺乏高质量的证据,但这种趋势仍在继续。tMCS的使用增加了主动脉的血流量和压力,其目的是逆转动脉内低灌注情况,维持血流动力学稳定,减少对有潜在危害的肌力药物和血管升压药的依赖,并为之后的干预留出时间,以期改善预后。
最近的三项随机试验评估了VA-ECMO在AMICS中的应用。VA-ECMO-CS试验涉及122名患者,并且进行了VA-ECMO治疗与保守治疗策略的比较,综合分析发现主要的结果(30天全因死亡率、复苏的心脏骤停或tMCS应用)没有显著差异。然而,该研究使用了未经验证的CS定义,无法评估死亡率,只有60%的患者患有AMICS,42%随机接受保守治疗策略的患者联合应用tMCS,从而无法与单独的药物治疗进行真正的比较。
EUR-SHOCK试验提前停止,这个试验仅对33名AMICS患者进行随机分组。VA-ECMO和标准治疗组的30天全因死亡率分别为44%和61%(危险比[HR]0.56,p=0.22)。VA-ECMO组1年死亡率为52%,对照组为82%(HR 0.52,p=0.014)。血管和出血并发症在VA-ECMO组更常见(分别为21.4%对0%和35.7%对5.6%)。不幸的是,由于纳入的患者数量有限,该试验无法得出明确的结论。
急性心肌梗死合并CS患者的体外生命支持(ECLS-SHOCK)试验是AMICS中最新的随机试验。该研究包括44个中心的417名AMICS患者(67%ST段抬高)。CS是由持续低血压、乳酸>3mmol/L和器官灌注不足的临床症状来定义。在介入组,早期应用VA-ECMO(22%在血运重建前,26%在血运重建术中, 52%在血运重建术后立即应用)。在出现血液动力学不稳定的医疗组中,可以按照方案进行主动脉内球囊反搏或IMPELLA。介入组的结局(30天死亡率)为48%,药物治疗组为49%(相对危险度0.98;p=0.81)。在VA-ECMO组中,下肢缺血发生率较高(11%对4%,相对危险度[RR]2.86,95%置信区间[CI]1.31–6.25),中重度出血的发生率较高(23%对10%,RR2.44,95%CI 1.5–3.95)。近期对四项随机VA-ECMO/AMICS试验(包括567名患者,其中75%来自ECLS-SHOCK 试验)的个体患者数据进行的荟萃分析结果并没有显示未经选择的早期使用VA-ECMO可以提高生存率,且该技术与较高的大出血和外周缺血率相关。
ECLS-SHOCK研究是由一个在AMICS临床试验中经验丰富的研究小组进行,该研究所使用的方法无可挑剔,并且是此类研究中规模最大的一个,且又足够的证据来评估第30天的死亡率。然而,该研究的一些特殊性可能解释了它的中立性,值得讨论。首先,随机化前的心脏骤停率非常高(78%),明显超过其他AMICS试验(45%IABP-SHOCK-II,53%CULPRIT-SHOCK)和国际注册试验(40-50%)中报告的比率。其次,低流量持续时间明显延长(最长持续复苏期的中位数为20分钟)。第三,由于低血压是唯一监测的血液动力学变量,一些患者可能表现出血管麻痹的表现,心输出量保持不变甚至增加。纳入时接受多巴酚丁胺治疗的患者比例较低(35%)(尽管AMICS中肌力药物的随机试验证据水平仍然较低),事实上只有不到3%的VA-ECMO患者没有动脉波形搏动或主动脉速度时间积分(VTI)<10cm作为左心室(LV)减负荷的原因,这确实表明大多数患者保留了心输出量。值得注意的是,VA-ECMO在这种情况下没有用处。第四,在ECLS-SHOCK中,26名(13%)对照组患者接受了VA-ECMO作为“联合”治疗,28名(13%的)患者接受了其他t-MCS(主要是IMPELLA)治疗,总计占对照组人数的26%。因此,ECLS-SHOCK比较了早期VA-ECMO与tMCS在药物治疗下血流动力学恶化的情况。此外,55%(56/102)的对照组死亡是由难治性CS引起的,这就提出了关于该组难治性CS患者中t-MCS使用不足的问题。最后,介入组的左心室减荷率非常低(5.8%)。这与最近的研究形成了对比,包括回顾性研究的荟萃分析,这些研究表明在这种情况下有实质性的潜在益处(死亡率降低25-50%)。另一种方法是EARLY-UNLOAD随机试验,该试验使用经间隔左心房插管来进行左心室减负荷,结果为阴性。然而,值得注意的是,50%的对照患者迅速转变为左心室减负荷,从而影响了证明死亡率获益的机会。其他考虑因素包括,尽管进行了VA-ECMO,但仍有高比率(51%)的VA-ECMO组患者死于难治性CS,并且VA-ECOM的中位持续时间仅为2.7天(四分位间距[IQR]1.5-4.8),这个时间是非常短的(在以前的记录和研究中为5-10天)。这些数据再次提出了对纳入患者血液动力学表型以及VA-ECMO脱机管理的质疑。最后,只有0.5%的患者接受了长期心室辅助治疗(IABP-SHOCK-II组为6%),没有患者接受移植。在之前的138名ECMO治疗的AMICS患者中,15%的患者无法脱离ECMO(12%接受了长期心室辅助装置(VAD),3%接受了心脏移植)。
总之,ECLS-SHOCK试验没有证明早期VA-ECMO在未经选择的AMICS患者群体中的优越性,这不支持在这种情况下常规使用VA-ECMO。然而,ECLS-SHOCK结果应在其纳入标准和局限性的背景下进行解释和分析。在这一领域开展研究的挑战有很多(见图1),所以有必要重新制定标准来选择哪些患者可能真正受益于t-MCS,哪种类型、在哪一阶段、在哪种组合以及不可避免地向个体化医疗发展。正在进行的ANCHOR试验(NCT04184635)和即将发表的DanGer-SHOCK试验(NCT01633502)预计会获得进一步的结果,该试验评估了IMPELLA-CP在AMICS中的早期应用。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#急性心肌梗死# #心源性休克# #VA-ECMO#
117