B系“家族”掩护下的T淋巴瘤
2023-02-06 吴遐 张磊 中科大附属第一医院 “检验医学”公众号 发表于上海
对于肿瘤细胞比例较少,背景细胞中某一类细胞异常增高的淋巴瘤,要加强临床与检验沟通,检验者之间更要加强沟通,避免由于诊断方法本身盲点及专业壁垒导致的误诊、漏诊。
01 前 言
本案例患者为疑似淋巴瘤患者,为明确诊断就诊我院。患者颈部淋巴结肿大,外周血白细胞数明显增高,分类为成熟淋巴样细胞及浆细胞明显增高,骨髓中也可见大量浆细胞及成熟淋巴样细胞。通过采集外周血、骨髓及淋巴结标本,最后给予明确诊断:血管免疫母T细胞淋巴瘤伴继发性浆细胞增高。对于肿瘤细胞比例较少,背景细胞中某一类细胞异常增高的淋巴瘤,要加强临床与检验沟通,检验者之间更要加强沟通,避免由于诊断方法本身盲点及专业壁垒导致的误诊、漏诊。
02 案例经过
患者,女,54岁,于2020年12月无明显诱因出现左侧颈部肿大,伴疼痛,夜间盗汗,当地市医院B超提示颈部淋巴结异常肿大,遂来我院就诊,血常规:白细胞计数 17.76×10^9/L,红细胞计数 3.23×10^12/L,血红蛋白量 97.0g/L,血小板计数 50×10^9/L,淋巴结活检(外院病理片会诊,左侧颈部)提示淋巴瘤,收入血液科住院。
既往史:19年前因胆囊结石行“胆囊切除术”。体格检查:贫血貌,全身皮肤、粘膜未见瘀点瘀斑,双侧颈部、腋下及腹股沟多发黄豆至蚕豆大小肿大淋巴结,质韧,活动度欠佳,无明显压痛。肝脾肋下未触及。
入院后复查血常规:白细胞计数66.16×10^9/L,红细胞计数1.99×10^12/L,血红蛋白量61.0g/L,血小板计数95×10^9/L 单核细胞百分比37.1% 有核红细胞计数0.69/L,白细胞数进行性升高。
肝胆胰脾腹腔及腹膜后B超示:
1.肝脏形态饱满,脾大;
2.胆道未见明显扩张;
3.腹腔所见部位未见明显积液;
4.脾肾之间低回声结节(淋巴结?胰腺来源待排)。
PET-CT:脾大伴FDG代谢增高,肝脏、鼻咽部等FDG代谢增高,双侧腮腺区、颈部、锁骨上、腋窝、肺门、右侧胸骨旁、心膈脚、双侧腹股沟区等多发肿大淋巴结伴FDG代谢增高。
骨髓细胞学:不明细胞比例约占39.0%,一类形态特点:呈浆细胞样,形态大小不一,呈多形性,胞浆量中等,呈深蓝色,核偏位,染色质呈较粗状,核仁模糊~清晰。还有一类细胞胞浆浅蓝色,核居中,染色质较粗,核仁模糊。外周血可见不明细胞26%.
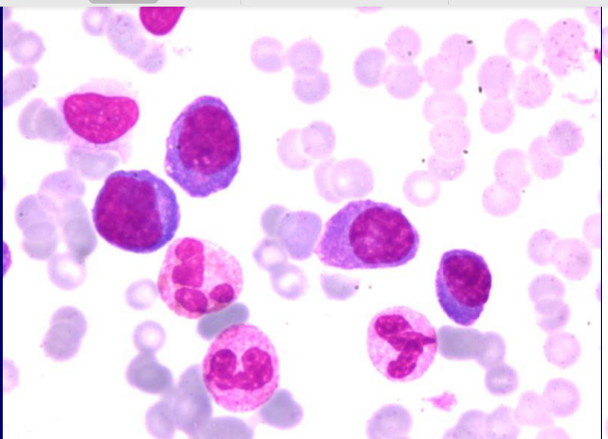
图1 外周血涂片瑞吉染色(10*100)

图2 骨髓涂片瑞吉染色(10*100)
骨髓标本流式细胞学
1.发现5.9%SSC增大,异常表型的成熟B淋巴细跑和0.2%异常细胞表型CD4+T淋巴细跑;2.浆细胞比例明显增高,未现单克隆;3.髓系幼稚细跑比例不高;CD3+T、nk、nkt细跑表型均无异常;粒细胞比例正常;未见明显非造血细胞。建议行IgH和TCR基因排,建议送淋巴结标本检测,并请结合其他实验室检查综合分析。
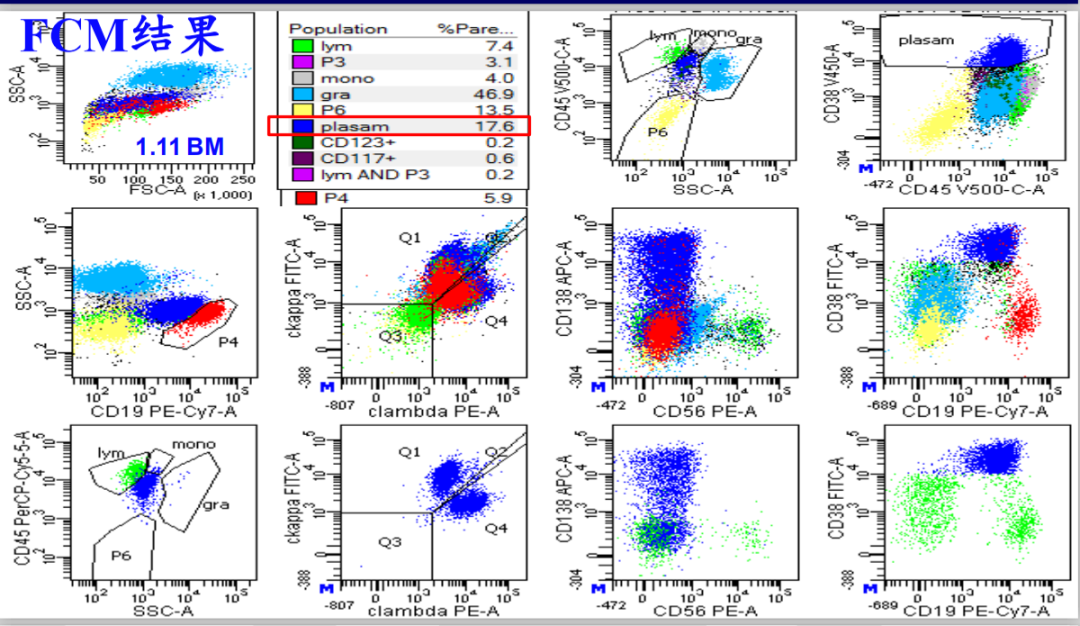
图3 骨髓流式细胞图
次日送检外周血流式细胞学:
1.发现0.05%异常表型CD4+T淋巴细胞;
2.成熟B淋巴细胞占淋巴细胞比例明显增高,细胞偏大,未见异常单克隆细胞。
浆细胞比例显着增高,未见单克隆。建议送淋巴结标本检测,并请结合其他实验室检查综合分析。
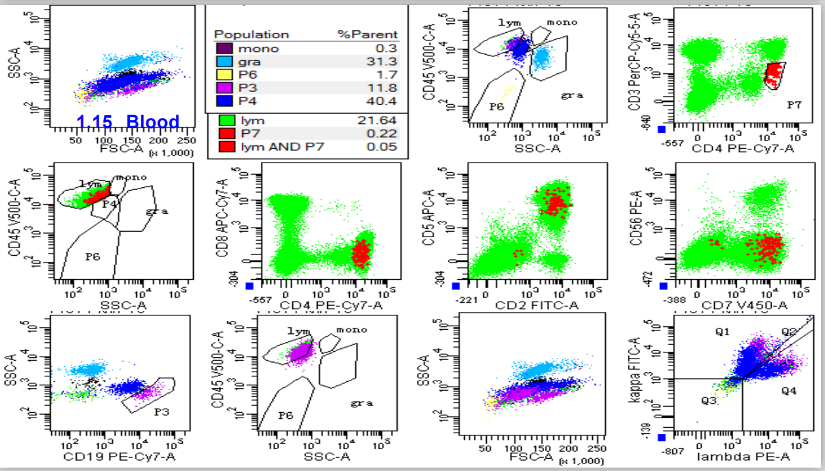
图4 外周血流式细胞图
免疫固定电泳:Y球蛋白区域见较宽而浓密的条带,呈扩散状,未见明显聚集的条带,请结合临床综合分析!

图5 免疫固定电泳
血清蛋白电泳:血清白蛋白24.73 %;血清a2球蛋白3.83 %;血清β球蛋白28.49 %;血清r球蛋白7.13 %。
免疫球蛋白:IgA:7.79g/L↑;IgG:57.55g/L↑;IgM:3.69g/L↑。
血轻链:血轻链K 11.00 g/L↑;血轻链L 11.40 g/L↑;
血β2-微球蛋白:10.70 mg/L↑。
尿轻链:尿轻链K 160.00 mg/L↑;尿轻链L 90.70 mg/L↑。
乳酸脱氢酶950 IU/L↑提升肿瘤负荷很高。
由于诊断疑似T淋巴瘤,血管免疫母T细胞淋巴瘤可能,为明确患者是否合并免疫系统疾病和免疫性溶血贫血:抗核抗体谱十六项:抗核抗体滴度 阳性* 1:320 均质,颗粒+,Coomb’s试验:直接抗人球蛋白试验neg阴性-;间接抗人球蛋白试验neg阴性-。
该病大部分存在EB病毒感染,巨细胞病毒核酸检测:阳性3.4E+5;EB病毒核酸检测:阳性1.6E+3
再次行左侧淋巴结活检,流式细胞学:
发现11.3%异常表型CD4+T淋巴细胞,考虑AITL可能,建议行TCR重排和二代测序;B淋巴细胞表型不完全正常,不能除外反应性,建议行IgH重排,建议随访;浆细胞比例显着增高,未见单克隆。请结合其他实验室检查综合分析。
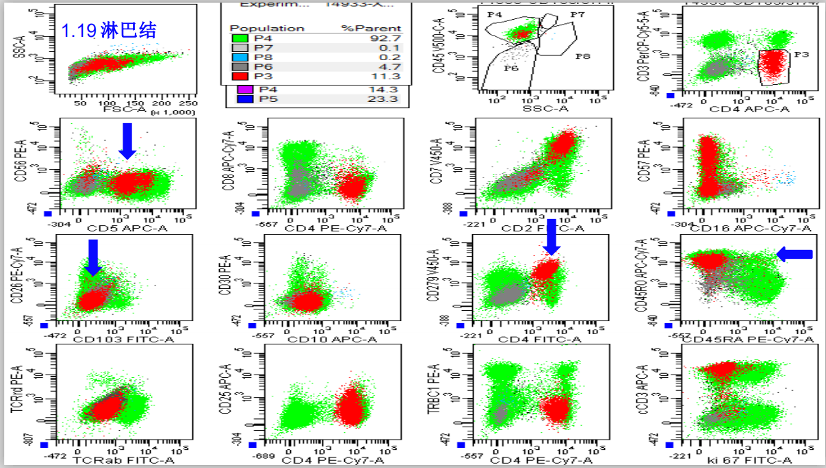
图6 淋巴结流式细胞图
病理组织学(骨髓组织):考虑T细胞性淋巴瘤累及骨髓。请结合临床及相关检查。
特殊染色:Ag(MF-1)。
免疫组化结果(IHC21-00800):CD3(少数+),CD5(少数+),CD20(-),PAX-5(-),MPO(髓细胞+),CD30(-),p53(-),CD38(浆细胞+),CD138(浆细胞+),CD56(-),Ki-67(骨髓细胞+,80%)。
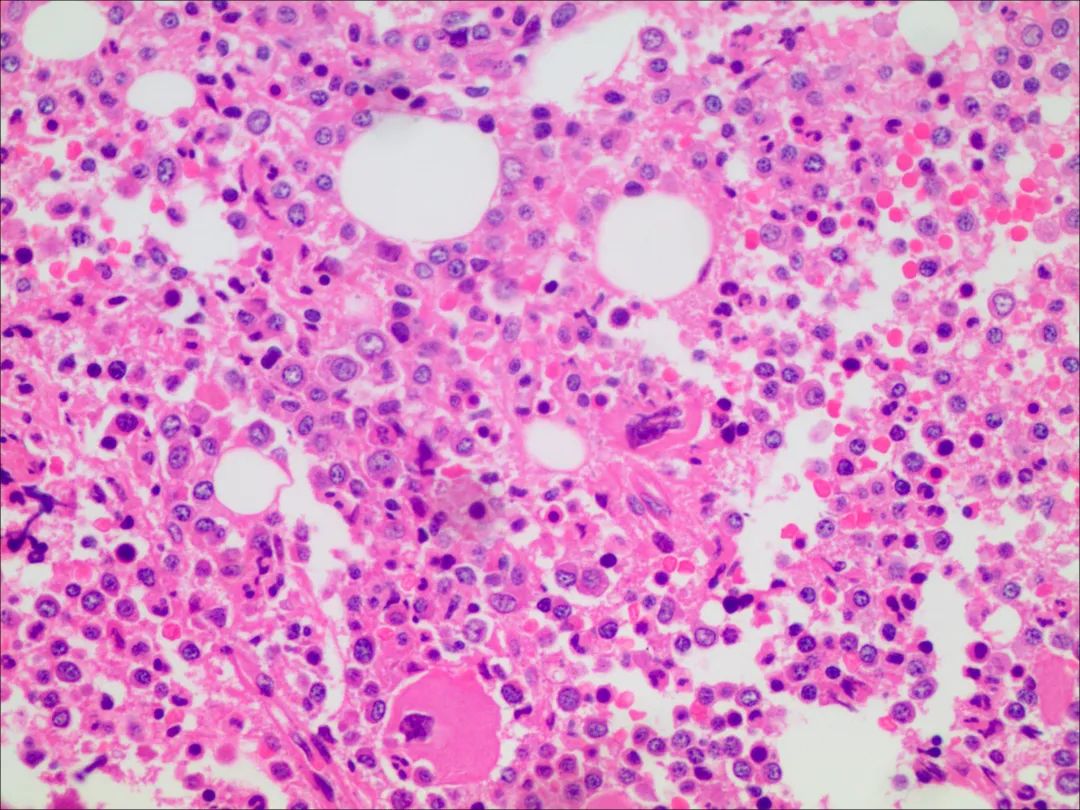
图7骨髓组织HE染色(10*40)
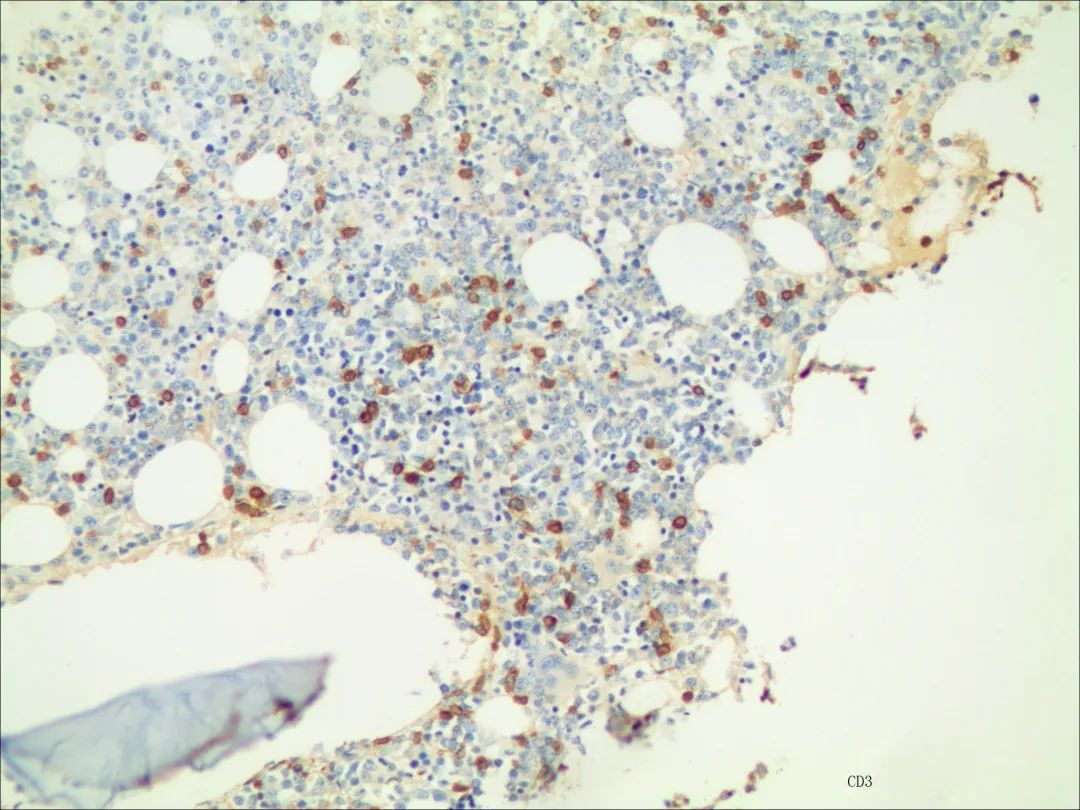
图8 骨髓组织CD3染色(10*40)
病理组织学(左侧颈部淋巴结活检)纤维脂肪横纹肌组织内见少许淋巴组织灶性浸润,组织较少,建议临床复查或可试行免疫组化标记进一步检查。
2021-01-22血清蛋白电泳(全自动蛋白电泳+扫描加收):M蛋白40.82%
2021-01-27血液标本:IgH基因重排检测阴性
2021-01-27淋巴结标本:IgH基因重排检测阴性
2021-01-27血液标本:TCRβ Tube A+. T细胞受体克隆性基因重排检测结果为阳性
2021-01-27淋巴结标本:TCRβ Tube A+;TCRβ Tube B+;TCRβ Tube C+;TCRγ Tube A+;TCRγ Tube B+;TCRδ Tube D+. T细胞受体克隆性基因重排检测结果为阳性
03 检验案例分析
诊断分析
1)该患者肿瘤细胞为CD4+T淋巴细胞,表达CD2,CD5,CD7,CD279,cCD3,丢失了CD3,CD4:CD8比值过高。符合血管免疫母T细胞淋巴瘤[1]。
2)患者外周血及骨髓浆细胞为正常多克隆浆细胞,而B淋巴细胞膜和细胞浆轻链都弱表达,表型异常。
检测指标分析
TCR重排:该患者外周血TCR重排仅有TCRβ阳性,而淋巴结TCR重排6管全阳。在不同标本中TCR重排阳性率有差别,有肿瘤浸润的组织标本阳性率高于血液标本。再者T细胞肿瘤中TCRβ阳性率94%,TCRγ阳性率89%,两者同检阳性率98%,TCRδ有助于早期淋巴瘤诊断。但是如果有典型的临床症状,即使所有TCR重排检测全阴性也不能因此排除T细胞淋巴瘤。
诊断方法分析
按照传统观念淋巴瘤诊断以病理活检为金标准。但该病例由于最早形态学在外周血中发现了大量浆细胞以及不明细胞,遂在骨髓送检流式后又加送了外周血标本,在病理组织学诊断不明朗的情况下,又加做了淋巴结标本的流式细胞学,才有了采用多种类标本,应用多种方法共同诊断,既明确了疾病进展的程度,也对每一类细胞的性质精确定性,大大提高了疾病诊断的精准性[2],也为后期精准治疗提供了依据。
本例患者特殊之处在于骨髓以及外周血、淋巴结均有大量表型异常的成熟B细胞及多克隆浆细胞存在,两者之和分别在外周血、骨髓、淋巴结中占52.2%,23.5%,37.6%;而肿瘤细胞为T淋巴细胞,且比例较低,在外周血、骨髓、淋巴结分别仅占0.05%,0.2%,11.3%,在二者比例如此悬殊的情况下,依靠某一种方法或者某一类标本都不够精确,且容易误诊。
浆细胞增多鉴别诊断
当骨髓、外周血中见到浆细胞增多[3],除了考虑浆细胞本身的疾病,还需要考虑反应性,该患者肿瘤负荷较高,如果浆细胞为肿瘤性,全身应该有更明显的CRAB症状[1],而该患者不仅骨质完全正常,钙离子在血中的浓度也正常。影像学也提示一个高代谢状态的表现,所以综合考虑更倾向于淋巴瘤。
该类疾病患者常发现存在EB病毒感染[1],而此患者EB病毒在疾病的全过程时隐时现,考虑该患者应该是EB病毒慢性感染。此类患者也是淋巴瘤高危人群。
该患者存在大量B淋巴细胞,表型异常,可能是由于反应性导致,但由于该患者存在EB病毒的长期感染,且现诊断为血管免疫母细胞淋巴瘤,所以它的B淋巴细胞表型需要尽可能的完整分析,染色体分析也需要关注B淋巴瘤相关的突变。并在后续的治疗中,密切关注B细胞表型的变化,及时发现随着时间推移疾病进展而出现B细胞淋巴瘤。
04 临床案例分析
该患者血管免疫母细胞性T细胞淋巴瘤,伴EBV阳性,预后差,5年生存率为30–36%。该病好发于老年人,中位年龄是60–65岁,发病率男性高于女性。确诊时几乎全部患者都在疾病的晚期阶段(III–IV期)。
临床一般常伴有广泛淋巴结肿大,B症状(70%), 皮肤瘙痒、红疹(50%), 肝大 (50%),脾肿大(79%), 胸腔积液(37%), 浮肿(40%), 腹水(25%)[1]。以及免疫机能失调,表现为全身性的炎症综合征、高丙种球蛋白血症,部分患者可见自身免疫疾病,包括:自身免疫性溶血性贫血、冷凝集性贫血、血管炎、多发性关节炎、桥本氏甲状腺炎。
这种自身免疫现象在其他PTCL中并不常见。该患者有淋巴结肿大,B症状,查体时并未发现皮损,但是该患者抗核抗体滴度 颗粒阳性,提示存在免疫系统功能紊乱。
患者反复胸闷,肿瘤负荷较高,淋巴结流式提示T细胞淋巴瘤,患者外周血及骨髓可见大量成熟B淋巴细胞,表型异常,同时合并EBV感染。所以尽管T-NHL,仍然加用了利妥昔单抗[4],兼顾CD20阳性的表型异常B淋巴细胞及EBV感染。
于2021-1予R-CHOP化疗2疗程,但2021-3出现耶氏肺孢子菌肺炎。此后CHOP方案治疗3疗程,2021-7采集自体造血干细胞,2021-8CHOP方案治疗1疗程。该疾病愈合较差,大部分患者死于疾病进展及化疗引起的免疫力低下继发的感染,所以该患者治疗需要在治疗效果和患者身体承受力上寻找一个平衡,在完全缓解后自体干细胞移植显然优于常规化疗,2021-8-23行ASCT,目前患者生存良好。
05 知识拓展
1)TFH细胞通过自分泌细胞因子或与B细胞相互作用[5],不仅辅助生发中心B细胞,也辅助自身细胞;此外,TFH细胞很可能提供信号给FDC细胞。已经在B细胞免疫缺陷病症中鉴定出与TFH相关的突变。
2)关于AITL的诊断方法,哪种方法学更好呢?虽然病理在诊断其它淋巴瘤中有很大的优势,但在AITL中有一定的局限性,特别是在大量反应性背景的情况下,如果仅有少量肿瘤细胞,则小的活检切片诊断困难。
在既往[6]38例AITL患者的144份标本(包括BM、PB、淋巴结、体液)进行了FCM分析总结:97例标本通过FCM可检测出异常的T细胞,异常细胞比例为0.5%-90%(占淋巴细胞比例)。16例患者中11例有外周血浸润。
AITL的FCM分析总结:
①所有病例的肿瘤细胞都是CD4+;
②CD3是最常见的异常标志:完全丢失sCD3(54%),部分丢失(5%),CD3强度降低(34%),表达增强仅占2%;
③70%的病例sCD3表达改变伴随着TCR的丢失或TCRab表达减弱;
④CD3表达改变常见于PB和BM,CD10表达异常更常见于淋巴结。
还有既往病例[7]统计得出最常见的异常是异常表达sCD3(80%,包括60%完全丢失sCD3表达);其次是异常表达CD7(73%)和过表达CD45RO(60%)。肿瘤细胞特征性地表现为TFH细胞表型:约60-100%的病例表达CD10,CXCL13,ICOS,BCL6,PD1(CD279),CXCR5,SAP,MAF(也称为c-MAF),CD200(大多数病例中)。
这种表型有助于鉴别AITL和不典型副皮质区增生和其他外周T细胞淋巴瘤[8],其中CD10和CXCL13最特异。PD1和ICOS最灵敏。所以AITL的诊断流式具有更多的优越性。在临床高度怀疑淋巴瘤的情况下,尽可能各类标本都需要做MIGM的诊断。
3)关于M蛋白:免疫固定电泳示Y球蛋白区域见较宽而浓密的条带,呈扩散状,未见明显聚集的条带,图显示为多克隆,但并不能排除M蛋白的存在。它既可能出现在免疫球蛋白呈多克隆的情况,也可能出现在单克隆疾病的早期。再者血清蛋白电泳:M蛋白数值阳,并不代表M蛋白真实存在,流式的浆细胞K/λ比值更为准确[3]。该值阳性还见于移植后免疫重建的患者及有风湿免疫疾病的患者。
4)血管免疫母细胞淋巴瘤伴有浆细胞增多,TCR基因重排较常见,但是由于该疾病还常伴有B细胞的克隆性增生,约25%-30%病例同时检出IgH/IgK重排,7%甚至仅存在IgH重排[4]。甚至经年进展为B-NHL,所以诊断AITL的同时,要将B细胞的免疫表型也要做全,及时发现潜在风险。
06 案例总结
对于淋巴瘤患者,最好采集多部位标本后综合诊断,不仅可以提高检出率,有些病例还可以尽早发现由于不同部位疾病进程不同而出现的亚克隆,提前干预,选择合适的治疗方案,提高治愈率。
各个诊断模块之间也要及时沟通,调整方向,提高检出速率及准确率,增加了临床及患者满意度,也提高了诊断的专业性。
关于报告单数字部分的解读,临床检验增加沟通,把机器数字变成临床语言,提高临床医师对于检验结果的理解,使检验结果更好的为临床服务。
检验工作者在工作中也可以根据自己的工作经验给临床提出合理的下一步检查的建议,不要做单一方向的接受者,增加临床检验互动,让检查更为精准,为临床提供更为高效的服务。
07 专家点评
中科大附属第一医院检验科 丁邦胜教授
该案例是临床及检验,检验与检验之间积极沟通,最终准确诊断的一个案例。这个患者淋巴结肿大,且伴有白细胞异常增高而就诊,外周血镜检及骨髓形态学提示大量浆细胞以及成熟样淋巴细胞,部分浆细胞形态偏幼稚,而流式细胞学明确骨髓中浆细胞为多克隆浆细胞,成熟样淋巴细胞为成熟B细胞,但存在部分表型异常。
在与骨髓病理实验室沟通后,与临床医师建议再次送检淋巴结活检同时做淋巴结流式细胞分析。经细胞形态学、免疫学和病理学等多方面沟通,并加做相关标记,最终确定各类细胞性质,并给予正确的诊断结果。该患者最终诊断非常明确,临床治疗有效。因此在日常工作中,临床和检验科室积极沟通的同时,检验专业之间也要加强联系沟通,减少专业壁垒带来的误诊、漏诊。及时准确的诊断结论提供给临床医师以便选择有效的治疗策略,可以大大提高患者的生存率。
参考文献
[1]2016 WHO造血和淋巴组织肿瘤分类
[2]Lome-Maldonado C, Canioni D, Hermine O, et al. Angio-immunoblastic T cell lymphoma (AILD-TL) rich in large B cells and associated with Epstein-Barr virus infection. A different subtype of AILD-TL?Leukemia 2002;16:2134–41
[3]Sokol K Kartan S, Johnson WT, Alpdogan O, et al. Extreme Peripheral Blood Plasmacytosis Mimicking Plasma Cell Leukemia as a Presenting Feature of Angioimmunoblastic T-Cell Lymphoma (AITL) Front Oncol. 2019 Jun 13;9:509.
[4] Shigeru Chiba 1, Mamiko Sakata-Yanagimoto. Advances in understanding of angioimmunoblastic T-cell lymphoma. Leukemia. 2020 Oct;34(10):2592-2606.
[5]Ahmet Dogan 1, Ayoma D Attygalle, Chara Kyriakou. Angioimmunoblastic T-cell lymphoma J Haematol. (2003) 121:681–91.
[6]Sanam Loghavi et,al Immunophenotypic and diagnostic characterization of angioimmunoblastic T-cell lymphoma by advanced flow cytometric technology. Leuk Lymphoma. 2016 ; 57(12): 2804–2812.
[7]Yabe et al. Bright PD-1 expression by flow cytometry is a powerful tool for diagnosis and monitoring of angioimmunoblastic T-cell lymphoma Blood Cancer Journal (2020) 10:32 https://doi.org/10.1038/s41408-020-0301-x.
[8]Chen W; Kesler MV; Karandikar NJ; Kroft SH; Flow cytometric features of angioimmunoblastic T-cell lymphomaCytometry B Clin Cytom.2006;70(3):142-8.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













还需要努力开发安全但高效的抗克隆疗法,并等待目前评估淀粉样蛋白靶向疗法的研究结果。
59