Cell:癌细胞如何策反周围健康细胞?
2016-04-17 生物通 生物通
发表在《细胞》(Cell)杂志上的一项新研究报告称,发现癌细胞利用了一种突变基因来胁迫邻近健康组织帮助癌症生长和扩散。研究人员发现,健康细胞被说服,释放出了癌细胞自身无法分泌的一些独特的生长信号,随后癌细胞利用了它们来实现增殖。他们的研究阐明了癌细胞与正常细胞之间彼此沟通的机制,这有可能为癌症治疗开辟一些新途径。 伦敦癌症研究所和英国癌症研究中心曼彻斯特研究所的科学家们发现,KRAS基因的错误版
发表在《细胞》(Cell)杂志上的一项新研究报告称,发现癌细胞利用了一种突变基因来胁迫邻近健康组织帮助癌症生长和扩散。研究人员发现,健康细胞被说服,释放出了癌细胞自身无法分泌的一些独特的生长信号,随后癌细胞利用了它们来实现增殖。他们的研究阐明了癌细胞与正常细胞之间彼此沟通的机制,这有可能为癌症治疗开辟一些新途径。
伦敦癌症研究所和英国癌症研究中心曼彻斯特研究所的科学家们发现,KRAS基因的错误版本对健康组织可以造成重要的影响。
正常的KRAS会生成一些临时信号告诉细胞进行分裂,但当突变之时,这一基因变得过度活化,帮助驱动了癌细胞快速、失控的生长。在新研究中,研究人员发现突变KRAS还发挥了另一个重要作用:将健康的“基质细胞”变为癌症的盟友。
这项研究第一次证实了,一个涉及某一致癌基因的通讯环路通过健康的基质细胞控制了癌症。
研究人员研究了一种类型的胰腺癌——胰腺导管腺癌细胞中的通讯网络。胰腺导管腺癌是最致命的癌症形式之一,每年在英国导致了约9000人死亡。
KRAS在超过90%的胰腺癌,和近20%所有类型的癌症中存在突变。
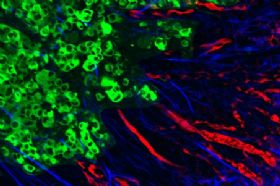
Figure 1
Tumor Cell KRASG12D Non-cell-autonomously Regulates PSCs
研究小组调查了不同胰腺导管腺癌细胞中数以千计不同的生长因子、蛋白和受体,看看信号是如何传递的。他们辨认出KRAS利用了一些众所周知的信号通路来与邻近健康细胞通讯,也注意到了一些不同寻常的东西。通过同时监测两种细胞中的蛋白质,他们发现健康细胞对一种全新的信号做出了反应——这一信号使得KRAS驱动癌细胞恶性行为的能力提高了一倍。
研究作者、伦敦癌症研究所的Chris Tape说:“我们的研究强调了,癌细胞并非独自驱动肿瘤的生长和扩散,它们可以欺侮健康的邻居来帮助它们。一些胰腺肿瘤内部的健康基质细胞多于癌细胞,因此认识癌细胞将它们的邻居转变为盟友的机制至关重要。我们发现了癌细胞说服基质组织分泌关键生长信号的机制,这样做为癌症治疗开辟了一些令人兴奋的新可能。”
伦敦癌症研究所该研究的领导者、现任职英国癌症研究中心曼彻斯特研究所的Claus Jorgenson博士说:“我们现在知道了肿瘤是由遗传不同的癌细胞和多种类型的健康细胞组成的一个复杂混合物,所有细胞彼此之间的通讯都是通过一个复杂的互作网络。解开这一网络,解码独立的信号,对于鉴别出众多的通讯中哪个对控制肿瘤生长和扩散最重要具有至关重要的意义。我们已经确定了癌症中最常突变的基因在与健康细胞的通讯中发挥的一种重要作用。阻断它的效应有可能是一种有效的癌症疗法。”
近日,加州大学旧金山分校的科学家们第一次在一个小鼠转移癌模型中,直接观察到了当侵袭性癌细胞迁移到肺脏时它们是如何建立滩头阵地的。他们看到的非常令人惊讶:定位在肺脏的早期“先头”癌细胞通常死亡,但它们首先放出了一些僵尸样的颗粒,这些颗粒可以自身四处移动,被一波波免疫细胞所吞噬。就好像被这些癌症颗粒感染了一样,其中许多的免疫细胞随后会钻入到肺组织中,为未来通过血液漂浮安全定居并形成新转移灶的癌细胞开辟空间。这项研究发布在2016年3月16日的Nature杂志上。
科学家们对免疫细胞在癌转移初期的作用已经有了充分的了解,它们会促使癌细胞从原发瘤扩散出去。那么,免疫细胞是否也推动了之后的侵袭和转移过程呢?Whitehead研究所的著名癌症生物学家Robert A.Weinberg领导团队对此进行了深入研究。他们发现,中性粒细胞是癌转移的关键调控者。(Nat Cell Biol:肿瘤相关单核巨噬细胞(TAM)参与癌症干细胞微环境建立)(Science:肿瘤恶性成功被逆转)。
原始出处:
Oncogenic KRAS Regulates Tumor Cell Signaling via Stromal Reciprocation.DOI: http://dx.doi.org/10.1016/j.cell.2016.03.029本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#CEL#
55
深度好文,值得关注
96
#Cell#
64
#癌细胞#
57
#健康细胞#
79
文章不错
81
值得关注
161
厉害?!!!
165
nature和cell这两篇文章
165
这种研究不太容易想到非常巧妙,不过也反映这两年中由于微环境之间的相互作用,成为研究热点。
136