Cell Reports: 王艳东/陈卫东团队揭示肝癌治疗新靶标及其复杂作用机理
2024-11-02 iNature iNature 发表于上海
本研究发现 STAMBPL1 调控 HCC 中 EGFR 蛋白稳定性和 RNA 剪接,揭示其促进 HCC 进展机制,为靶向 HCC 药物研发和联合治疗奠定基础,提示其及下游分子是潜在靶点。
肝癌是威胁人类健康的恶性肿瘤,发病率逐年上升。肝细胞癌(hepatocellular carcinoma, HCC)是肝癌最常见的病理类型。HCC患者确诊时多数已进入中晚期,治疗效果不佳。在我国HCC患者五年生存率不足20%。探究HCC进展过程中的分子机制,开发HCC靶向药物具有重要意义。
已知,蛋白质稳态对细胞发挥正常功能至关重要,蛋白质稳态失衡会引起肿瘤等各种病变。泛素化和去泛素化在维持人类细胞蛋白质稳态中发挥重要作用。泛素化是指泛素分子在一系列酶的作用下,对靶蛋白质进行特异性修饰,进而泛素标记的靶蛋白质被特异性识别并降解的过程。去泛素化是泛素化的逆过程。去泛素化是指泛素化的蛋白质在去泛素化酶的作用下解离泛素分子,将泛素分子从底物中去除并将泛素再循环到胞质池中的过程。泛素化和去泛素化是参与调节蛋白质稳态的重要机制,是肿瘤等疾病治疗药物的重要靶点。
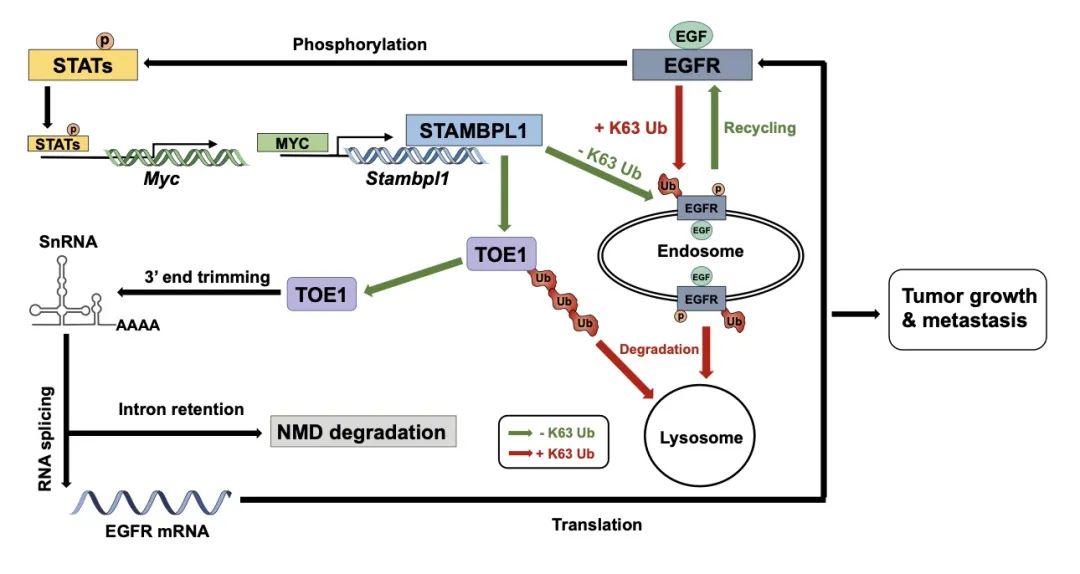
近期,北京化工大学王艳东教授课题组和内蒙古医科大学陈卫东教授课题组在Cell Press出版社旗下学术期刊Cell Reports 上发表了题为“A MYC-STAMBPL1-TOE1 positive feedback loop mediates EGFR stability in hepatocellular carcinoma”的研究论文(Cell Rep. 2024 Oct 22;43(10):114812. doi: 10.1016/j.celrep.2024.114812. Epub 2024 Oct 9.PMID: 39388352)。课题组研究人员发现,STAM结合样蛋白1(STAMBPL1)可以调控表皮生长因子受体(EGFR)的蛋白稳定性和RNA剪接。STAMBPL1在2003被鉴定出具备去泛素化酶功能。作为去泛素化酶,STAMBPL1通过调控肿瘤细胞的增殖、凋亡、存活、转移和侵袭,参与促进多种肿瘤的进展。EGFR作为跨膜受体酪氨酸激酶家族的一员,促进下游信号通路的激活和癌基因的表达,并在多种肿瘤中表达异常升高或者活化。课题组研究人员发现,在蛋白层面,STAMBPL1通过与STAM1结合,减少EGFR蛋白的K63泛素化,避免其溶酶体降解。在RNA层面,STAMBPL1通过去除TOE1蛋白上的K63连接的泛素链,减少其自噬溶酶体降解,进而促进RNA剪接体的形成和EGFR的pre-mRNA剪接。同时,发现EGF激活EGFR后,通过MYC-STAMBPL1-TOE1轴促进EGFR的RNA剪接,敲除STAMBPL1可以抑制MYC驱动的HCC的发生以及提高仑伐替尼治疗肝癌的效果。这些结果揭示了STAMBPL1促进HCC进展的分子机制,为特异性靶向HCC药物的研发和联合治疗奠定了理论基础,提示STAMBPL1及其下游调控分子可能是潜在的HCC药物设计靶点。
相关文章请见:
https://www.cell.com/action/showPdf?pii=S2211-1247%2824%2901163-X
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#肝细胞癌# #STAMBPL1#
27