支气管肺发育不良患儿的麻醉管理
2023-07-17 麻醉MedcalGroup 麻醉MedcalGroup 发表于上海
该疾病以间质纤维化、肺泡过度膨胀和区域性肺不张交替出现和气道异常为特征,包括鳞状化生和过度肌化。
全世界超过1/10的新生儿是早产儿(<胎龄37周),每年有1500多万早产儿,其中240万在妊娠32周之前出生,1967年,Northway等对32例因呼吸窘迫综合征(respiratory distress syndrome,RDS)进行机械通气的早产儿进行研究后,发现了支气管肺发育不良(broncho pulmonary dysplasia,BPD)。该疾病以间质纤维化、肺泡过度膨胀和区域性肺不张交替出现和气道异常为特征,包括鳞状化生和过度肌化。
在早产儿存活的早期,呼吸机治疗通常包括高吸入氧浓度(FiO2)、高通气量和气道压力,现已知这些治疗方式会导致严重的肺损伤,并在许多早期BPD患者中导致严重的慢性肺部疾病。
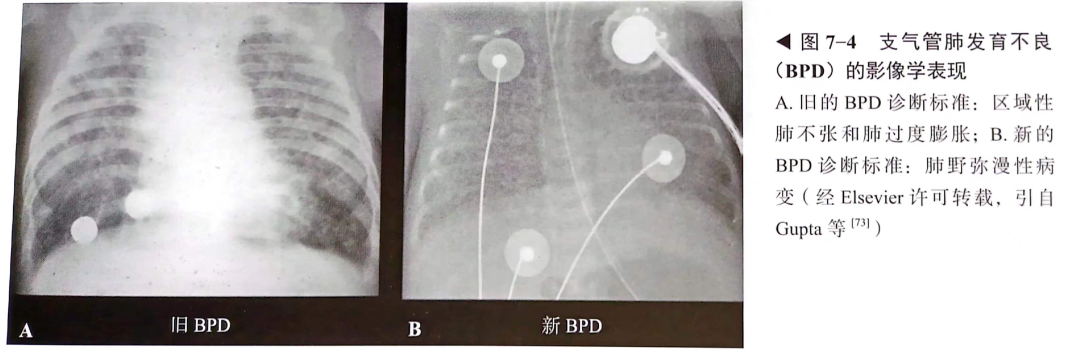
近年来,随着早产儿存活率的升高,以及对高氧引起肺损伤和机械通气压力过高、容量过大带来的不良影响的认识,BPD表型已转变为气道和肺泡发育停滞的组织学形态改变:肺泡数量减少,肺泡直径大于正常,未出现更严重的形态改变(图7-4)。
然而,尽管早产儿的治疗策略有所改进,BPD仍是早产儿最常见的并发症,超过2/3的29周之前出生的儿童肺发育受到影响。BPD与早产儿死亡率升高、神经发育不良和慢性呼吸道疾病有关。
目前,对BPD最常见的定义是,诊断为RDS的早产儿需要进行28天以上的氧疗(与是否需要机械通气无关),孕36周后BPD可进一步分为轻度、 中度或重度。
将BPD进一步分型:
轻度BPD,即氧疗时间≥28天,孕36周后可停止氧疗;中度BPD,即氧疗时间≥28天,孕36周后需继续氧疗FiO2< 0.3;重度BPD,即氧疗时间≥28天,孕36周后需要机械通气和(或)需继续氧疗FiO2> 0.3。
各研究中心BPD的发病率差异较大,但在最近的研究中,出生体重500~ 1500g的妊娠24~31周的早产儿,根据孕36周后对氧气的需求量计算,BPD的平均发病率为25%~ 30%;然而,因各中心的研究结果存在差异,BPD的发病率为5%~ 60%。
BPD的总体发病率是稳定的,但由于早产儿的存活率增加,BPD的总体发病率可能略有升高。BPD的危险因素包括较低的胎龄和出生体重、宫内发育迟缓、胎儿性别男、哮喘家族史、未接受产前糖皮质激素治疗及可能未知的遗传因素。
关于BPD的发病机制的新理论为,处于小管晚期和囊泡期的肺部发育关键阶段的极早产儿发生肺损伤,导致肺结构发育停滞和关键阶段的修复中断,肺损伤可能的风险因素包括绒毛膜羊膜炎和胎儿炎症反应、呼吸机诱导的肺损伤(容积伤、气压伤、肺不张)、氧毒性(氧自由基的产生和脂质过氧化)、表面活性物质缺乏及血管生成的中断[血管内皮生长因子(vascular endothelial growth factor,VEGF)途径的抑制] 。
降低BPD发生率和严重程度的措施包括:对RDS早产儿使用无创通气模式替代气管插管。nCPAP和通过特殊设计的鼻罩进行的鼻间歇正压通气(nasal intermittent positive pressure ventilation,NIPPV)均可用于无创通气。
无创通气作为继发于RDS的呼吸系统衰竭的主要治疗手段,可以让部分婴儿避免气管插管,但目前尚无一致的证据证明这些手段可以降低BPD的发生率。无创通气作为拔管后的主要治疗方法,可以减少气管插管和机械通气的持续时间。然而,拔管后使用这些通气模式并没有最终证明可以降低BPD的发生率。
现代常规机械通气采用微处理器技术,可实现患者触发同步通气、容量保证通气和流量循环通气,所有这些通气模式在预防呼吸机诱发的肺损伤方面都具有优势。与压力控制通气模式相比,容量控制通气模式可以降低BPD的发生率。
允许性高碳酸血症缩短了机械通气时间,但并不能降低BPD发生率。高频振荡通气常用于RDS的早产儿,研究发现这种通气模式可以降低BPD的发病率。
氧中毒在RDS和BPD恶化的发病机制中扮演重要角色。在最近的研究中,以SpO2控制在85%~89%范围为目标,而不是94%~97%,可能可以减少肺损伤和减轻BPD的严重程度;为进一步阐明其效果,正在进行相关的Meta分析。产前单次使用糖皮质激素(地塞米松或倍他米松),可以促进胎儿肺表面活性物质成熟,降低RDS的严重程度,但尚无证据表明可以降低BPD的风险,这可能与早产儿存活率的增加有关。
使用表面活性剂治疗可显著降低RDS的发生率和严重程度,但仍不能降低BPD的发生率,这同样可能与早产儿存活率增加有关。最初用于减少早产儿呼吸暂停的咖啡因疗法,也可以降低BPD的发病率。
吸入性一氧化氮(inhaled nitric oxide,iNO)是一种强效肺血管扩张药,已用于早产儿低氧性呼吸衰竭的治疗,但随机对照试验结果显示,它对BPD的生存率和发病率的影响不一致,因此不推荐作为RDS的常规治疗。
其他用于RDS患儿治疗,并评估其可降低BPD发生率的药物包括吸入皮质类固醇、呋塞米、β受体激动药、抗胆碱能吸入药、吲哚美辛、布洛芬、维生素E、超氧化物歧化酶,但这些药物并未降低BPD的发病率。
有效降低BPD发病率的治疗方法除了咖啡因疗法外,还包括在出生后口服补充糖皮质激素、维生素A和肌醇。
大多数关于早产儿BPD的纵向研究发现肺功能异常在极早产儿、BPD严重程度较高者、宫内发育受限者中加重。通常,这种肺功能异常包括不同程度的气道阻塞、支气管高反应性、过度通气和气体弥散功能障碍。
BPD患儿支气管高反应性的潜在原因尚不清楚,究竟是由于气道结构改变还是细菌性气道炎症引起的还存在争议。
【麻醉医师须注意】
在面对BPD的患者时,麻醉科医师必须充分回顾病史和阅读目前的胸部X线片。
根据上文提到的标准,评估BPD的严重程度。检查通常可以发现婴儿在接受补充氧疗时出现不同程度的呼吸急促、肋间肌和肋下凹陷,并有肺水肿或支气管反应性增加的迹象,如细啰音和呼气性喘息。
了解患者的基础血氧饱和度和PaCO2很重要,两者通常可从毛细血管或静脉血气中获得。
术中的通气策略应尽量减少气压伤、容积伤和氧中毒,允许性高碳酸血症与患者基础的PaCO2水平持平。
麻醉科医师必须预测到BPD患者术后可能出现的以下情况并做好相关计划,肺顺应性下降、气道阻力增加、术后机械通气风险增加,这些都必须对BPD患者进行预测和计划。
术中可能需要使用利尿药或支气管扩张药,以优化围术期肺部预后。
对麻醉科医师而言,识别支气管高度反应性尤为重要,在气道操作引起机械刺激的情况下应更加警惕。
早产儿的呼吸道症状通常被认为是哮喘,尽管其潜在的病理生理原因似乎与BPD患儿不同,在BPD患儿中没有观察到嗜酸性炎症通路。这也表明,常规哮喘治疗可能对这些儿童无效。
此外,肺动脉高压已被认为是儿童BPD的一个重要并发症,术前应筛查患儿是否患有肺动脉高压。
在围术期的其他因素中,低温、疼痛和酸中毒可导致肺血管收缩。这些是造成低氧血症的重要危险因素,因为BPD患儿的呼吸储备有限,而通气-血流比例失调会进一步增加低氧血症的风险。
此外,麻醉还可能进一步加重潜在的右心室功能损害。
虽然随着年龄的增长,症状通常会缓解,而且在术前评估时儿童可能没有症状,但支气管高反应性的发生率仍然是升高的,增加了围术期呼吸不良事件的风险。
【关于支气管肺发育不良要点】
⑴BPD表型已转变为气道和肺泡发育停滞的组织学形态改变:肺泡数量减少,肺泡直径大于正常,未出现更严重的变化。
⑵关于BPD的发病机制的新理论,在小管晚期和肺泡期的肺发育关键阶段的早产儿发生肺损伤,导致肺结构发育受阻,并破坏其修复。
⑶允许性高碳酸血症可缩短机械通气的持续时间,但不能降低BPD的发生率。
⑷以SpO2 控制在85%~89%范围为目标,而不是94%~97%,可能可以减少肺损伤和减轻BPD的严重程度。
⑸BPD包括不同程度的气道阻塞、支气管高反应性、过度通气和气体弥散功能障碍。
⑹肺动脉高压是公认的BPD患儿的重要并发症。
⑺围术期体温过低、疼痛和酸中毒可导致肺血管收缩。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言