Arthritis Rheumatol:FoxO1缺失增强系统性红斑狼疮中B细胞异常激活的作用机制及其治疗潜力
2024-11-08 潘华 MedSci原创 发表于上海
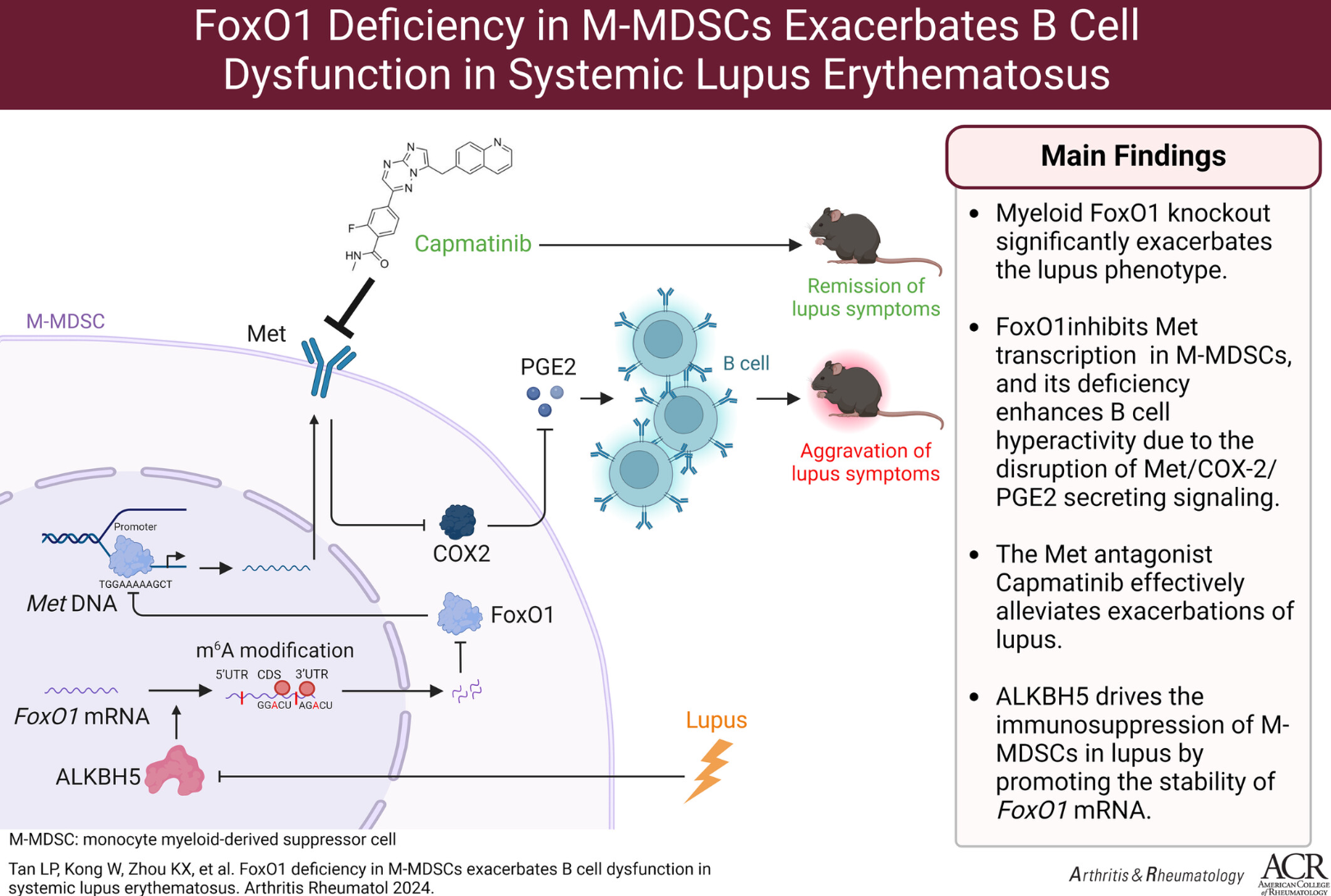
FoxO1缺失会导致B细胞异常增殖和活化,加剧SLE病情。
系统性红斑狼疮(SLE)是一种自身免疫性疾病,其中髓系抑制性细胞(MDSCs)通过支持浆细胞的存活在疾病进展中起关键作用。研究发现,单核髓系抑制性细胞(M-MDSCs)中的叉头盒蛋白O1(FoxO1)表达水平与SLE疾病活动指数(SLEDAI)评分呈负相关,提示FoxO1可能在调节M-MDSCs功能和控制SLE进展方面具有重要作用。本研究旨在验证FoxO1缺失是否通过增强B细胞异常功能加剧SLE病情,并探讨这一机制的潜在治疗价值。

首先,利用GEO数据库和临床样本对SLE患者和SLE模型小鼠中M-MDSCs的FoxO1表达及其临床意义进行验证。通过Cre-LoxP技术构建FoxO1缺失的髓系特异性敲除小鼠(mFoxO1-/-),在小鼠SLE易感模型中观察其对B细胞功能的影响。通过整合ChIP-seq和转录组分析、荧光素酶报告基因实验及ChIP-qPCR,评估FoxO1在转录调控中的作用。使用甲基化RNA免疫沉淀测序(MeRIP-seq)、RNA测序和CRISPR-dCas9技术分析FoxO1的m6A修饰情况。体外B细胞共培养实验、Capmatinib胃内灌胃、m6A调控的MDSCs移植以及SLE患者样本验证,用以探讨FoxO1在M-MDSCs失调中对B细胞的调节作用。
研究结果表明,FoxO1在SLE患者和狼疮小鼠的M-MDSCs中表达降低,而FoxO1缺失的髓系特异性敲除小鼠(mFoxO1-/-)表现出更显著的B细胞功能异常。机制上,FoxO1通过与启动子区结合抑制Met基因的转录。FoxO1缺失的M-MDSCs会阻断Met/COX2/PGE2分泌通路,导致B细胞增殖和过度活化。此外,Met拮抗剂Capmatinib有效缓解了狼疮的加重过程。研究还发现,ALKBH5通过在FoxO1 mRNA的CDS和3'-UTR区域催化m6A修饰,调控FoxO1的表达水平。通过在M-MDSCs中过表达ALKBH5提高FoxO1水平,可以有效改善狼疮的进展。最后,在未经治疗的SLE患者样本中证实了这些相关性。
研究设计与主要研究结果
本研究揭示了M-MDSCs中的FoxO1通过Met/COX2/PGE2通路在B细胞调控中的关键作用,FoxO1缺失会导致B细胞异常增殖和活化,加剧SLE病情。此外,ALKBH5介导的m6A修饰上调FoxO1表达在改善SLE病程中具有显著疗效。这些发现表明,通过调控ALKBH5/FoxO1/Met轴以抑制B细胞的活化,可作为管理SLE的新型治疗策略。
原始出处:
FoxO1 Deficiency in M-MDSCs Exacerbates B Cell Dysfunction in Systemic Lupus Erythematosus. Arthritis Rheumatol. 2024 Nov 4. doi: 10.1002/art.43046. Epub ahead of print. PMID: 39492682.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#系统性红斑狼疮(SLE)# #叉头盒蛋白O1(FoxO1)#
31