中国糖原累积性肌病诊治指南(四)
2016-07-28 中华神经科杂志 中华神经科杂志
Ⅴ型糖原累积病(glucogen storage disease type Ⅴ,GSDⅤ)GSDⅤ型又称为肌磷酸化酶缺乏症(myophosphorylase deficiency),还可称为麦卡德尔病(McArdle disease)。GSDⅤ型是一种常染色体隐性遗传性疾病,由于位于染色体11q13上的肌磷酸化酶基因(human myophosphorylase gene,PYGM)发生突变,
Ⅴ型糖原累积病(glucogen storage disease type Ⅴ,GSDⅤ)
GSDⅤ型又称为肌磷酸化酶缺乏症(myophosphorylase deficiency),还可称为麦卡德尔病(McArdle disease)。
GSDⅤ型是一种常染色体隐性遗传性疾病,由于位于染色体11q13上的肌磷酸化酶基因(human myophosphorylase gene,PYGM)发生突变,导致肌磷酸化酶的活性明显减低或缺失,使糖原支链的α-1,4葡萄糖苷键不能被水解生成葡萄糖-1磷酸,影响糖原分解和ATP的产生,糖原在肌纤维内大量堆积,细胞膜的兴奋性和肌肉收缩或放松功能出现异常。
一、临床表现
GSDⅤ型是比较常见的非溶酶体性GSD,发病率约为1/100 000。国内仅有个别病例报道。在发病年龄和病情严重程度上存在异质性[48,49]。
1.一般在15岁之前发病,也可在50岁以后发病;隐袭起病,慢性病程,男性多于女性。
2.绝大多数患者的主要症状是运动不耐受和易疲劳,运动诱发性肌痛、强直、痉挛、肿胀僵硬感,常出现在四肢近端,伴有心率加快和气短。剧烈运动或持续中、高强度运动易诱发症状,如:举重物、连续俯卧撑、爬楼梯、搬运重物等,个别患者咀嚼或刷牙等也可诱发运动肌肉的疲劳、疼痛。休息可使症状缓解,疼痛也可持续数小时或更长时间。
3.再振作现象(second wind phenomenon),又称继减现象,是本病的特征性症状,表现为患者在开始运动的10~15 min内出现运动肌肉渐进性疲劳感、无力、肌痛、肌强直,伴心慌,但在经过短暂停顿或减慢运动后,症状突然消失,且运动能力和耐力明显改善。
4.部分患者逐渐出现持续性肌无力,以四肢近端为主,多数程度较轻,部分患者日常生活能力下降。少数晚发患者存在明显的肌肉萎缩,以肩带肌、骨盆肌和躯干肌为主,可有非对称的翼状肩胛或面肩肱分布的肌萎缩。少数患者肌肉肥大,包括三角肌、肱二头肌、腓肠肌、大腿肌群。少数患者可伴有吞咽困难、眼睑下垂,个别累及呼吸肌。
5.半数以上的患者有过肌球蛋白尿或横纹肌溶解发作,部分发作导致了急性肾功能衰竭。多以剧烈运动为诱因。
6.少见类型:有的患者仅表现为单纯肌酸激酶水平增高或轻度易疲劳;个别研究报道称,在应用降脂药引发肌酸激酶升高伴或不伴有肌肉症状的患者中,可筛查出GSDⅤ型;个别伴有肥厚型心肌病;个别严重的病例可在婴儿期出现全身无力、呼吸衰竭或精神运动发育迟滞,预后差。
二、实验室检查
1.90%以上患者的血清肌酸激酶呈轻-中度升高,可有一定波动性,运动有时可导致肌酸激酶急剧升高和肌球蛋白尿。
2.前臂缺血运动试验是最经典的筛查GSD的试验,但可能诱发患者肌肉疼痛和痉挛,甚至可诱发肌红蛋白尿和骨筋膜室综合征,故不推荐使用。改良前臂非缺血运动试验研究发现[50]:不采用袖带充气加压,其他步骤与前臂缺血运动试验相同,结果显示运动后血乳酸和血氨的变化与前臂缺血运动试验相似,对疾病评估具有同样的敏感度和特异度。GSDⅤ型患者运动后血乳酸无明显升高,一般认为运动后4~5 min内血乳酸水平不升高或升高幅度小于基线的1.5倍,而血氨明显升高为异常。另外,采用50%的最大握力、以0.5 Hz的节律抓握握力器2 min;或以30%的最大握力抓握握力器,保持2 min,也可以得到相近的结果。
3.再振作现象(继减现象)试验:12分钟行走试验(12 minute walk test):在跑步机上或在长走廊内,患者以尽可能快的速度连续行走12 min,期间监测心率并记录症状。GSDⅤ型患者在初始阶段,随着行走时间的延长,心率加快和肌肉疲劳、肌痛等症状逐渐加重,但5~10 min后心率恢复、症状改善。15分钟单车骑行试验:患者以中等运动强度(运动时心率提高达到预计最大心率的60%~70%,预计最大心率=220-年龄)连续单车骑行15 min,具有同样的评估意义[51,52]。
4.肌电图:发作间期肌电图表现可正常,约50%的患者可见轻度的肌源性损害,可伴有纤颤电位和CRDs。
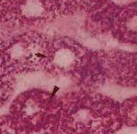
5.肌肉活检:肌纤维浆膜下多发空泡样改变,PAS染色阳性,可被淀粉酶消化,提示糖原颗粒聚集。在标本制备工程中,糖原颗粒可脱失,导致空泡区PAS阴性;有些轻型病例可无空泡样改变。采用树脂包埋标本的半薄切片进行PAS染色可避免糖原脱失,更好地显示糖原聚集。其他病理改变包括散在单个肌纤维坏死伴吞噬现象,在横纹肌溶解发作后更加明显。磷酸化酶的组织化学染色显示患者肌纤维不着色,但肌间血管平滑肌着色,提示骨骼肌纤维内肌磷酸化酶活性明显减低[52]。注意磷酸化酶染色时需要将患者肌肉切片与对照标本切片置于同一玻片上进行染色,以保证结果的可靠性。另外,由于肌纤维再生活跃时肌磷酸化酶组织化学染色也可能呈阳性反应,易导致误诊,因此,应避免在横纹肌溶解或肌球蛋白尿发作后短期内进行此项检查。电镜下观察可见糖原颗粒明显增多,肌浆膜下、肌原纤维间斑片聚集呈"糖原湖"。
6.生化检测:大多数患者肌肉中肌磷酸化酶活性缺失,少数患者肌磷酸化酶活性少量残存。有些PYGM基因复合杂合突变者的肌磷酸化酶活性减低,但临床上无异常表现。有研究报道,采用外周血白细胞经过PYGM抗体标记,流式细胞仪计数PYGM阳性T细胞数,发现患者与健康人之间差异明显[53]。
7.PYGM基因检测:PYGM基因由2 523个碱基对组成,包含20个内含子和12个外显子。已有近百种致病性基因突变被发现,包括纯合突变或复合杂合突变,尚未发现基因突变类型与临床表型的相关性[54,55,56,57]。
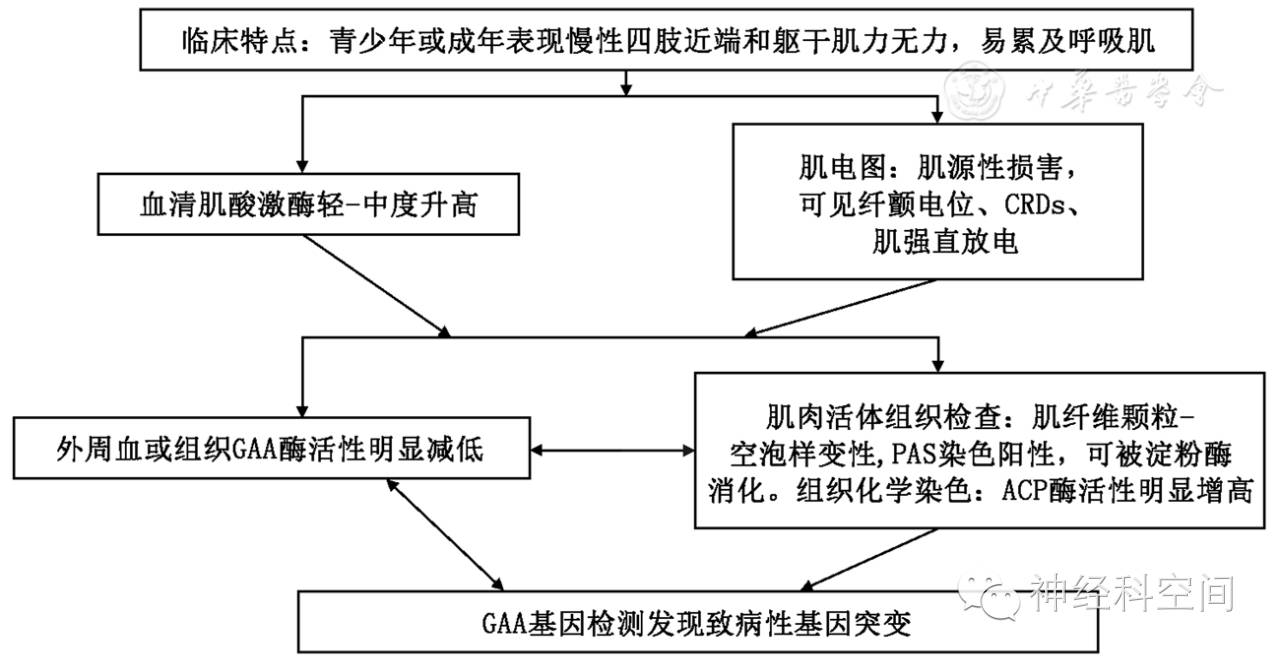
三、诊断依据
1.临床特点:运动诱发的肌肉无力、疼痛、痉挛,伴再振作现象,多数患者有过横纹肌溶解发作,且多与剧烈运动相关,部分患者伴不同程度的持续性肌无力。
2.血清肌酸激酶升高,可有波动性。
3.前臂运动试验:运动后血乳酸无升高或升高幅度明显低于健康对照。
4.再振作现象(继减现象)试验:12分钟行走和15分钟单车骑行试验提示存在再振作现象。
5.肌电图:肌源性损害,常伴有纤颤电位和CRDs。
6.肌肉活检:肌纤维浆膜下空泡,PAS染色呈深着色,且可被淀粉酶消化,组织化学染色显示肌磷酸化酶活性缺失或明显降低。
7.PYGM基因检测:发现致病性基因突变。
GSDⅤ型的具体诊断流程详见图2。
图2
Ⅴ型糖原累积病诊断流程图
四、鉴别诊断
1.GSD Ⅶ型:又称肌磷酸果糖激酶缺乏症(muscle phosphofructokinase deficiency)或Tarui病(Tarui disease),临床表现与GSDⅤ型十分相似,主要区别在于,GSD Ⅶ型常伴有溶血性贫血;进食高碳水化合物食物后运动相关的疲劳症状加重;无运动中再振作现象;肌肉活检组织化学染色或肌肉组织生化检测显示磷酸果糖激酶活性明显减低;PFKM基因突变。还有多种类型的GSD患者的临床表现与GSDⅤ型十分相似,鉴别主要依据相关酶活性测定和基因检测。
2.部分类型的脂肪代谢异常性肌病和线粒体肌病在临床上也表现运动不耐受,易发生横纹肌溶解,但无明显再振作现象,运动后血乳酸水平升高,肌肉活检有助于鉴别,酶活性测定和相关基因检测可以帮助鉴别诊断。
3.其他:还需要和骨骼肌离子通道病、重症肌无力、Lambert-Eaton肌无力综合征、内分泌肌病、其他病因的横纹肌溶解症相鉴别。
五、治疗[58,59,60,61]
1.尚无针对基因和酶替代的治疗。
2.目前有一些病例治疗疗效观察和少量安慰剂对照研究报道,但治疗研究纳入的患者数量很少,疗效评价存在一定局限性,包括:低剂量一水肌酸(60 mg·kg-1·d-1)可以增加患者的运动耐受性,但是大剂量(150 mg·kg-1·d-1)会加重肌痛症状;运动前口服含75 g蔗糖的液体,可提高患者的运动耐力,减少运动中的心率增快,尤其在运动前5 min进食效果更为明显;日常高碳水化合物饮食可提高患者的运动能力;个别报道称维生素B6补充治疗可以改善患者的症状;个别病例观察发现患者高蛋白饮食后运动耐力显著改善。
3.规律的低-中强度的运动练习对GSDⅤ型患者是安全的,并有助于改善患者的运动耐力。在中高强度运动之前,进行5~15 min的热身运动,可促进代谢的转换,减轻或避免患者运动初期的不耐受症状。
4.避免横纹肌溶解的诱因,包括剧烈运动或连续重复性运动,慎用他汀类药物。个别报道称在GSDⅤ型家系中有恶性高热的病史,患者骨骼肌离体三氟溴氯乙烷收缩试验阳性,提示该疾病可能具有恶性高热易患性[54]。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#诊治指南#
57
#肌病#
78
继续学习
72
继续关注
96