Hepatology:陆军军医大学柴进等团队合作发现SLC35C1可减轻胆汁淤积性肝损伤和炎症
2024-08-09 iNature iNature 发表于上海
该研究发现阻塞性胆汁淤积患者和小鼠模型中肝脏SLC35C1 mRNA转录本和蛋白表达显著增加。
炎症反应是胆汁酸(BA)诱导的胆汁淤积性肝损伤的关键,但分子机制仍有待阐明。溶质载体家族35成员C1 (SLC35C1)可将鸟苷二磷酸基团转运到高尔基体中,促进蛋白糖基化。它的突变导致白细胞粘附不足,增强人类的炎症。然而,人们对其在肝脏疾病中的作用知之甚少。
2024年7月10日,陆军军医大学柴进、陈文生、潘琼和耶鲁大学蔡仕英共同通讯在Hepatology在线发表题为“Hepatic GDP-fucose transporter SLC35C1 attenuates cholestatic liver injury and inflammation by inducing CEACAM1 N153 fucosylation”的研究论文。该研究发现阻塞性胆汁淤积患者和小鼠模型中肝脏SLC35C1 mRNA转录本和蛋白表达显著增加。
免疫荧光显示,上调的SLC35C1表达主要发生在肝细胞中。肝脏特异性消除Slc35c1(Slc35c1 cKO)显著加重了由胆管结扎和1%胆酸喂养诱导的小鼠胆汁淤积模型中的肝损伤,表现为肝坏死、炎症、纤维化和胆管增生的增加。Slc35c1 cKO增加了小鼠胆汁淤积模型中肝脏趋化因子Ccl2和Cxcl2的表达,以及T细胞、中性粒细胞和F4/80巨噬细胞的浸润,但不影响血清和肝脏胆汁酸的水平。液相色谱-串联质谱分析显示,肝脏Slc35c1缺乏显著减少了细胞-细胞粘附蛋白CEACAM1在N153位点的岩藻糖基化。从机制上讲,胆汁淤积水平的结合胆汁酸通过激活STAT3信号通路促进CEACAM1在N153位点的岩藻糖基化,从而刺激SLC35C1的表达,而CEACAM1在N153位点的岩藻糖基化缺失则增强了初级小鼠肝细胞和Primary Liver Carcinoma/Poliomyelitis Research Foundation/5-ASBT细胞中BA刺激的CCL2和CXCL2 mRNA表达。

肝脏中的胆汁酸(BAs)积累可以引起胆汁淤积性肝损伤。如果不及时治疗,这种损伤将进展为肝纤维化、肝硬化和肝衰竭。作者和其他研究表明,肝内胆汁酸可以通过刺激趋化因子(如CCL2和CXCL2)的表达引发炎症反应,吸引炎症免疫细胞(如中性粒细胞)并启动肝细胞损伤。同时,胆汁酸也可以通过激活JAK/STAT3和P38/MAPK信号(如RUNX1和IL32)触发负反馈回路,抑制过度炎症并减轻胆汁淤积性肝损伤。然而,尚不清楚其他机制是否参与胆汁酸诱导的肝损伤病理。
溶质载体家族35成员C(SLC35C)基因,包括SLC35C1和SLC35C2,编码核苷酸糖运输蛋白,将鸟苷二磷酸-岩藻糖从细胞质运输到高尔基体和内质网(ER)腔中以促进蛋白质糖基化。SLC35C1和SLC35C2在包括肝脏在内的广泛器官和组织中表达。具体而言,SLC35C1将鸟苷二磷酸-岩藻糖运输到高尔基体进行蛋白质N-岩藻糖基化,而SLC35C2则特异性地参与蛋白质O-岩藻糖基化。人类SLC35C1的突变会导致白细胞粘附缺陷II型(LADII)并加剧炎症。SLC35C1在肝细胞癌(HCC)和肝内胆管癌(iCCA)中也表现出上调表达,但其在肝病尤其是胆汁淤积中的功能作用尚不清楚。
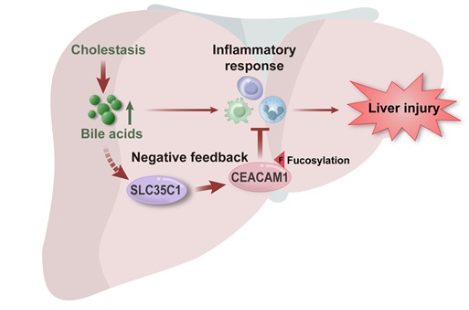
模式机理图(图片源自Hepatology )
癌胚抗原相关细胞粘附分子1(CEACAM1),也称为CD66a和胆道糖蛋白,是一种高度糖基化的细胞粘附分子。它主要在上皮细胞(如肝细胞)、内皮细胞和免疫细胞中表达。CEACAM1可以调节细胞分化、肿瘤发生和转移、胰岛素敏感性以及在各种疾病中的黏膜免疫,包括HCC、非酒精性脂肪性肝病(NASH)和炎症性肠病。此外,在自身免疫性肝炎的小鼠模型中,Ceacam1缺乏通过激活先天淋巴和髓系细胞加剧肝损伤和炎症。相反,肝脏特异性转基因小鼠中CEACAM1的过表达通过减少饮食诱导的代谢和炎症反应来保护肝脏免受损伤。这些观察结果支持CEACAM1作为肝脏炎症反应负调节因子的假设。有趣的是,在阻塞性黄疸患者的血清和胆汁中以及胆管结扎(BDL)诱导的胆汁淤积性肝损伤大鼠模型中检测到了CEACAM1。然而,关于肝脏CEACAM1在胆汁淤积性肝损伤中的作用及其与SLC35C1的功能关联知之甚少。
在本研究中,作者调查了肝脏SLC35C1在胆汁淤积中的表达和功能。作者发现肝脏SLC35C1表达在胆汁淤积患者和小鼠胆汁淤积模型中显著上调。在小鼠肝脏中缺乏SLC35C1显著加剧了胆汁淤积性肝损伤和炎症,并与CEACAM1在N153位点的岩藻糖基化减少有关,这表明SLC35C1是胆汁淤积性肝损伤的负调节因子。这些发现可能有助于开发治疗胆汁淤积性肝病的新策略。
原文链接:
https://doi.org/10.1097/HEP.0000000000001003
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#胆汁淤积性肝损伤# #SLC35C1#
111