临床热点:多发性骨髓瘤分层及个体化治疗
2012-04-10 田磊磊 北京协和医院
导语 多发性骨髓瘤(multiple myeloma,MM)是一种浆细胞恶性疾病,其生物学异质性强,临床治疗差异明显。近年来,MM的危险分层及个体化治疗策略成为临床治疗热点,本文为北京协和医院血液内科的李剑医生就此进行的综述分析,先摘录如下,以飨读者。 多发性骨髓瘤危
导语
多发性骨髓瘤(multiple myeloma,MM)是一种浆细胞恶性疾病,其生物学异质性强,临床治疗差异明显。近年来,MM的危险分层及个体化治疗策略成为临床治疗热点,本文为北京协和医院血液内科的李剑医生就此进行的综述分析,先摘录如下,以飨读者。
多发性骨髓瘤危险分层及个体化治疗策略
作者:北京协和医院血液内科 李剑
多发性骨髓瘤(MM)是一种好发于老年人的克隆性浆细胞肿瘤,其中位发病年龄约为65岁。MM的生物学异质性很强,不同患者之间可能存在着明显不同的病程、治疗反应及预后。近年来,一些临床指标、细胞遗传学和基因表达谱特征被用于预测MM患者的病程和预后,这有助于建立MM患者的个体化治疗策略。现将MM危险分层及个体化治疗策略方面的最新进展综述如下。
临床因素
年龄
尽管MM是一种老年性疾病,但是年龄仍然是决定MM患者预后的重要因素之一。
与年轻患者相比,高龄患者有着更差的体能情况和更多的合并症,对化疗的耐受性更差。因此,与年轻患者希望通过积极治疗达到长期缓解并获得长期生存的治疗目标不同,高龄患者的主要治疗目标是缓解症状和提高生存质量,次要目标才是生存期延长。
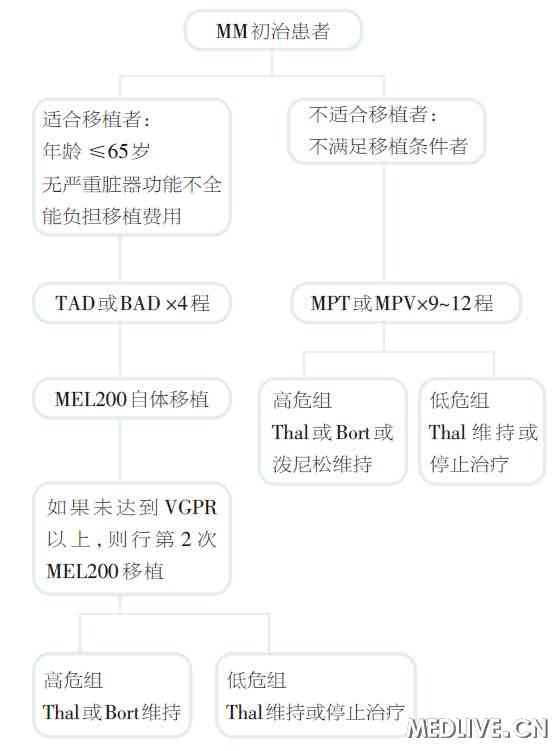
临床实践中一般以65岁(部分单位以70岁)作为划分年轻和高龄的标准。在治疗策略方面,对于≤65岁的患者,主张给予短程强化诱导(三药联合诱导)、基于大剂量美法仑的自体造血干细胞移植以及晚期的维持治疗。对于年龄>65岁的患者,则主张给予长疗程(9~12程)诱导化疗(基于MP方案的三药联合),后期可给予一定的维持治疗(图)。

图 推荐MM患者个体化治疗策略
BAD:硼替佐米、阿柔比星、地塞米松;Bort:硼替佐米;MEL200:美法仑200 mg/m2;MPT:美法仑、泼尼松、沙利度胺;MPV:美法仑、泼尼松、硼替佐米;TAD:沙利度胺、阿柔比星、地塞米松;Thal:沙利度胺;VGPR:非常好的部分缓解。低危组:ISSⅠ期,LDH正常,无(t 4:14)、(t 14;16)和17p-。高危组:ISSⅡ~Ⅲ期,高LDH,有(t 4:14)、(t 14;16)或17p- DS和ISS分期
DS(Durie-Salmon)分期是最常用的MM分期系统,但只能用于判断MM的肿瘤负荷,而不能用于判断MM患者的预后。
2005年国际骨髓瘤工作组(IMWG)提出了基于血清β2微球蛋白(β2MG)和血清白蛋白水平的国际分期系统(ISS)(表1)。ISS分期与预后明显相关,ISS Ⅰ期患者中位生存时间约为62个月,而Ⅲ期患者中位生存时间仅为29个月。

虽然没有结合细胞遗传学改变进行预后分层是其最大缺陷,但ISS适用于各类人群(包括各种人种及接受移植或新药治疗的患者),临床应用比较简单、操作性强、不需要特殊设备和技术,因此未来ISS分期仍应是我国MM患者预后分层最重要的因素之一。
疗效
MM患者经过治疗后有以下几种缓解模式,持续完全缓解(CR)、短期CR后快速复发、持续部分缓解(PR)。
多项研究已经证实,获得CR可以预测MM患者有着更长的无进展生存(PFS)时间和总生存(OS)时间。但是,最近美国小石城的TT(Total Therapy)研究经验告诉我们,只有持续CR(≥3年)才是预后最为相关的因素(5年OS率为82%),获短暂CR后复发患者的预后(5年OS率为24%)甚至不如持续PR患者(5年OS率为59%)。
因此,获得持久和深层次的CR是年轻MM患者的治疗目标。
其他因素
血清乳酸脱氢酶(LDH)水平也被广泛用于评估MM患者的预后。高水平LDH(>250 U/L)代表高肿瘤负荷和高增殖率,往往预示着患者预后不良。另外,IgD型以及存在髓外浆细胞瘤或浆细胞白血病也是MM患者的不良预后因素。
更多阅读>>>
中国多发性骨髓瘤诊治指南(2011年版)
NCCN临床实践指南:多发性骨髓瘤(2012.V1)
细胞遗传学因素
基于细胞遗传学的危险分层是近年来MM领域取得的主要进展之一。利用常规的中期G显带染色体核型技术和间期原位荧光杂交(FISH)技术,已发现骨髓瘤细胞中存在着多种染色体异常,这些异常与患者的临床预后密切相关。
美国梅奥医院(Mayo Clinic)是最早将染色体异常用于MM患者危险分层并据此制定个体化治疗策略的单位,表2列出了Mayo骨髓瘤分层和适应风险治疗(mSMART) 路径1.0版(2007年)和2.0版(2010年)中基于细胞遗传学的危险分层标准。

2011年IMWG也提出了MM细胞遗传学危险分层共识,其标准与mSMART 1.0版类似。
从上述分层标准中可以看出,t(14;16)和17p-始终是MM患者的高危不良预后因素,自体移植和现有新药(包括沙利度胺、硼替佐米和来那度胺)都不能克服这些不良因素。因此,对此类高危患者应在诱导期积极给予多药联合化疗,自体移植巩固,最后接受长时间的维持治疗。异基因造血干细胞移植对于年轻的高危MM患者也可以是一种选择。
基于t(4;14)的危险分层被部分学者认为是MM个体化治疗的典范。在自体移植和沙利度胺的时代,t(4;14)患者预后很差,基本不能从自体移植中获益。但后期的TT3研究发现,长疗程硼替佐米治疗可显著改善t(4;14)患者预后,其PFS和OS与非t(4;14)患者相似。因此mSMART 2.0版将t(4;14)列为中危标准,并将硼替佐米诱导和维持治疗列为t(4;14)患者标准治疗方案。
在临床实践中,最为重要的是需要区分出高危患者,并针对这些患者给予特殊的治疗选择,包括更强的诱导和巩固以及更长时间的维持治疗(图),还包括更多地参与临床试验等。因此在MM基线评价时,需要完成最基本的细胞遗传学检查,包括染色体核型G显带和FISH检测[包括t(4;14)、t(14;16)和17p-]。
更多阅读>>>
硼替佐米联合地塞米松诱导治疗可改善t(4;14)骨髓瘤患者转归
基于细胞遗传学异常和DNA倍数评MM患者维持治疗的预后情况
基因表达谱
美国阿肯色大学最早将基因表达谱(GEP)用于MM的危险分层,利用微阵列基因芯片技术鉴定出70个与MM的CR持续时间、 PFS及OS相关的基因,用上调和下调基因平均表达水平比值的高低将MM患者分成高危和低危组。高危组5年持续CR率为20%,而低危组为60%。同时,结果还显示,GEP是独立于ISS和高危染色体异常的预后因素。此后国际骨髓瘤基金会(IMF)也开发了基于15个基因的GEP模型,高危组3年 OS率为47%,低危组为91%。因此,GEP对MM危险分层有着重要意义。但目前关于GEP操作、数据分析及结果判断的标准尚未达成共识,而GEP分析也需要专门的设备和技术人员,因此,现阶段还很难将GEP推广到常规临床实践中。
综上所述,对MM患者进行基于临床因素、细胞遗传学和GEP结果的危险分层是MM个体化治疗的基础。鉴于我国目前的临床现状,应该至少采用临床因素以及最基本的细胞遗传学进行危险分层,并采用相应的治疗策略。 更多阅读>>>
基于患者年龄和易感性的多发性骨髓瘤个体化治疗
注:本文原载于中国医学论坛报
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#多发性#
90
#个体化治疗#
82
#个体化#
90