作者:翁建平 单位:中国科学技术大学附属第一医院
当前新型冠状病毒肺炎(COVID-19)疫情仍在世界各地蔓延,是国际社会聚焦的突发公共卫生事件。历经全国各界数月来坚持不懈的全力抗疫后,我国以湖北省武汉市为中心的本土疫情流行已基本落幕,疫情防控趋于常态化。
国际糖尿病联盟2019年发布的数据显示,我国糖尿病患者群体高达1.16亿。在这非常时期,应如何协助COVID-19合并糖尿病患者做好血糖管理,以及采取何种程度的医疗干预是医护、学者们关注的热点问题。鉴于高血糖可能通过炎症途径及刺激机体生成自由基影响肺部通气和肺泡弥散功能[1],且感染可能增强机体应激反应导致更大的血糖浮动这一恶性循环[2],医护人员亟需扎根临床的相关研究数据对COVID-19患者的血糖控制情况与死亡等不良事件的风险关系进行分析,从而实施更有效的医疗干预。
2020年5月1日,武汉大学李红良教授团队[3]在《细胞-代谢》杂志报道了湖北省19家医院于2019年12月30日至2020年3月20日收治的7337例COVID-19住院病例的流行病、临床、影像学、实验室和人口统计资料,并对患有2型糖尿病(T2DM)952例(占病例总数的13.0%,与全国范围内T2DM患病率10.9%相近)及未患T2DM的6385例进行分组回顾分析。与未合并T2DM患者相比,合并T2DM的COVID-19病例年龄更大(中位年龄分别为62岁和53岁),出现呼吸困难等临床症状的比例更高(分别为20.5%和15.4%),易于合并基础疾病(包括高血压分别为53.4%和19.7%、冠心病分别为13.7%和3.7%、脑血管疾病分别为5.6%和1.5%)。相关报道:Cell Metab:李红良教授发现糖尿病合并新冠肺炎的患者血糖控制水平与死亡率相关

糖尿病患者可因体内的高血糖状态导致其免疫力低下,在该团队报道的952例合并T2DM的COVID-19病例中,发生外周血淋巴细胞减少症的比例要显著高于未合并T2DM的患者(分别为44.5%和32.6%),而表明炎症反应和高凝状态的血清标志物升高也显著多于无T2DM组(C反应蛋白分别为57.0%和42.4%,降钙素原分别为33.3%和20.3%,D-二聚体分别为50.5%和33.3%)[3]。这印证了高血糖状态对人体免疫系统存在的不利影响可能导致COVID-19患者更容易出现各类感染、炎症反应和血栓栓塞等不良事件。
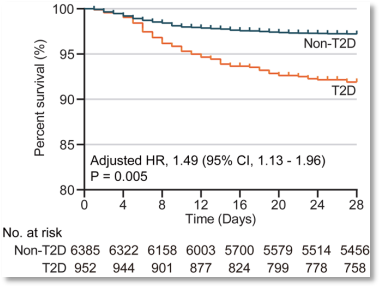
此外笔者注意,该团队报道的7337例患者中,T2DM组入院时血氧饱和度低于95%的发生率更高(分别为18.8%和13.2%),更容易出现成人呼吸窘迫综合征(分别为16.9%和7.2%),因此也更频繁地采用各类呼吸支持手段(包括吸氧分别为76.9%和61.2%,无创通气分别为10.2%和3.9%,有创通气分别为3.6%和0.7%)[3]。尽管合并T2DM的COVID-19患者接受了强度更高的综合治疗,其不良预后的比例却未能就此降低(感染性休克分别为3.8%和1.0%,弥散性血管内凝血分别为0.5%和0.2%,死亡率分别为8.4%和2.8%,调整后的危险比为1.49),说明患有T2DM的COVID-19个体比非糖尿病个体需要更多的医疗干预,其死亡率更高,多器官损伤更明显。
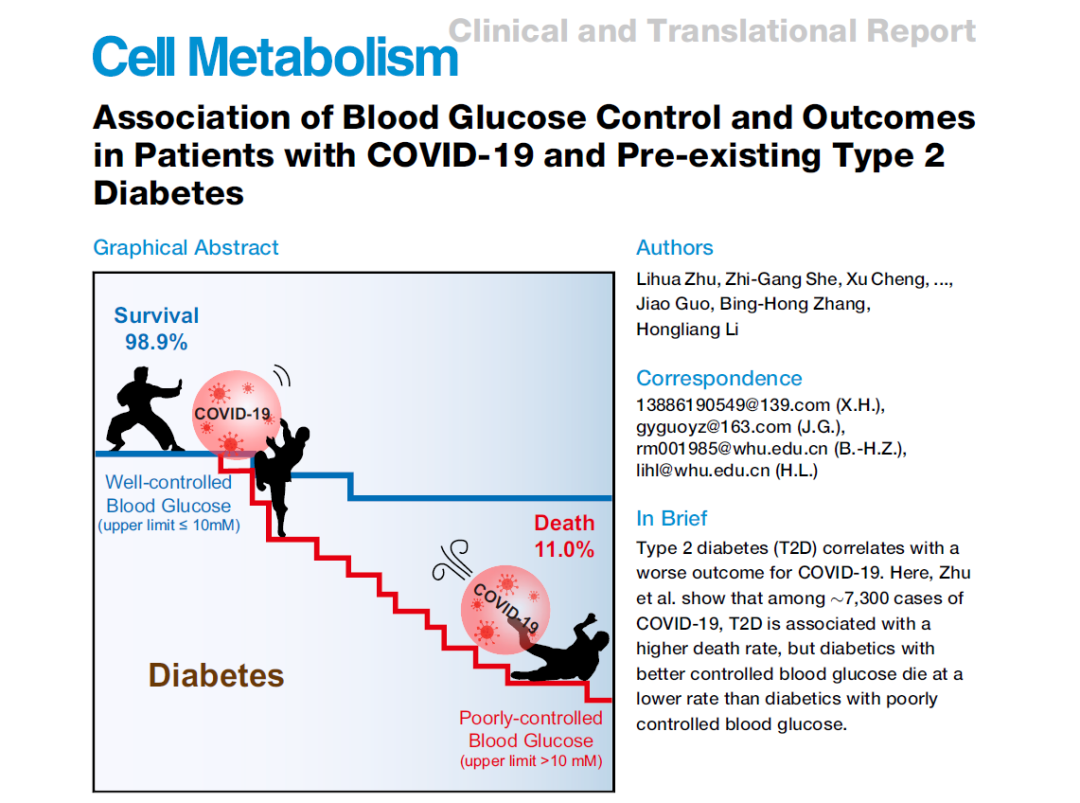
我们应采取什么样的血糖控制策略,制定什么程度的血糖控制目标呢?该团队[3]通过对T2DM组进行细化分析,对比该队列中282例血糖控制良好的患者(其血糖变化范围为3.9~10.0 mmol/L,中位年龄为62岁,男性患者136例,占48.2%)和528例血糖控制较差的患者(其血糖变化上限超过10.0 mmol/L,中位年龄为63岁,男性298例,占56.4%),发现与血糖控制较差的COVID-19患者相比,血糖控制良好患者入院时血氧饱和度低于95%的比例更低(分别为12.6%和22.7%),其淋巴细胞减少症发生率也较低(分别为30.5%和49.6%),提示较好的血糖控制可能有助于改善COVID-19患者的肺部氧合状况和机体免疫力,因此需要呼吸支持的比例也更低(包括吸氧分别为70.2%和83.5%,无创通气分别为4.6%和11.9%,有创通气分别为0.0%和4.2%)。还应注意的是,虽然血糖控制良好患者所需的医疗投入显著降低(使用抗病毒药物的比例分别为62.8%和71.2%,输注免疫球蛋白的比例分别为15.3%和26.5%),但住院期间发生不良事件的比例明显更低(成人呼吸窘迫综合征分别为7.1%和21.4%,感染性休克分别为0.0%和4.7%,弥散性血管内凝血分别为0.0%和0.6%),其死亡率也更低(分别为1.1%和11%)。这说明对于合并T2DM的COVID-19患者控制血糖是一种可行的辅助治疗手段,更有利于保护重要脏器功能。
这一项发现为改善COVID-19合并T2DM患者的血糖状态和临床预后提供了充分证据,也明确提出对于T2DM这类COVID-19进展和不良终点的重要危险因素,将血糖稳定在适宜的范围内(3.9~10.0 mmol/L)有助于降低此类患者不良事件的发生和死亡率,改善其临床结局。
参考文献
[1] Roca-Ho H, Riera M, Palau V, et al. Characterization of ACE and ACE2 expression within different organs of the NOD mouse[J]. Int J Mol Sci, 2017,18(3):E563. DOI:10.3390/ijms18030563.
[2] 王宝丽, 胡伦阳, 蒋勇, 等. ICU患者应激性高血糖治疗的研究进展[J/CD]. 中华危重症医学杂志(电子版), 2019,12(4):276-280. DOI:10.3877/cma.j.issn.1674-6880.2019.04.014.
[3] Zhu LH, She ZG, Cheng X, et al. Association of blood glucose control and outcomes in patients with COVID-19 and pre-existing type 2 diabetes[J]. Cell Metab, 2020, 31(1). DOI:10.1016/j.cmet.2020.04.021.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#临床结局#
81
#T2DM患者#
79