中国医大:维生素D通过恢复肠道菌群和代谢缓解非酒精性脂肪肝
2023-04-11 微科盟海星 医药加学习班 发表于上海
维生素D(Vitamin D,VD)作为人体必需营养素,通过其在胃肠道中的高表达受体(Vitamin D Receptor,VDR)对肠道菌群的调节起着重要作用。
导读
非酒精性脂肪肝病(NAFLD)是一个严重的公共卫生问题。肠道菌群失调是导致非酒精性脂肪性肝病的重要环境因素之一。维生素D(Vitamin D,VD)作为人体必需营养素,通过其在胃肠道中的高表达受体(Vitamin D Receptor,VDR)对肠道菌群的调节起着重要作用。本研究采用HFD(高脂饲料)喂养大鼠12周,并每周2次通过腹腔注射给予VD。通过H&E染色结合血浆生化指标观察肝脏病理改变及功能变化,粪便微生物16S rRNA基因测序和代谢组学来揭示肠道菌群和代谢产物的变化。结果表明,补充VD可减轻HFD诱导的肝脏脂质蓄积,并降低谷丙转氨酶(ALT)和谷草转氨酶(AST)水平。维生素D的添加降低了厚壁菌门/拟杆菌门(F/B)的比值,但增加了α多样性。此外,VD处理通过增加普雷沃氏菌属和紫单胞菌科以及降低粘螺菌、Acetatifactor、脱硫弧菌属和颤螺菌属丰度改善HFD诱导的肠道菌群紊乱。VD处理后酪氨酸代谢、色氨酸代谢、精氨酸生物合成和鞘脂代谢能力增强。普雷沃氏菌属与色氨酸代谢和鞘脂代谢呈正相关。普雷沃氏菌属丰度与分别由色氨酸、酪氨酸、精氨基琥珀酸和丝氨酸合成的血清素、褪黑素、色胺、L-精氨酸和3-脱氢鞘氨醇呈正相关。VD治疗可抑制HFD诱导的NAFLD,并抑制肠道菌群及其代谢产物的失调,VD补充剂可能是一种潜在的靶向特定菌群的NAFLD治疗干预措施。
论文ID
原名:Vitamin D alleviates non-alcoholic fatty liver disease via restoring gut microbiota and metabolism
译名:维生素D通过恢复肠道菌群和代谢缓解非酒精性脂肪肝
期刊:Frontiers in Microbiology
IF:6.064
发表时间:2023.02
通讯作者:都健,刘慧鑫
通讯作者单位:中国医科大学附属第四医院
实验设计
实验结果
1. VD摄入可减轻HFD诱导的NAFLD和肝损伤
如图1 A-C所示,与正常饮食(ND)相比,高脂饮食(HFD)显著增加大鼠体重(BW)、肝脏/体重比和空腹血清葡萄糖。相对于HFD喂养的大鼠,VD处理显著降低了上述指标。此外,通过H&E染色在HFD组的肝脏中观察到明显脂滴积聚(图1D-E)。电子显微镜观察显示,与HFD组肝脏相比,VD可抑制肝细胞肿胀和膜破裂(图1F)。与喂食HFD的大鼠相比,VD干预后血清ALT、AST、TG和TC也显著降低(图1G-J),这与组织学变化是一致的。
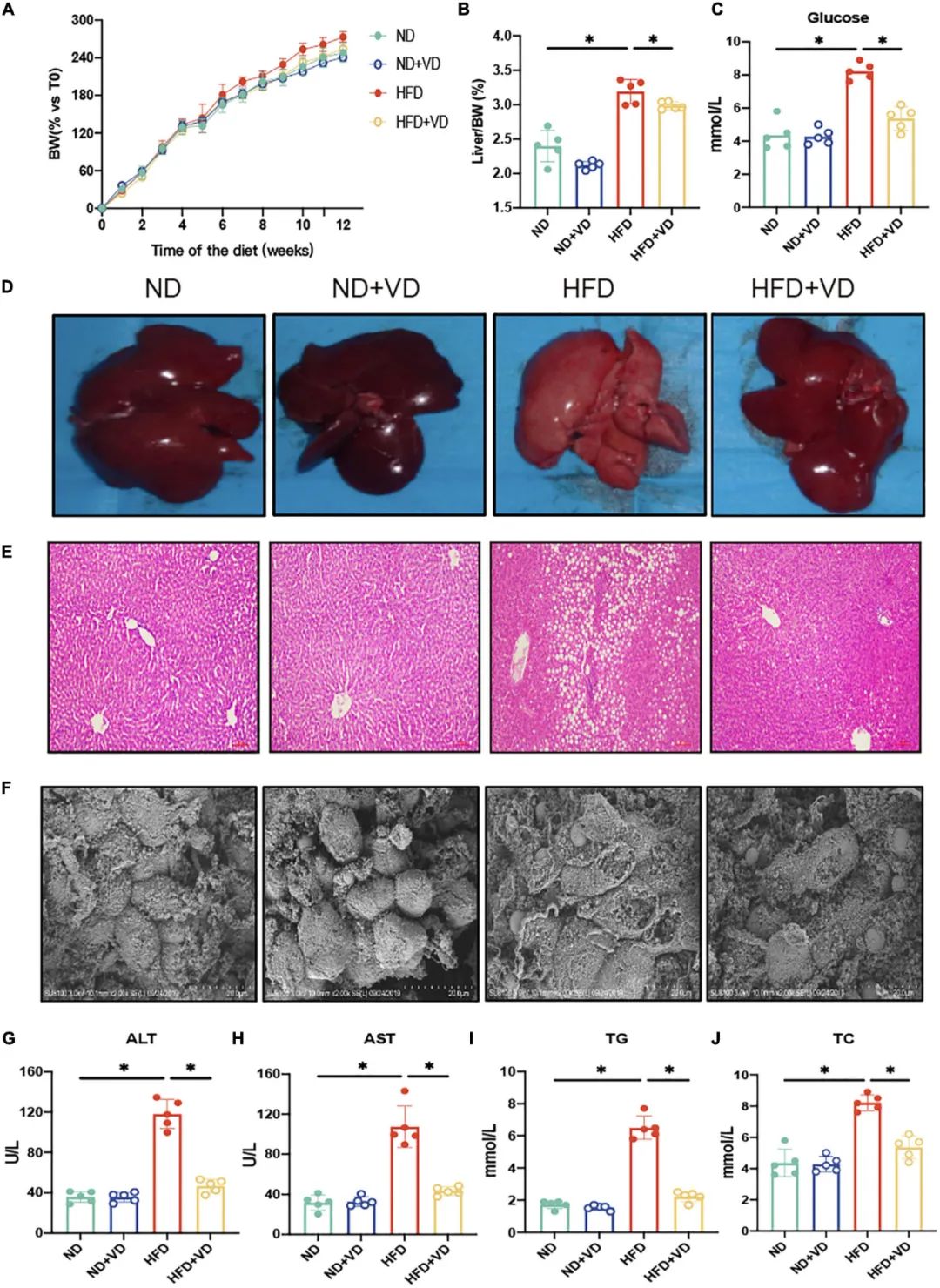
图1 补充维生素D(VD)可缓解高脂饮食(HFD)引起的非酒精性脂肪肝。(A)在12周内每周测量喂食指定饮食的雄性大鼠的体重(BW),并表示为与初始体重的百分比。数据为平均值±SEM(n = 5)。(B,C)四组大鼠的肝脏指数和空腹血糖值。(D-F)四组大鼠代表性的肝脏形态,苏木精-伊红(H&E)染色的肝脏切片,以及电子显微镜下的肝脏图片。(G-J)四组大鼠的血浆谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆固醇(TC)和总甘油三酯(TG)水平。* P<0.05,采用ANOVA分析,然后进行Tukey的多重比较检验。
2. 基于16S rRNA基因的非酒精性脂肪肝大鼠VD治疗后的肠道菌群变化
如图2A所示,HFD+VD组与ND组共有的OTU(2787=1721+155+749+162)多于HFD+VD组和HFD组共有的OTU(2212=1721+155+241+95)。此外,与ND组相比,HFD组的chao 1指数显著降低(图2B),但在VD给药后的大鼠中chao 1指数升高。作者还发现VD干预可显著降低由HFD诱导的厚壁菌门/拟杆菌门的比值(图2C)。此外,PCoA分析显示4组大鼠肠道菌群组成明显不同(图2D),HFD+VD组和ND组大鼠之间的距离比HFD+VD组和HFD组大鼠之间的距离更近(图2D)。巴氏杆菌属和紫单胞菌科(未分类属)与α多样性呈正相关(图2E)。Spearman相关性分析表明α多样性与梭菌属、Odoribacter和颤杆菌属之间呈负相关(图2E)。与喂食HFD的大鼠相比,VD给药增加了拟杆菌门的丰度(图2F)。与HFD组相比,在HFD+VD组大鼠中也观察到厚壁菌门减少(图2F)。在属水平上,补充VD逆转了紫单胞菌科(未分类属)和普雷沃氏菌属丰度的降低,这两种菌仅在HFD组中丰度降低(图2G)。即使喂养HFD,补充VD也可提高乳杆菌属的丰度(图2G)。

图2 维生素D(VD)治疗后粪便菌群的改变。(A)四组中观察到的共同和差异的分类操作单位(OTU)。(B)各组之间的α多样性差异。(C)四组样本中的厚壁菌门/拟杆菌门比值的比较。(D)主坐标分析(PCoA)显示四组肠道菌群的明显差异。(E)α多样性和差异肠道菌群之间的相关性。(F,G)堆叠条形图描述了门水平(左)和属水平(右)肠道细菌的百分比。*P<0.05,**P<0.01。Kruskal-Wallis检验与事后Dunn检验。
3. VD干预非酒精性脂肪肝病大鼠肠道菌群的特异性变化
接下来,作者比较了VD治疗后大鼠肠道菌群种水平的变化。如图3A所示,HFD喂养显著增加了粘螺菌、Acetatifactor、脱硫弧菌、颤螺菌、Clostridium_XlVb、Eisenbergiella、Odoribacter和Robinsoniella菌的丰度,但上述细菌的丰度在VD处理后均下调。然而,VD的补充逆转了由HFD诱导的紫单胞菌科(未分类)、普雷沃氏菌、拟普雷沃氏菌和巴氏杆菌比例的降低(图3B).
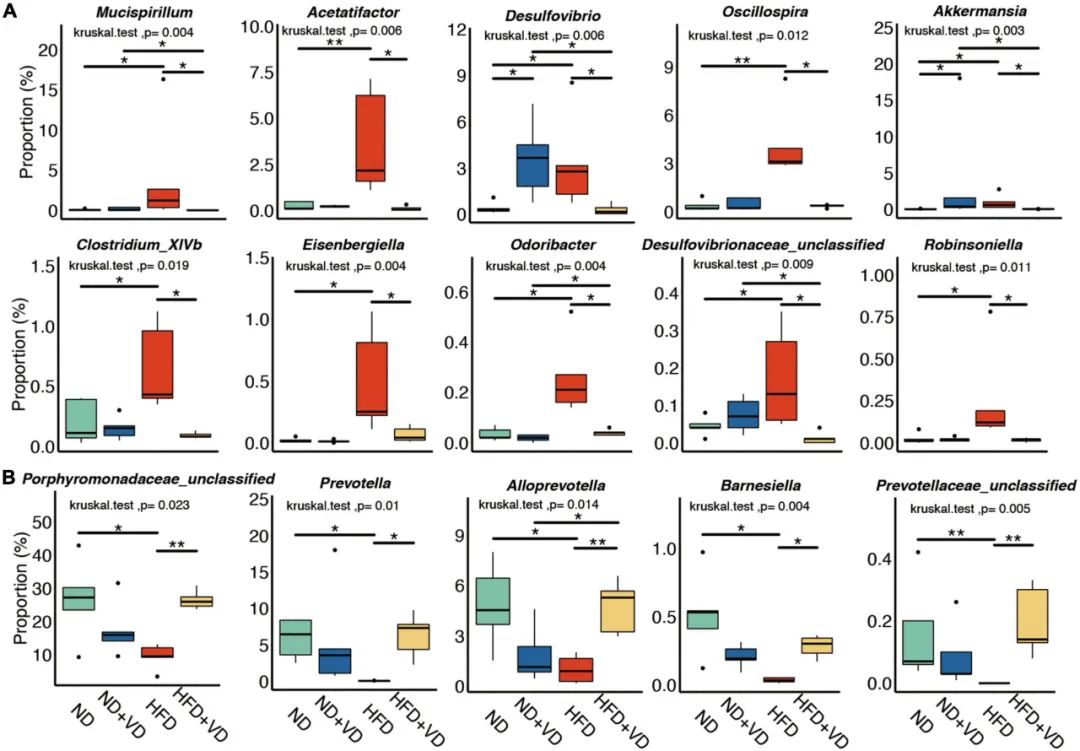
图3 维生素D(VD)干预后改变的菌群。(A,B)四组大鼠的肠道微生物组发生了明显的变化。*P<0.05,**P<0.01。Kruskal-Wallis检验与事后Dunn检验。
4. VD改变了微生物的功能和代谢途径
此外,肠道微生物群功能预测分析显示,不同组大鼠的肠道微生物代谢途径发生了明显的变化。如图4A所示,除了HFD组与ND组和之间共有的25条通路外,HFD+VD组相对于HFD组单独改变了56条代谢通路。具体而言,亚油酸代谢、醚脂代谢和鞘脂代谢途径在两项比较(HFD+VD/HFD和HFD/ND)中均得到富集(图4B),而组氨酸代谢和核黄素代谢分别在两项比较中单独发生了变化(图4B)。VD给药后属于脂质代谢的花生四烯酸代谢、亚油酸代谢、醚脂代谢和鞘脂代谢增加(图4C)。补充维生素D可降低氨基酸代谢,包括赖氨酸降解和苯丙氨酸代谢。最后,VD处理后丰度增加的紫单胞菌科(未分类)、普雷沃氏菌、拟普雷沃氏菌和巴氏杆菌与脂质代谢呈正相关,而脂质代谢与粘螺菌、Acetatifactor和脱硫弧菌丰度呈负相关(图4C)。
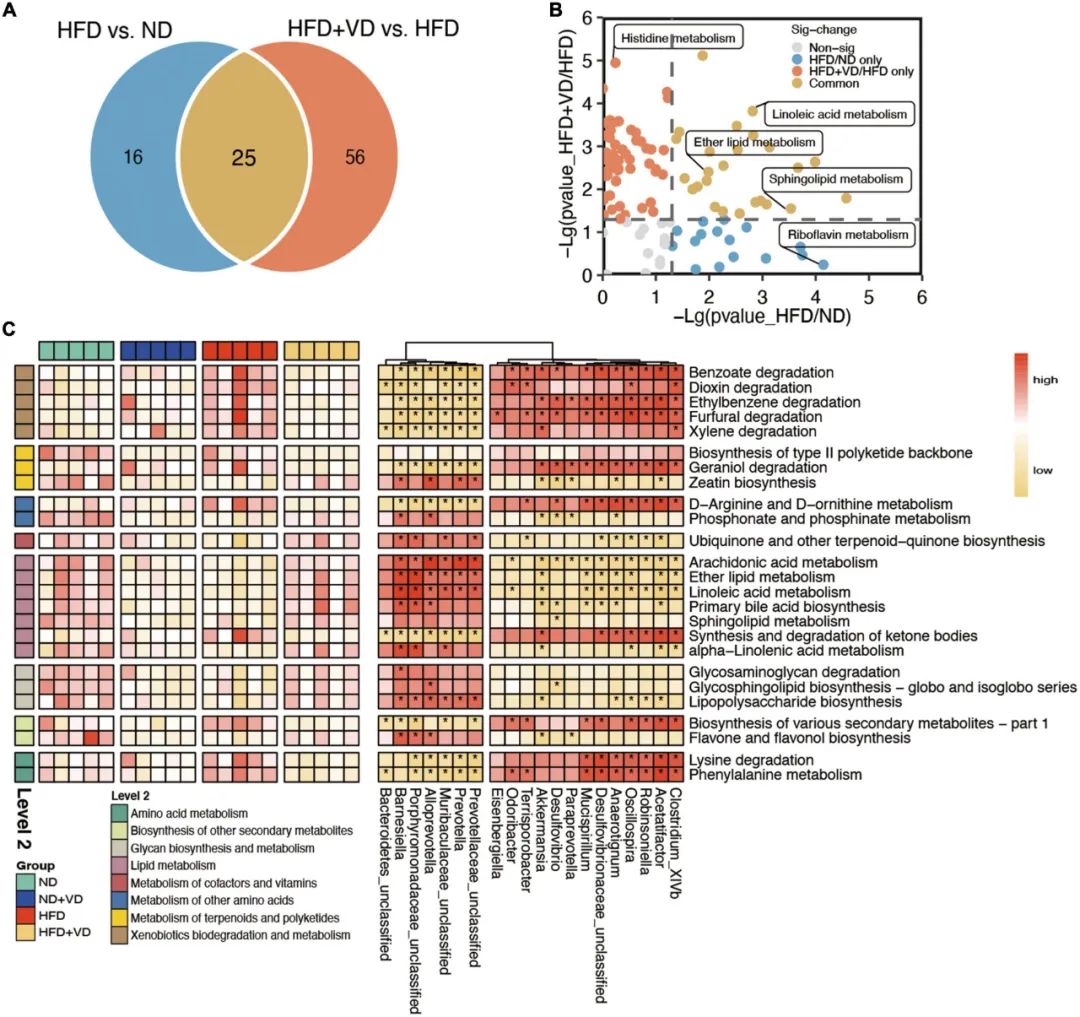
图4 肠道微生物群的特征功能。(A)维恩图说明了高脂肪饮食(HFD)与ND和HFD+VD与HFD之间预测的代谢途径的数量明显改变。(B)HFD与ND之间以及HFD + VD与HFD之间存在明显的区别。(C)肠道菌群功能预测分析以及功能与差异菌群之间的相关性。红色表示正相关。黄色表示负相关。*P<0.01。
5. 代谢组学显示VD摄入改变了特定的代谢途径
作者通过全局代谢组学分析血浆样本,发现VD治疗后1098(上升)和1474(下降)个代谢物发生显著变化(图5A)。如图5B所示,VD治疗后L-缬氨酸、L-亮氨酸和L-异亮氨酸显著降低。此外,HFD+VD组的鞘氨醇、L-丝氨酸和二氢鞘氨醇水平降低,3-脱氢二氢鞘氨醇、维生素D3、L-精氨酸和多巴胺水平升高。代谢组学分析显示,变化的代谢物主要富集在氨基酸、肽、苯甲酸、单糖、胺和吲哚中(图5C)。变化的代谢产物见补充表1。此外,KEGG通路富集分析表明补充VD后酪氨酸代谢、色氨酸代谢、精氨酸生物合成、缬氨酸、亮氨酸和异亮氨酸生物合成以及鞘脂代谢途径发生显著改变(图5D)。
通路分析显示,VD处理增加了色氨酸的代谢能力,这可能导致更多的色胺、血清素和褪黑激素的产生(图6A),在HFD+VD组中还观察到酪氨酸代谢能力增强(图6B)。此外,VD干预分别诱导谷氨酸盐和L-精氨琥珀酸盐合成N-乙酰谷氨酸盐和精氨酸(图6C)。
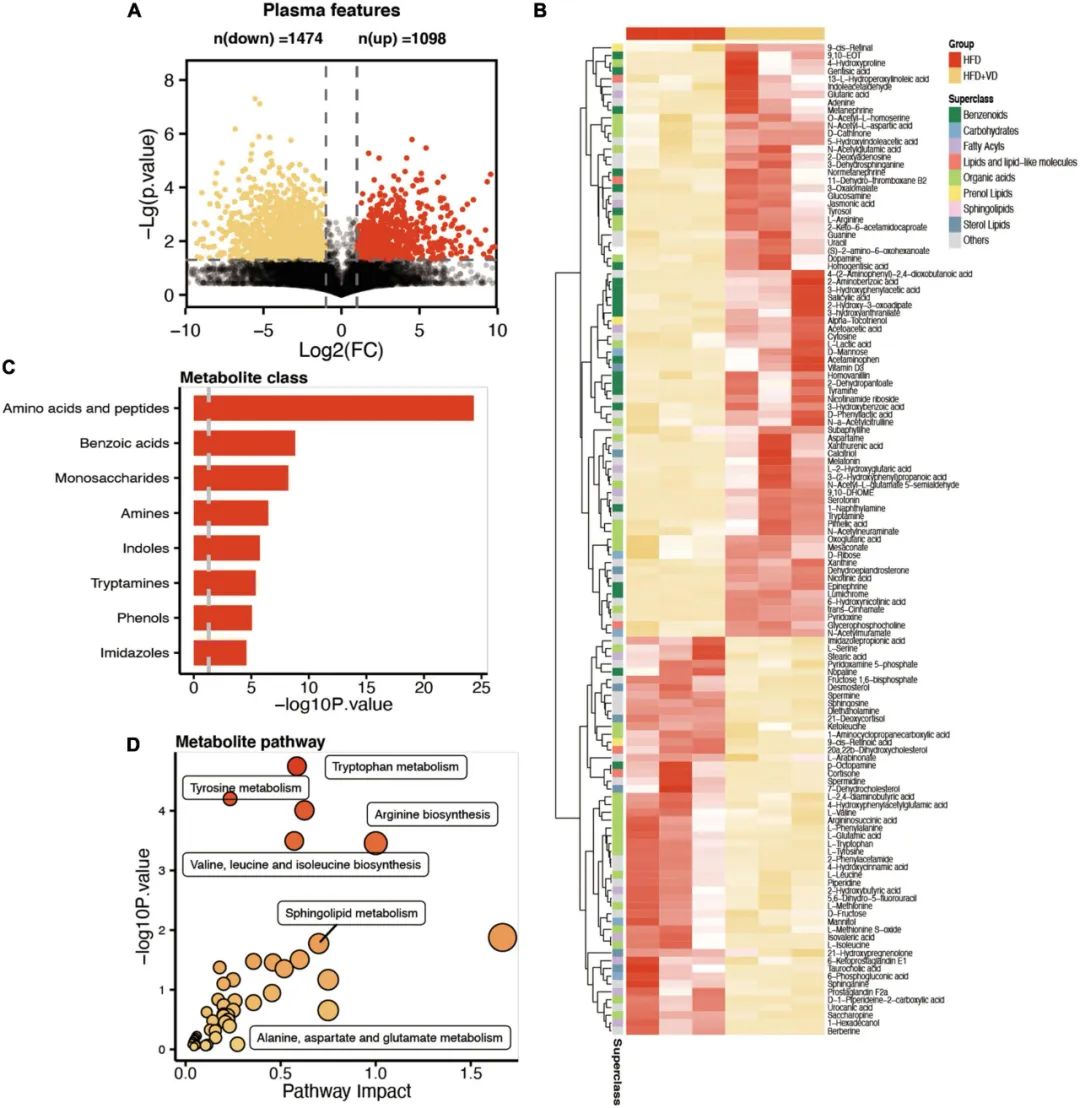
图5 代谢组学分析确定了高脂饮食(HFD)+VD中血浆代谢物与HFD组的差异。(A)火山图显示了两组之间代谢物改变的数量。(B)热图显示了血浆代谢物中被注释的差异代谢物。(C,D)基于差异代谢物的代谢组学和通路富集。

图6 通路分析。(A-C)色氨酸代谢、酪氨酸代谢和精氨酸生物合成途径中代谢物变化的示例。
6. 肠道菌群和代谢组学的综合分析
为了进一步探索VD对肠道菌群和血浆代谢物的潜在影响,作者进行Spearman分析以将差异代谢物和肠道菌群联系起来。如图7A所示,VD给药后下调的L-色氨酸、L-酪氨酸、L-谷氨酸、L-苯丙氨酸、L-异亮氨酸、L-亮氨酸、L-缬氨酸和鞘氨醇与Clostridium_XlVb、Paraprevotella和粘螺菌呈正相关,这些菌在HFD+VD组中的水平较低。普雷沃氏菌、普雷沃氏菌科(未分类)、拟普雷沃氏菌与多巴胺、L-精氨酸、吲哚乙醛和3-脱氢二氢鞘氨醇相关。此外,粘螺菌、脱硫弧菌和Akkermansia muciniphila与4-羟脯氨酸和酪胺负相关。HFD组中富集的顫螺菌属、Robinsoniella和Acetatifactor与VD治疗后上调的2-氨基苯甲酸、肾上腺素、色胺、血清素和褪黑素呈负相关。对显着变化通路的综合分析表明,鞘脂代谢与微生物组和代谢物重叠(图7B)。作者还采用Mantel检验和Spearman分析将属于鞘脂代谢的代谢物与改变的肠道菌群相关联(图7C、D)。结果发现富含普雷沃氏菌和拟普雷沃氏菌的HFD+VD组大鼠与Acetatifactor、颤螺菌和脱硫弧菌呈负相关,同时与3-脱氢二氢鞘氨醇具有强正相关。即使VD处理诱导了3-脱氢二氢鞘氨醇直接从L-丝氨酸和棕榈酰-CoA合成,但HFD+VD组中随后产生二氢鞘氨醇和鞘氨醇的代谢也被下调(图7E)。

图7 微生物组和代谢物之间的综合分析。(A)差异菌群和代谢物之间的Spearman相关性分析。+和-分别表示显著的正相关和负相关。(B)肠道菌群功能分析中具有显著差异的 KEGG 通路维恩图和基于代谢物的代谢通路。(C,D)Mantel检验和参与其代谢的微生物途径中富集的代谢物的交互网络图。红色表示显著上调的代谢物或微生物,而黄色表示显著下调的代谢物或微生物。红线和黄线分别表示正相关和负相关。(E)鞘脂代谢途径中代谢物变化的示例。
讨论
众所周知,非酒精性脂肪肝的高发病率正在成为全球范围内的一个主要健康问题。更重要的是,新的证据表明,肠道微生物群参与了非酒精性脂肪肝的进展。VD作为一种必需的营养素,有利于骨骼生长。此外,低血清VD水平会增加多种疾病的风险,包括肥胖、糖尿病和自身免疫性疾病。然而,迄今为止,对VD和NAFLD之间的相关性的研究有限。作者先前的研究集中在VD对肝脏损伤、脂质积累、NLRP3炎症小体的激活和细胞焦亡的影响。在这项研究中,作者进一步研究了VD通过调节肠道菌群和代谢对非酒精性脂肪肝的有益影响。研究结果表明,补充VD可以改善HFD引起的肝功能异常,并通过调节肠道菌群逆转肝脂肪变性。
VD处理显着降低了F/B比(卡路里吸收能力的指标)。HFD+VD组中肠道菌群的Chao1指数增加表明,VD处理可以恢复HFD诱导的微生物物种多样性的降低。拟杆菌门(通常在NAFLD患者中减少),在HFD组中降低,但可以通过补充VD逆转。在属水平上,乳杆菌属可以通过调节小鼠肠道微生物组来改善NAFLD的进展,作者发现VD治疗后也诱导了乳杆菌属丰度的增加。在大鼠中也观察到了类似结果,VD可通过增加乳杆菌属的相对丰度和降低Acetatifactor、颤螺杆菌和Flavonifractor的相对丰度来恢复HFD诱导的肠道微生物群失调。此外,已经被鉴定为具有健康益处的产丁酸的紫单胞菌科和瘤胃球菌科的丰度在补充VD的HFD大鼠中增加。普雷沃式菌与NAFLD严重程度呈负相关,其在VD干预后增加。粘螺菌属、脱硫弧菌属和脱硫弧菌科在高脂/高胆固醇诱导的NAFLD小鼠中富集,而在补充VD后降低。醋酸杆菌的水平在HFD+VD组中降低,醋酸杆菌的水平增加可能会引起肠道功能障碍。肠道菌群功能分析表明,VD处理显著提高了肠道菌群亚油酸代谢能力。与本研究的发现一致,Miyamoto等人报道HFD可通过改变肠道微生物群抑制亚油酸代谢。综上所述,本研究结果表明,VD可以基于肠道微生物群的恢复来缓解NAFLD。
代谢组学分析显示VD治疗改善了代谢紊乱。患有代谢综合征的患者肠道微生物将色氨酸代谢成衍生物的能力降低。然而,本研究发现VD处理后色氨酸代谢增强。在HFD+VD组大鼠中观察到较高水平的色氨酸衍生物,如色胺、血清素、邻氨基苯甲酸盐和褪黑素。其它研究已经表明色胺是依赖于微生物群的代谢物,并且在HFD中减少。最近的研究还揭示血清素和褪黑激素可分别调节食欲和预防脂肪肝。此外,先前的一项研究表明酪氨酸水平与NAFLD的存在正相关。酪氨酸水平的降低和其衍生物水平的升高表明VD治疗具有促进酪氨酸代谢的能力。另一项研究发现,接受减肥干预的患者体内的微生物从酪氨酸产生酪胺的能力更高。肠道微生物群衍生的多巴胺也可以调节进食。此外,肾上腺素、去甲肾上腺素的增加和盲肠微生物群的变化可诱导脂肪组织的能量代谢。其他研究表明Akkermansia muciniphila通过特异性调节乙酰乙酸盐有益于代谢综合征。已经证明较高水平的谷氨酸盐会增加肥胖症和代谢综合征的风险并促进肝糖异生。然而,VD处理不仅抑制2-酮戊二酸合成谷氨酸,而且促进其代谢产生N-乙酰谷氨酸。Alexander等人发现摄入精氨酸可以预防小鼠的肠道炎症。精氨酸代谢是一种潜在的免疫调节途径,由长双歧杆菌和Akkermansia muciniphila介导。然而,补充VD促进了L-精氨酰琥珀酸合成精氨酸。因此,这些结果表明VD治疗不仅可以逆转肠道菌群紊乱,而且可以恢复代谢失调。
肠道菌群和代谢组学的综合分析还显示色氨酸、酪氨酸、谷氨酸、苯丙氨酸、支链氨基酸、二氢鞘氨醇、亚精胺和粘螺菌属之间呈正相关,表明HFD大鼠中这些代谢物水平升高可能是由于粘螺菌属丰度增加。越来越多的研究表明肠道微生物来源的鞘脂可调节肝脏代谢。Johnson等人报道鞘脂由拟杆菌(Bacteroidetes)产生,拟杆菌门是肠道微生物群的优势菌。本研究结果表明,3-脱氢二氢鞘氨醇与拟杆菌门下的普雷沃氏菌呈正相关。据报道,细菌鞘脂合成途径在普雷沃氏菌属中是常见的。本研究发现,VD处理后普雷沃氏菌丰度的增加可能促进了丝氨酸合成3-脱氢二氢鞘氨醇。鞘氨醇可调节肠道免疫细胞,保护肠道免受感染;然而,鞘氨醇也在NAFLD患者中富集。在本研究中,鞘氨醇与颤螺菌属呈正相关,表明VD治疗后颤螺菌属的下降可能促进鞘氨醇的合成。但普雷沃氏菌和颤螺菌是否影响3-脱氢二氢鞘氨醇和鞘氨醇的合成还需进一步研究。本研究有一些局限性。首先,维生素D在肥胖中的作用在男性和女性之间是不同的,本研究仅揭示了VD对NAFLD肠道菌群和代谢的影响,没有性别依赖性的方式。本研究的第二个局限性与检测到的代谢物数量有关,可通过使用高分辨率质谱法进一步改进,该质谱法可准确区分异构体代谢物,尤其是脂质及其衍生物。尽管本研究的目的是基于肠道微生物群和代谢组学揭示先前未知的补充VD的功能特征,为NAFLD预防和治疗提供依据,但它是一项描述性的研究,针对组学分析所表明的假设之一,如将补充维生素D大鼠的粪菌移植给非酒精性脂肪肝大鼠或无菌动物模型验证,还需要进一步研究。
结论
补充VD可减轻HFD引起的肝脏脂质蓄积。本研究对大鼠肠道菌群和血浆代谢物的分析揭示了补充VD在恢复肠道微生物群和代谢失调中的作用。补充VD可诱导普雷沃氏菌的丰度增加,并与血清素、褪黑素、色胺、L-精氨酸、3-脱氢二氢鞘氨醇含量呈正相关。维生素D对粘螺菌属的抑制作用与血浆色氨酸、酪氨酸、谷氨酸、苯丙氨酸、支链氨基酸、鞘氨醇和亚精胺含量呈正相关,表明维生素D通过抑制粘螺菌属的增殖,促进色氨酸代谢、酪氨酸代谢和精氨酸生物合成。此外,补充VD可促进肠道菌群功能和代谢途径中的鞘脂代谢。本研究对VD、肠道微生物群和代谢失调之间的关系进行了全面的分析,结果表明补充VD可能是一种针对特定微生物群的治疗NAFLD的潜在干预措施。
原文链接: https://pubmed.ncbi.nlm.nih.gov/36819064/
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











学习了
98
有收获,谢谢分享
103