Nature:水可载舟亦可覆舟!癌细胞脱颖而出的秘密,全因这个“健康指纹”!
2019-07-25 Ruthy 转化医学网
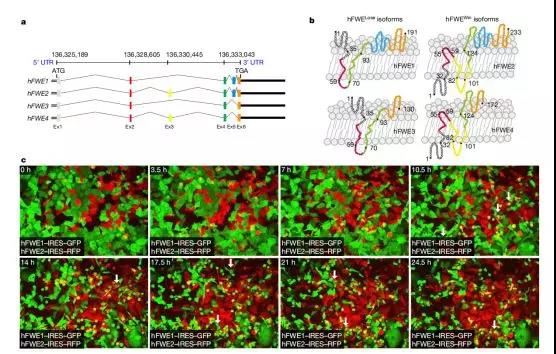
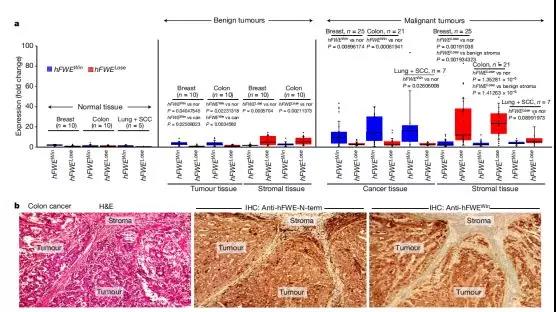
癌细胞研究已成为生物医学中探索癌变机理及肿瘤生成规律的一个活跃领域。癌细胞与正常细胞本是同根生,却有着截然不同的命运和功能差异。癌细胞源自正常细胞,多种变异给予了癌细胞超强的竞争力,致使癌细胞团体日益壮大,导致癌症发生发展转移,最终引发患者死亡。但这份超强的竞争力如何形成至今仍众说纷纭。

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言




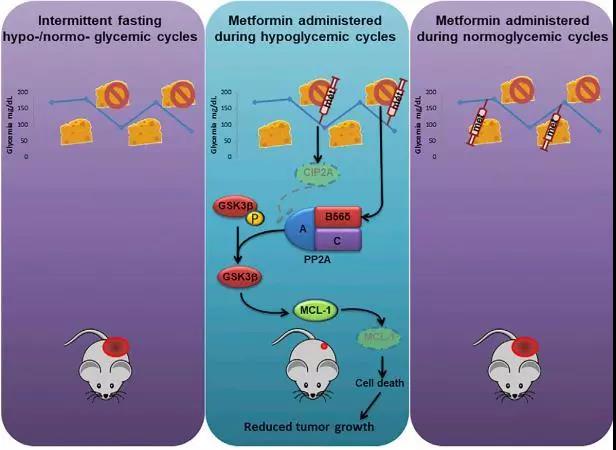





#Nat#
66
#指纹#
75
#癌细胞#
75