【BCJ】伴1q gain/amp MM患者自体移植的结局:MD安德森经验
2024-01-20 聊聊血液 聊聊血液 发表于陕西省
MD安德森癌症中心Muzaffar H. Qazilbash教授牵头一项研究213例1q+ NDMM患者结局的真实世界研究,近日发表于《Blood Cancer Journal》。
1q+与MM患者自体移植的结局
1号染色体长臂(1q+)的额外拷贝是初治多发性骨髓瘤(NDMM)患者最常见的细胞遗传学异常之一(20%~50%),且随着疾病从冒烟型进展到复发/难治性疾病,1q+的频率也会增加。1q+又可分为1q gain (3个拷贝)和1q amplification (简称amp,≥4个拷贝) ,其不良预后在新药时代仍然存在。一些研究提示,amp患者的预后比gain患者差,但报告相互矛盾。
大剂量巩固治疗联合自体干细胞移植(autoSCT)是目前MM患者(包括高危细胞遗传学患者)的标准治疗,多项研究评估了1q+ MM患者接受auto SCT的结局,但1q gain和amp之间的结果相互矛盾。因此MD安德森癌症中心Muzaffar H. Qazilbash教授牵头一项研究213例1q+ NDMM患者结局的真实世界研究,近日发表于《Blood Cancer Journal》,该研究也是当代接受诱导治疗和一线autoSCT最大样本的1q+ NDMM患者队列。

研究结果
患者、疾病和治疗特征
该研究为单中心回顾性研究, 纳入接受autoSCT的1q+ NDMM患者共213例。患者中位年龄62.5岁,男性占53%(113例)。大多数患者(n=114, 54%)为R-ISS II期,而I期和III期患者分别为40例(19%)和22例(10%)。最常用的诱导方案为硼替佐米+来那度胺+地塞米松(VRD)(88例,41%),预处理方案最常用的为美法仑(165例,77%)。169例(79%)患者有1个额外1q+拷贝,18例(8%)和26例(12%)患者分别有2个或>2个额外1q +拷贝。31例(15%)患者共存del(17p)、30 (14%)共存t(4;14)、13 (6%) 共存t(14;16),作为额外高危细胞遗传学异常。182例(85%)患者接受移植后维持治疗,大多数患者接受来那度胺单药治疗或来那度胺联合地塞米松(58%)。整个队列的患者特征和1q拷贝数见表1。与携带3个1q拷贝的患者相比,携带>3个拷贝的患者多为女性(43% vs. 61%, p=0.041)且R-ISS (p=0.032)和R2-ISS (p=0.024)分期较高。
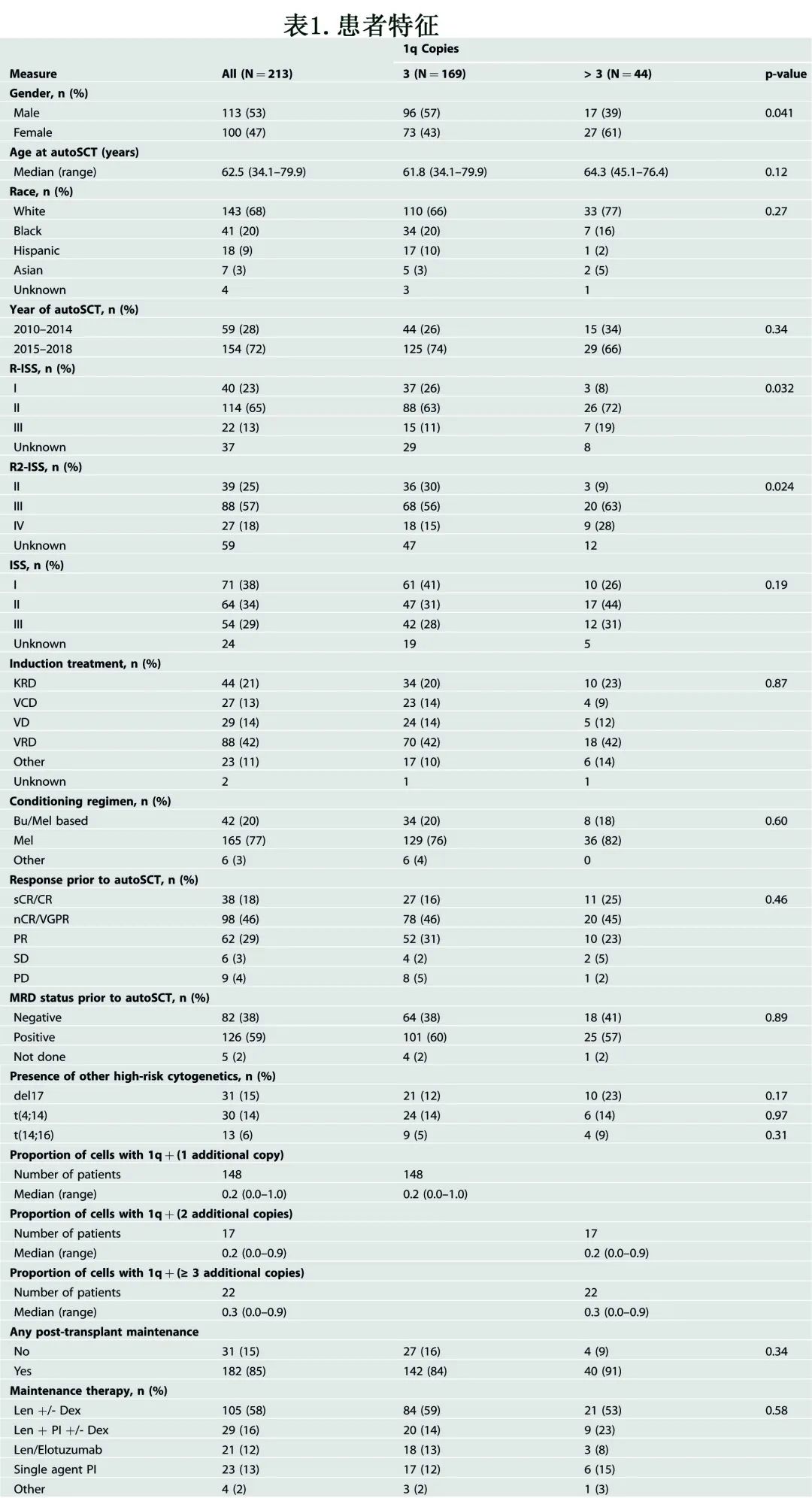
缓解和MRD结局
完成诱导治疗后和移植前,分别有38例(18%)和136例(64%)患者达到≥CR或≥VGPR, 69例(32%)达到MRD阴性≥VGPR。autoSCT后分别有78%和87%的患者在第100日和最佳缓解为≥VGPR,autoSCT后分别有分别有38%和50%的患者在第100日时和最佳缓解达到MRD阴性≥VGPR。根据1q+的额外拷贝数,移植前和移植后的血液学反应如图1所示。
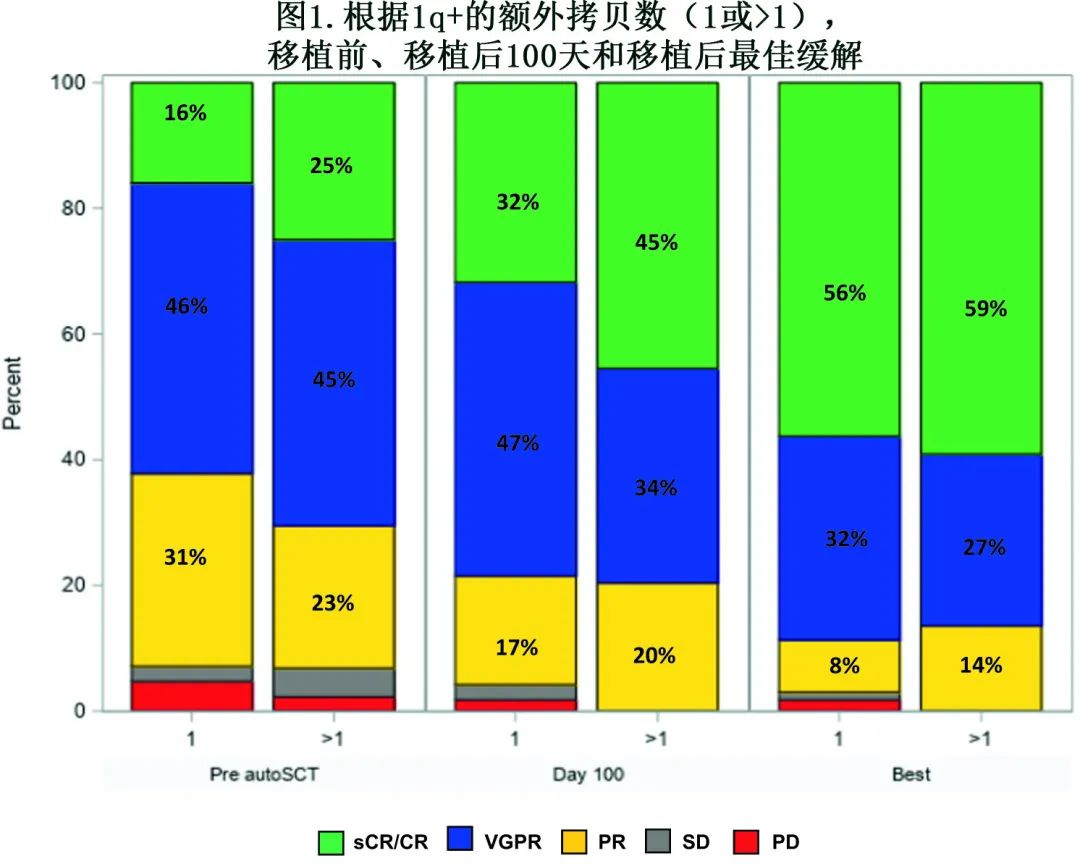
生存结局
全组患者中位随访41.1个月,生存患者的中位随访时间为43.9个月。全组患者的中位PFS和OS分别为35.5个月和81.4个月(图2)。
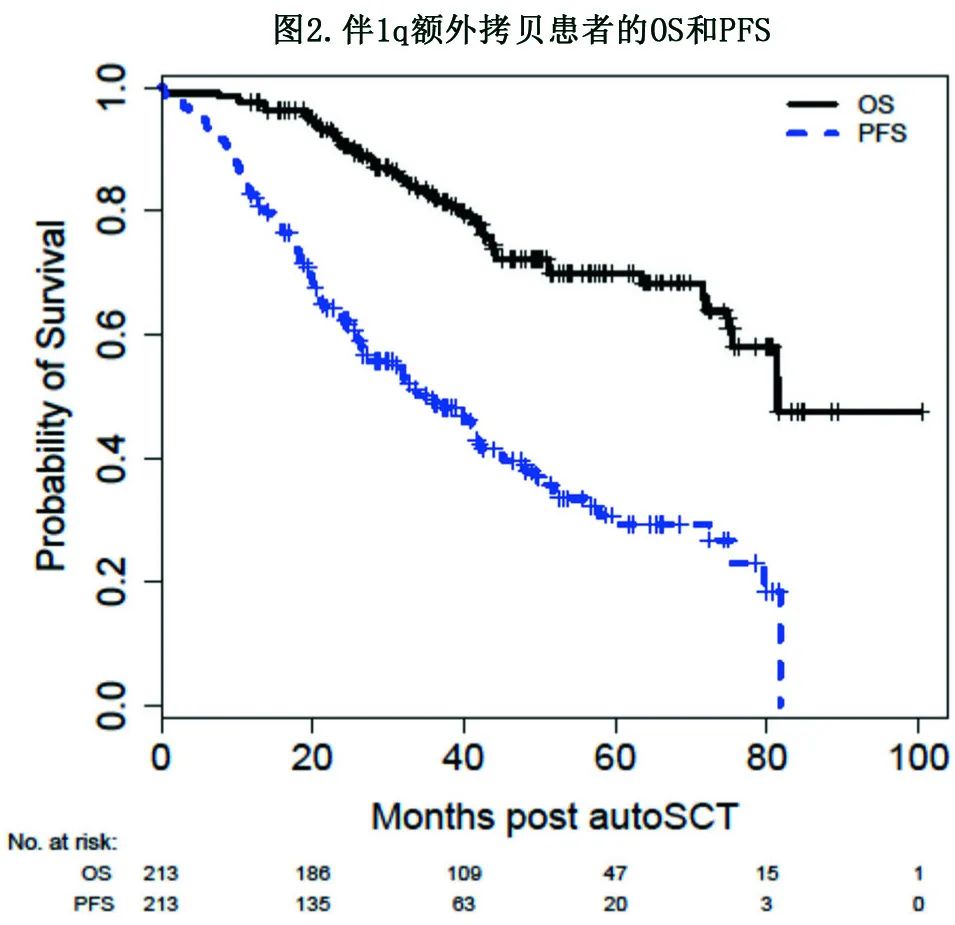
在PFS的单变量分析中,达到MRD阴性≥VGPR状态与较好的PFS相关,包括在autoSCT前(HR=0.49;p<0.001)和autoSCT后100天 (HR=0.59;p=0.007)达到。移植后来那度胺维持治疗也与PFS改善相关(HR=0.56;p=0.003)。存在>1个额外1q+拷贝与较差的PFS相关(HR=2.03;p<0.001,图3A),且在携带>2个额外1q+拷贝的患者中情况更差(HR=2.66;p<0.001,图3B)。
在PFS的多变量评估中,移植前MRD阴性≥VGPR (HR=0.52;p=0.013)与较好的预后相关,而1q amplification与较差的PFS相关(HR=2.03;p=0.003)(表2)。
在OS的单变量分析中,autoSCT前MRD阴性≥VGPR状态(HR=0.51;p=0.046)、autoSCT后100天MRD阴性≥VGPR状态(HR=0.43;P=0.006)和移植后最佳缓解MRD阴性≥VGPR状态(HR=0.49;p=0.013)以及使用来那度胺为基础维持治疗(HR=0.45;p=0.019)均与较好的OS相关,而较高的R-ISS分期(II期的HR=3.79;p=0.028,III期的HR=5.95;p=0.008,相对于I期)、存在>1个额外1q+拷贝(HR=1.90;P=0.028)及共存del17p (HR=2.19;p=0.014)与较差的OS相关。
在OS的多变量分析中,达到移植后MRD阴性≥VGPR的最佳缓解与较好的生存相关(HR=0.29;p<0.001),而R-ISS分期III期与较差的OS相关(HR=6.95;p=0.030)(表3)。
值得注意的是,无论是作为连续变量进行评估,还是作为分类变量(使用30%或50%的阈值进行评估),1q+细胞百分比均与PFS或OS无关。
共存细胞遗传学异常的影响
共存del17p与较差的OS相关,包括单变量分析中(HR=2.19;p=0.014)和多变量分析中 (HR=2.33;P=0.023)。单变量分析中共存t(4:14)与较差的OS无关(HR=1.56;p=0.27),但多变量分析中可预测OS较差(HR=3.00;p=0.047,表3)。其他高危细胞遗传学异常均无法预测PFS。
总结
该回顾性研究是当代接受诱导治疗和一线autoSCT最大样本的1q+ NDMM患者队列,纳入接受autoSCT的1q21 gain/amplification (分别为3个或≥4个拷贝)NDMM患者共213例 (包括79% 1q gain;21% 1q amplification)。最常用的诱导方案为硼替佐米、来那度胺和地塞米松(41%)。在auto-SCT后第100天和移植后最佳缓解时,分别有78%和87%的患者达到≥VGPR, 38%和50%的患者达到MRD阴性≥VGPR。全组患者的中位PFS和OS分别为35.5个月和81.4个月。在PFS的多变量分析中,autoSCT前MRD阴性≥VGPR与较好的PFS相关(HR=0.52,p=0.013),而1q amplification与较差的PFS相关(HR=2.03,p=0.003)。在OS的多变量分析中,移植后达到MRD阴性≥VGPR与较好的OS相关(HR=0.29,p<0.001),而R-ISS III期和共存del17p或t(4:14)与较差的OS相关(分别为HR=6.95,p=0.030; HR=2.33, p=0.023和HR=3.00,p=0.047)。
该研究再次证实1q+是MM患者的不良细胞遗传学异常,尽管一线使用了新药、auto-SCT和移植后维持治疗,但患者的生存结局差于标危患者;但与其他高危细胞遗传学异常患者相比,1q+患者的预后可能更好。此外与1q gain患者相比,1q amplification患者PFS更差。近期研发的CAR-T和双特异性T细胞衔接器应在有高危细胞遗传学(包括1q+和特别是1qamplification)的患者中进行探索,这些患者可能从病程早期联合使用这些药物中获益。
参考文献
Pasvolsky O,et al. Outcomes of patients with multiple myeloma and 1q gain/ amplification receiving autologous hematopoietic stem cell transplant: the MD Anderson cancer center experience.Blood Cancer J . 2024 Jan 10;14(1):4. doi: 10.1038/s41408-023-00973-w.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#自体移植# #gain/amp#
106