降糖和减重的背后,竟与8项诺奖密切相关!
2024-09-22 医学新视点 医学新视点 发表于上海
胰高糖素样肽 - 1 受体激动剂受广泛关注,回顾其发展历程,包括肠促胰素发现、作用机制及临床应用现状,无论是否获诺奖都具重大意义。
近年来,胰高糖素样肽-1受体激动剂(GLP-1RA)获得了广泛关注,以其为代表的新型治疗药物能同时抑制胰高糖素(GCG)分泌、刺激胰岛素分泌,发挥降糖、减重、降压、调脂等作用,极大地影响和推动了糖尿病、肥胖、心血管代谢疾病等的临床诊疗进展。当前,GLP-1RA及其他肠促胰素开始逐步进入长效化、多适应证、注射制剂与口服制剂并驾齐驱的高速发展期,据公开资料,相关临床研究多达500多项。
鉴于GLP-1RA在多个疾病领域取得的重磅突破,GLP疗法近年来接连斩获2023盖伦奖(Prix Galien USA Awards)、获选为2023年度科学突破,刚刚出炉的2024拉斯克奖(The Lasker Awards)也授予GLP-1类疗法领域的开创性贡献的科学家。
自人类认识胰腺激素到GLP开发的一个世纪里,与GLP相关的科学发现已有8项诺奖。2024年诺贝尔生理学或医学奖将于10月7日正式公布,在此之前,《医学新视点》与读者朋友们共同回顾GLP-1RA这一备受关注的诺奖候选成果背后的科学突破和临床应用前景。
肠促胰素是如何被发现的?
19世纪下半叶,医学界已经发现胰腺激素与糖尿病密切相关。1923年,Banting和Macleod因揭示了胰岛素的存在而荣获诺奖。然而,在那个时期,人们对于胰岛素的化学结构和本质认识还相当有限。直到1951年至1953年间,科学家Frederick Sanger完成了对牛胰岛素氨基酸序列分析,获得了胰岛素一级结构解析的蛋白质,并因此荣获了1958年的诺奖。10多年后,Dorothy Crowfoot Hodgkin成功利用X射线晶体衍射术解析了牛胰岛素的三维结构,这项技术也让她斩获1964年诺奖。尽管人们对胰岛素已经有了一定认识,但当时仍然无法明确2型糖尿病的具体发生机制,直到1977年,Rosalyn Yalow通过其创设的肽激素放射免疫测定分析技术,证实了2型糖尿病是由身体无法有效利用胰岛素引起的,而非胰岛素的缺乏,因此获得了诺奖。1984年,Bruce Merrifield创立了一种在固体基质上进行化学合成的方法,该方法包括了胰岛素的合成,这让他也荣获了诺奖。
胰腺分泌的激素并不是单一成分,事实上,在胰岛素发现不久后,医学界紧接着就发现胰腺中还有一种激素会升高血糖,在1922年正式将其命名为胰高糖素,并在1957年完成测序。在探索胰高糖素如何通过信号通路发挥作用的过程中,也有三位科学家获得诺奖,其中Christian de Duve教授因发现溶酶体这一重要细胞结构而获得诺贝尔奖,他在早期研究中描述了胰腺中一种高血糖-糖原分解因子(也就是胰高糖素)的特征;Earl Wilbur Sutherland Jr利用胰高糖素发现了环磷酸腺苷(cAMP)在细胞内作为激素的“第二信使”的关键角色;Rodbell教授多年来研究胰高糖素对其受体的调节作用,发现G蛋白及其在细胞信号传导中的作用。
医学科学界开始意识到,胰岛分泌激素并不是孤立工作的。1890年,Mering和Minkowski发现被切除胰腺的狗均患上了糖尿病,他们提出胰腺是导致糖尿病的重要器官,1902年至1922年期间,人们发现肠道激素可以控制胰腺分泌,以及胰腺会产生胰高糖素来对抗胰岛素的降糖作用。于是在1932年,Jean La Barre首次提出肠促胰素的概念,并提出了使用肠促胰素治疗糖尿病的建议。至此,从猜想肠促胰素到提出治疗已过去40多年。
1964年,McIntyre和Elrick发现与静脉注射葡萄糖相比,口服葡萄糖能引起更多的胰岛素分泌,“肠促胰素效应”得到证实,提示肠道可能释放对胰岛分泌具有调节作用的因子。但当时口服葡萄糖仅能刺激已知肠道激素内源性分泌的适当增加,直到1971年,Brown JC率先分离出具有抑制胃酸和胃蛋白酶分泌的作用的抑胃肽。但随后Pederson等人发现抑胃肽是一种葡萄糖依赖性肠促胰素,并将其更名为葡萄糖依赖性促胰岛素释放多肽(GIP),GIP也是最早被发现的肠促胰素。尽管已取得相当大的进展,但科学家们发现,仅通过对GIP的定量分析,并不能完整解释口服葡萄糖后肠道激素对胰岛素分泌的影响。
这个无法很好解释的问题,在80年代后期开始逐渐有了新的答案。得益于此前对胰高糖素的发现,Graeme Bell等人在1983年对哺乳动物胰高糖素基因进行了克隆和测序,cDNA推导的胰高糖素原结果明确提示,除胰高糖素序列外,激素原还含有两种新型胰高糖素样肽的序列,他们将其命名为GLP-1和GLP-2,并证实了GLP-1是由胰高糖素原在肠道剪切而来,GLP-1是第二个被发现可以刺激胰岛素释放的肠促胰素。1987年,Habener和Holst确定GLP-1是胰腺分泌胰岛素的重要调节剂,为进一步探索GLP-1在葡萄糖稳态中的作用奠定了基础,最终促成了基于肠促胰素的2型糖尿病治疗方法的成功研发。1993年,Nauck等人发表的文章指出,GLP-1可抑制胰腺α细胞分泌胰高糖素。1997年,Drucker等发现GLP-2促进肠道黏膜生长的作用强于其他生长因子,且促进生长的作用仅局限于胃肠道,由此GLP-2开始受到人们的关注与深入研究。
在无数前人研究的基础之上,以及众多科学家们的努力和探索下,2005年,全球首个GLP-1RA艾塞那肽获批上市。此后,其他GLP-1RA,如利司那肽、阿必鲁肽、度拉糖肽、司美格鲁肽等陆续获批上市。
肠促胰素及其受体代谢作用广泛
现在我们已经知道,肠促胰素是通过激活相关受体及其下游信号通路来发挥作用的,GIPR和GLP-1R均属于G蛋白偶联受体家族成员,在人体内广泛分布,在胰岛、中枢神经系统等靶器官也均有表达。胰高糖素受体在胰岛β和α细胞上表达,与肠促胰素受体具有相当大的氨基酸同源性。
-
肠促胰素对糖代谢的调节:GIP和GLP-1的作用均存在葡萄糖浓度依赖,因此若机体处于血糖正常或低血糖浓度状态时,GIP和GLP-1不会刺激胰岛素分泌,也就不会引起严重低血糖反应。高血糖状态下,GIP对胰高糖素分泌无显著影响,而GLP-1可通过两条间接通路降低胰高糖素分泌。
-
肠促胰素对脂代谢的调节:GIP可以实现对脂质代谢的直接调控。肥胖时,皮下脂肪组织GIP受体水平下调,表现出对血糖和脂肪调控功能的下降。GLP-1则通过对胰岛素分泌的调节可以间接影响体内的脂质代谢过程,改善脂肪组织的胰岛素敏感性,影响游离脂肪酸水平。
-
肠促胰素对机体的其他调节:肠促胰素在心脏、血管和骨骼方面也表现出一定的调节作用。
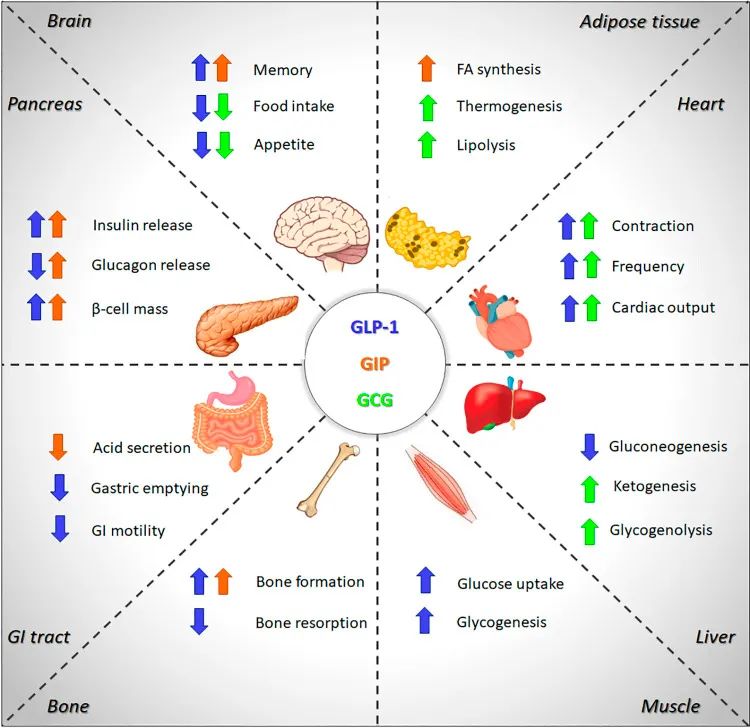
▲GIP、GLP-1和胰高糖素的多器官效应(图片来源:参考文献[1])
肠促胰素临床应用现状
肠促胰素主要有胰腺内效应和胰腺外效应两大类,与对应受体结合后发挥生物学功能。其受体分布在重要的能量调节相关的组织器官,通过协同或互补作用,从摄入、存储和代谢等方面实现对能量代谢平衡的多维度调控。研究发现,在糖尿病患者中,GLP-1的功能效应比GIP更稳定,因此尽管GIP的发现早于GLP-1,但早期肠促胰素药物研发更集中于GLP-1。
GLP-1RA
利拉鲁肽
2014年,美国FDA批准皮下注射的利拉鲁肽可用于治疗肥胖,但需要每日用药,而后相继获批用于治疗10岁以上的2型糖尿病患者和青少年肥胖。
司美格鲁肽
2019年,司美格鲁肽口服片剂获美国FDA批准适应证为治疗2型糖尿病,而后获批用于治疗肥胖。
Danuglipron
Danuglipron是一种在研小分子GLP-1受体激动剂,与大分子GLP-1类似物不同的是,它的服用更为简便,且不受食物或者服用时间的限制。JAMA Network Open发表的“首个口服小分子GLP-1受体激动剂的2期临床数据”结果显示,所有danuglipron剂量组(每日2次)2型糖尿病患者第16周时的糖化血红蛋白(HbA1c)和空腹血糖(FPG)水平均较基线时显著更低。
GIP/GLP-1双重受体激动剂和GIP/胰高糖素双重受体激动剂
鉴于肠促胰素的多器官效应,双重受体激动剂和三重受体激动剂在减重、降糖及其他代谢疾病风险方面也起到了重要作用。其中,GIP和GLP-1双重受体激动剂可调节胰岛素分泌,在中枢神经和外周神经中发挥作用,从而降低患者食欲,激发饱腹感,使糖尿病伴有肥胖患者同时控制体重和血糖;GLP-1和胰高糖素双重受体激动剂可诱导消耗能量,增加脂质代谢,降低食欲,可减轻体重,同时实现良好的血糖控制和能量平衡。
目前,GIP/GLP-1双重受体激动剂有替尔泊肽(tirzepatide),周一次皮下注射给药,已获批用于使肥胖或超重成年患者减轻体重并保持体重稳定。GLP-1/胰高糖素受体激动剂注射用药的有survodutide、mazdutide等。
The Lancet Diabetes & Endocrinology报告的survodutide治疗肥胖症2期试验结果表明,在实际治疗期间,每周一次4.8 mg的survodutide可使受试者体重减轻18.7%,这相当于受试者绝对体重减少19.5 kg。发表于NEJM的研究也发现,survodutide在改善MASH且不加重肝纤维化的效果优于安慰剂。
2024年第60届欧洲糖尿病研究协会年会(EASD)公布的mazdutide的GLORY-1试验最新结果显示,治疗第48周时,mazdutide 4 mg组、mazdutide 6 mg组体重较基线分别下降12.05%和14.84%,体重减轻≥5%患者比例分别为73.5%和82.8%。两种剂量的mazdutide可明显改善收缩压、甘油三酯、总胆固醇、低密度脂蛋白胆固醇(LDL-C)、血清尿酸、丙氨酸氨基转移酶水平。此前的研究也显示,在第20周,54.0%~73.5%接受不同剂量mazdutide治疗的受试者达到HbA1c<7.0%的目标。
GIP、GLP-1和胰高糖素三重受体激动剂
GIP、GLP-1和胰高糖素三重受体激动剂则同时结合三种受体作用,对维持代谢平衡相关的多种神经系统产生影响。Retatrutide的出现,开启了三重受体激动剂减重新时代。Retatrutide为注射用药,尚无口服制剂,发表于NEJM的研究结果显示,肥胖患者使用retatrutide治疗48周后,体重减轻>24%,其中使用8 mg、12 mg剂量的患者可100%实现减重5%(具有临床获益的体重降幅)。
小结
每一款新药,每一项医学进步背后都是长期大量科学研究的积累。GLP-1正在改写糖尿病、肥胖等一系列代谢疾病的治疗格局,以及其在阿尔茨海默病、帕金森病等疾病中也展现出治疗潜力。对这些疾病领域深入研究,可以帮助我们更广泛地认识到肠促胰素在人体健康和疾病中的作用。无论GLP-1相关研究是否会摘得诺奖桂冠,都“含金量”满满。让我们共同期待2024年诺奖的正式公布。
参考资料
[1]Folli F, Finzi G, Manfrini R, Galli A, et al. Mechanisms of action of incretin receptor based dual- and tri-agonists in pancreatic islets. Am J Physiol Endocrinol Metab. 2023 Nov 1;325(5):E595-E609. doi: 10.1152/ajpendo.00236.2023. Epub 2023 Sep 20. PMID: 37729025; PMCID: PMC10874655.
[2]American Diabetes Association Highlights Novel Agent Retatrutide which Results in Substantial Weight Reduction in People with Obesity or Type 2 Diabetes During Late Breaking Symposium. https://diabetes.org/newsroom/press-releases/2023/american-diabetes-association-highlights-novel-agent-retatrutide-results-substantial-weight-reduction-people-with-obesity-type-2-diabetes-during-late-breaking-symposium
[3]Julio Rosenstock, Juan Frias, Ania M Jastreboff, et al. Retatrutide, a GIP, GLP-1 and glucagon receptor agonist, for people with type 2 diabetes: a randomised, double-blind, placebo and active-controlled, parallel-group, phase 2 trial conducted in the USA. The Lancet. June 26, 2023DOI:https://doi.org/10.1016/S0140-6736(23)01053-X
[4]The Galien Foundation Honors 2023 Prix Galien Award Recipients. Retrieved October 27, 2023 from https://www.prnewswire.com/news-releases/the-galien-foundation-honors-2023-prix-galien-award-recipients-301969840.html
[5]The 2024 Lasker Awards. Retrieved September 19, 2024 from https://laskerfoundation.org/
[6]2023 BREAKTHROUGH OF THE YEAR. Retrieved December 14, 2023 from https://www.science.org/content/article/breakthrough-of-the-year-2023
[7]Mering J, Minkowski O. Diabetes mellitus nach pankreas-extirpation. Arch Exp Pathol Pharmakol. (1889/90: ) 26:372–87.
[8]BaylissWM, StarlingEH. The mechanism of pancreatic secretion[J]. J Physiol, 1902, 28(5):325-353. DOI: 10.1113/jphysiol.1902.sp000920.
[9]MooreB. On the treatment of diabetus mellitus by acid extract of duodenal mucous membrane[J]. Biochem J, 1906, 1(1):28-38. DOI: 10.1042/bj0010028.
[10]Banting, F. G. et al. The effect produced on diabetes by extractions of pancreas. Transact. Ass. Amer. Physicians 37, 337 (1922).
[11]Banting, F. G. et al. Pancreatic extracts in the treatment of diabetes mellitus: preliminary report. Can. Med. Assoc. J. 12, 141–146 (1922).
[12]Klein SW, Morch JE, Mahon WA. Cardiovascular effects of glucagon in man. Can Med Assoc J 98: 1161–1164, 1968.
[13]La Barre J. Sur les possibilités d'un traitement du diabète par l'incrétine. Bull Acad Royal Med Belg. (1932) 12:620–34.
[14]ElrickH, StimmlerL, HladCJ, et al. plasma insulin response to oral and intravenous glucose administration[J]. J Clin Endocrinol Metab, 1964, 24:1076-1082. DOI: 10.1210/jcem-24-10-1076.
[15]BrownJC. A gastric inhibitory polypeptide. Ⅰ. The amino acid composition and the tryptic peptides[J]. Can J Biochem, 1971, 49(2):255-261. DOI: 10.1139/o71-037.
[16]PedersonRA, SchubertHE, BrownJC. Gastric inhibitory polypeptide. Its physiologic release and insulinotropic action in the dog[J]. Diabetes, 1975, 24(12):1050-1056. DOI: 10.2337/diab.24.12.1050.
[17]SangerF, TuppyH. The amino-acid sequence in the phenylalanyl chain of insulin. 2. The investigation of peptides from enzymic hydrolysates[J]. Biochem J, 1951, 49(4):481-490. DOI: 10.1042/bj0490481.
[18]SangerF, ThompsonEO. The amino-acid sequence in the glycyl chain of insulin. Ⅱ. The investigation of peptides from enzymic hydrolysates[J]. Biochem J, 1953, 53(3):366-374. DOI: 10.1042/bj0530366.
[19]McintyreN, HoldsworthCD, TurnerDS. New interpretation of oral glucose tolerance[J]. Lancet, 1964, 2(7349):20-21. DOI: 10.1016/s0140-6736(64)90011-x.
[20]BlundellTL, CutfieldJF, CutfieldSM, et al. Atomic positions in rhombohedral 2-zinc insulin crystals[J]. Nature, 1971, 231(5304):506-511. DOI: 10.1038/231506a0.
[21]Unger RH, Eisentraut AM, Mc CM, Keller S, Lanz HC, Madison LL. Glucagon antibodies and their use for immunoassay for glucagon. Proc Soc Exp Biol Med 102: 621–623, 1959
[22]BellGI, Sanchez-PescadorR, LaybournPJ, et al. Exon duplication and divergence in the human preproglucagon gene[J]. Nature, 1983, 304(5924):368-371. DOI: 10.1038/304368a0.
[23]BellGI, SanterreRF, MullenbachGT. Hamster preproglucagon contains the sequence of glucagon and two related peptides[J]. Nature, 1983, 302(5910):716-718. DOI: 10.1038/302716a0.
[24]潘琦, 郭立新. 全面正确评价肠促胰素的生物学效应[J] . 中华糖尿病杂志, 2023, 15(9) : 790-796. DOI: 10.3760/cma.j.cn115791-20230714-00386.
[25]彭永德. 胰高糖素样肽-1受体激动剂的临床应用[J] . 中华糖尿病杂志, 2023, 15(Z2) : 1-7. DOI: 10.3760/cma.j.cn115791-20230929-00206.
[26]潘琦, 郭立新. 胰高糖素样肽-1受体激动剂的发展历程和临床应用进展 [J] . 中华糖尿病杂志, 2022, 14(12) : 1355-1363. DOI: 10.3760/cma.j.cn115791-20220802-00375.
[27]Müller TD, Blüher M, Tschöp MH, DiMarchi RD. Anti-obesity drug discovery: advances and challenges. Nat Rev Drug Discov 21: 201–223, 2022. doi: 10.1038/s41573-021-00337-8.
[28]NauckMA, KleineN, OrskovC, et al. Normalization of fasting hyperglycaemia by exogenous glucagon-like peptide 1 (7-36 amide) in type 2 (non-insulin-dependent) diabetic patients[J]. Diabetologia, 1993, 36:741–744.
[29]Drucker DJ, DeForest L, Brubaker PL. Intestinal response to growth factors administered alone or in combination with human [Gly2]glucagon-like peptide 2. Am J Physiol 1997; 273: G1252-G1262
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#肠促胰素# #GLP-1RA#
34