燃烧吧!脂肪~(看CD8+T细胞如何消灭肿瘤)
2017-10-11 佚名 生物探索
众所周知,通过游泳、竞走等运动方式可减少脂肪、增加肌肉、使身体变得轻盈敏捷从而保持健康。从分子生物学角度,“燃烧脂肪”(促进脂肪酸的破裂)还具有延长癌症患者T细胞存活时间,调节肿瘤微环境的免疫学功能。Nature Review Cancer 的一篇综述佐证了这一观点。
, 众所周知,通过游泳、竞走等运动方式可减少脂肪、增加肌肉、使身体变得轻盈敏捷从而保持健康。从分子生物学角度,“燃烧脂肪”(促进脂肪酸的破裂)还具有延长癌症患者T细胞存活时间,调节肿瘤微环境的免疫学功能。Nature Review Cancer 的一篇综述佐证了这一观点。
肥胖已经成为全球性流行病,2014年大约13%成年人肥胖,超重者高达40%。肥胖患者表现出低度脂类代谢异常。这不仅与心血管疾病发生密切相关,而且与肿瘤发生、发展、侵袭和转移等密切相关。肿瘤脂类异常代谢是改变肿瘤代谢(也称肿瘤代谢重编程)的重要组成部分。
医学家们将从肿瘤组织中分离到的淋巴细胞称为“肿瘤浸润性T淋巴细胞”(TILs)。据文献报道,这种细胞在体外经白细胞介素2(IL-2)刺激后可大量增殖,刺激后增殖的TIL细胞又称之为“肿瘤来源的激活细胞”,具有超强的特异性抗肿瘤功能。
免疫治疗的阳性反应通常依赖于肿瘤细胞与肿瘤微环境(TME)内免疫调节的相互作用。在这些相互作用下,肿瘤微环境在抑制或增强免疫应答中发挥着重要的作用。然而,肿瘤浸润性T淋巴细胞(TILs)是如何适应肿瘤微环境(TME)导致其耗尽(例如低血糖和缺氧)以维持其抗肿瘤功能代谢挑战尚不清楚。
但在最近的研究中,科学家发现:CD8+TIL(细胞毒性T细胞和CD8表面蛋白)能够增强PPARα信号转导,后者是一种过氧化物增殖激活受体,参与脂质调节、脂肪生成和血糖控制,是脂肪酸分解代谢的关键转录因子。
1CD8+TIL细胞增强PPARα信号转导
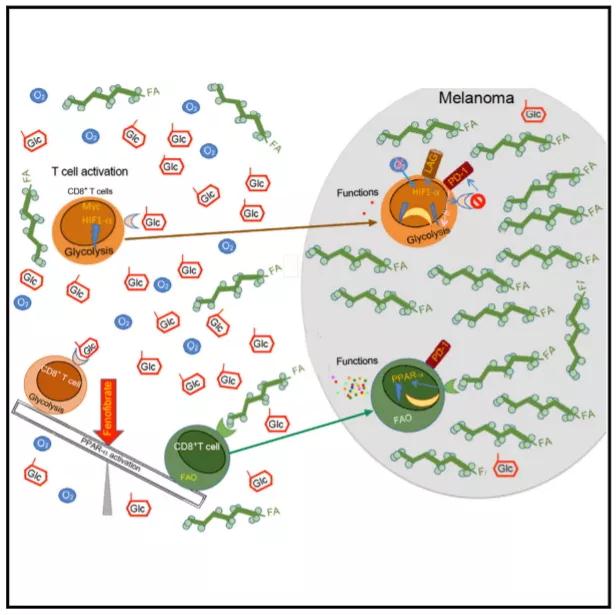
CD8+T细胞增强PPARα信号
在实验过程中,研究者给予正常和BRAF基因V600E突变(B16-BrafV600E)荷瘤小鼠两种基于腺病毒的疫苗混合物,以刺激黑素瘤相关特异性抗原(MAA)和人乳头瘤病毒E7(E7)特异性CD8+T细胞的应答。
尽管疫苗接种延迟了肿瘤进展,但在第30天,特异性靶向CD8+TILs细胞的黑色素瘤相关抗原(MAA-specific CD8+TILs)和人乳头瘤病毒(E7-specific CD8+TILs)数量依次下降了约90%和805,PD-1和LAG3的表达显著增强,HIF1α增加。当研究人员敲低CD8+T细胞后,HIF1α增加,LAG3表达,但不增加PD-1,并损害T细胞的效应。
他们还发现,具有HIF1α敲低的CD8+TIL分别增加了糖酵解相关基因表达,降低了三羧酸循环相关基因的表达,并增加了PPARα信号的表达。这说明,CD8+TIL细胞促使脂肪酸分解代谢以保持效应子功能,通过增强PPARα信号转导改善肿瘤生长控制。
2PD-1表达随CD8+TILs增加而增加
而后,研究人员通过使用液相色谱—质谱法联用、同位素标记代谢物强度表征体内CD8+TIL代谢。在给予[13C]葡萄糖或[13C]棕榈酸酯接种疫苗的荷瘤小鼠中,糖酵解代谢物的强度在第30天下降,而脂肪酸分解代谢物增加。
在携带BRAF基因V600E突变的黑素瘤患者体内,游离脂肪酸的水平一直升高;而从切除的黑色素瘤转移中分离出的CD8 + TIL与循环T细胞相比,展示出更强的脂肪酸吸收negligence和较高的PPARα表达力,PD-1的表达随CD8+TILs的增加而增加。
3降胆固醇药有望改善黑色素瘤疗法
研究者利用利用FDA批准的用来降低胆固醇水平贝特类(fibrates)药物进行研究发现,这类药物能够促进脂肪酸的破裂,同时他们还观察到促进代谢开关的开启或与肿瘤中T细胞功能的改善直接相关。更重要的是,在CD8+T细胞转移期间与免疫检查点抑制剂阻断疗法相协同,延缓了小鼠肿瘤进展,并完全阻止50%的小鼠的肿瘤生长。
首席研究人员Hildegund Ertl教授总结说:“我们将测试CD8+T细胞对脂肪酸的分解代谢是否延长了T细胞存活,并进一步改善黑色素瘤疗法。采用药物介入促进TILs应对脂肪酸代谢机制或有助于开发基于T细胞的不同类型癌症的免疫疗法。”
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#D8+T#
112
#CD8#
119