CSCO2022 CDE专场|2022年中国抗肿瘤新药审评情况报告
2022-11-08 梅斯医学 网络
在2022年11月6日上午开启的CDE专场中,国家药品监督管理局药品审评中心副主任杨志敏针对2022年中国抗肿瘤新药审评情况展开精彩报告。
由中国临床肿瘤学会和北京市希思科临床肿瘤学研究基金会共同主办的第25届全国临床肿瘤学大会暨2022年CSCO学术年会于2022年11月5日至12日以”CSCO年会学术周”的形式举行。本次会议以“精准创新,智慧人文”为主题,邀请国内、外著名专家学者进行主题演讲和新进展报告,力求全面、准确地传递临床肿瘤学领域的新观念、新知识和新技术。在2022年11月6日上午开启的CDE专场中,国家药品监督管理局药品审评中心副主任杨志敏针对2022年中国抗肿瘤新药审评情况展开精彩报告。
审评工作情况
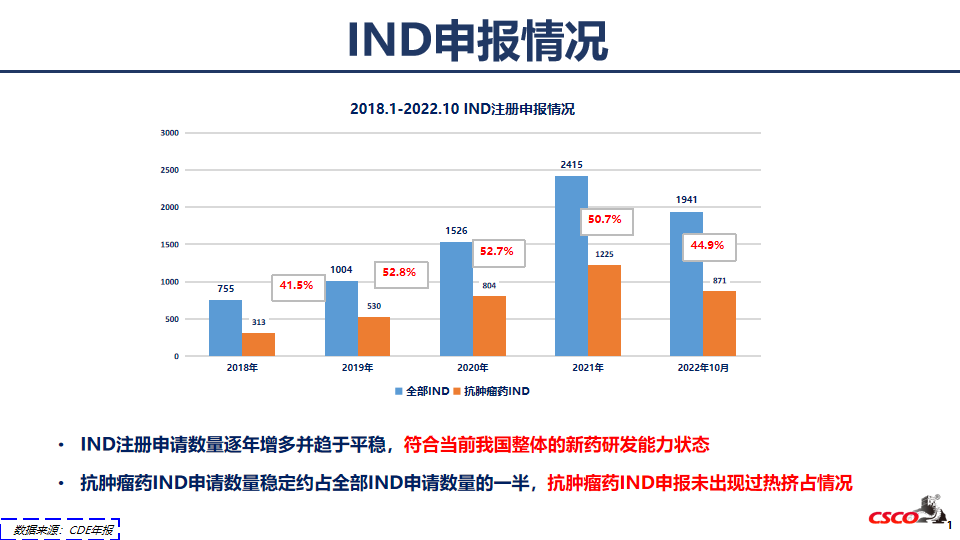
IND申报情况
2018年1月-2022年10月,共有 55 个 NDA 获批,其中 21 个位首次上市获批,新上市的国产抗肿瘤药物有 4 个,分别为帕瑞妥单抗(血液肿瘤)、斯鲁利单抗(泛肿瘤)、卡度尼利单抗(妇科肿瘤-双抗)、瑞维鲁胺片(前列腺癌)。符合当前我国整体的新药研发能力状态。抗肿瘤药IND申请数量稳定约占全部IND申请数量的一半,抗肿瘤药IND申报未出现过热挤占情况。我国抗肿瘤药研发的活跃程度不断增高,2018-2021年间增幅(35.7%)超过全球总体增长(17.3%)。NDA数量呈逐年增多趋势,其中抗肿瘤药NDA约占全部NDA的31.1%
抗肿瘤新药NDA 批准情况
首次获批上市的新药近三年总体持平,新增适应症的药物,2022年较2021年有所降低。2020年7月发布的新《药品注册管理办法》第六十八条优先审评审批适用范围包括:临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药;符合儿童生理特征的儿童用药品新品种、剂型和规格;疾病预防、控制急需的疫苗和创新疫苗;纳入突破性治疗药物程序的药品;符合附条件批准的药品;国家药品监督管理局规定其他优先审评审批的情形。
今年抗肿瘤NDA批准纳入优先审评审批品种23个,包括附条件批准18个78.3%、随机对照批准2个(8.7%)、儿童用药及罕见突变3个(13.0%)、临床急需名单1个(艾伏尼布)。

实践与思考
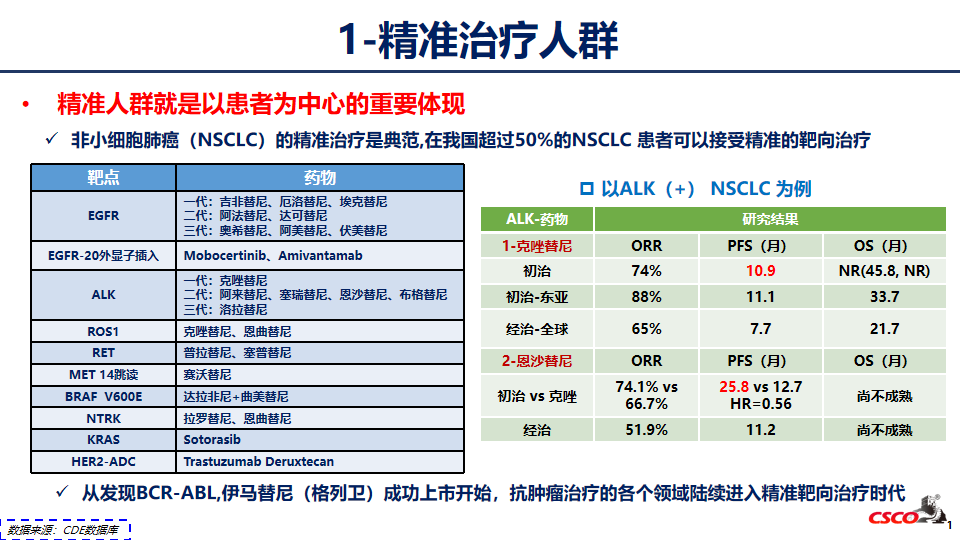
精准治疗人群
肿瘤治疗已经进入精准医学时代,新时代下肿瘤精准医学需要药物和诊断的协同。近年来,国家药品监督管理局药品审评中心(CDE)、国家药品监督管理局医疗器械技术审评中心(CMDE)等部门先后颁布了多项指导原则,强调规范化的精准检测及伴随诊断在新药研发中的必要性,精准检测和伴随诊断能够更精准地锁定用药人群,从而提高肿瘤患者的临床获益。
精准人群是指富集对治疗有更好反应的人群,特别是针对预后差的人群,临床意义更加显著。精准人群就是以患者为中心的重要体现,针对不同的精准患者人群,单药疗效差别很大,深入和全面的了解疾病特征,是选择适应症人群和制定治疗策略的基础。对于无法精准找到基因病变的情况,开展广泛研究,从预后因素着手,在复杂的异质性中寻找潜在的共性规律。对于特定精准治疗的有效性评价需要通过预设的前瞻性设计的研究予以验证。
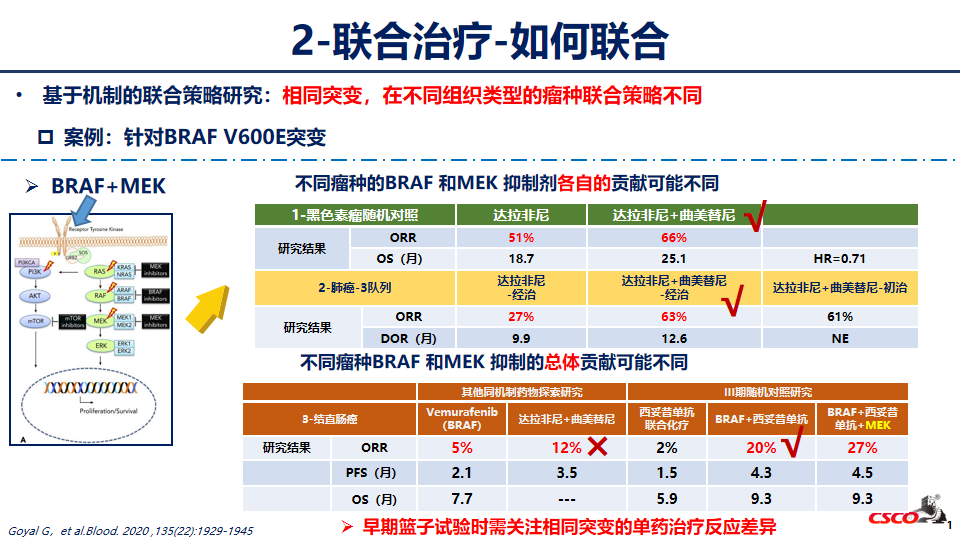
联合治疗
单药治疗在应对晚期癌症时是较为无力的,这是因为癌症具有多种发病和自我繁殖的机制,单一抗癌药物很难完全抑制其疾病进程。这就好比一座四通八达的城市,只堵住一条高速路,车辆依然可以从其它道路进城。相比之下,使用针对不同靶点抗癌药物的联合治疗可以同时“堵住”多条道路,在抗癌疗效上显然更有优势。但这种优势除了简单的“疗效叠加”,还依靠药物组合的“协同效应”。所谓协同效应,就是“1+1>2”,药物组合的疗效大于各个药物的疗效总和,甚至出现单独使用组成药物无法获得的额外益处。协同效应的存在让联合治疗的抗癌效果更上一层楼。
联合治疗是提高患者抗肿瘤疗效(单药不满意)和克服耐药(单药无效/进展)的重要手段,《抗肿瘤药联合治疗临床试验技术指导原则》指出,联合开发的一般考虑包括联合的机制依据(分子机制、病理生理特征、体外体内非临床数据)和单药临床数据,探索性试验设计应加入疗效析因考量(临床数据支持联合机制)。当单药无效/单药疗效不足,机制充分基础上,可尽早开展联合探索,当开展联合用药,参照《注册管理办法》第二十七条,递交联合用药的IND申请。
是否需要联合?和谁联合?如何联合?这是进行联合治疗应该充分考虑的问题。明确联合用药中每个单药的贡献是有效性获益还是安全性风险,在联合使用相同机制的药物时,需关注不同药物安全性特征差异,避免毒性叠加。
人群分线
临床试验中对于肿瘤患者既往的治疗方案计算线数,最主要的目的就是进一步明确适应症人群。一般来说,一个治疗方案对未经治疗的患者比经过治疗的患者,效果会更好一些。经过多种治疗方案失败的患者,可能激发各种耐药机制,导致越来越难治,对新的治疗方案效果也更差。同时,经过多种治疗方案失败的患者,对新的治疗方案可能耐受性更差,更容易出现不良反应。
抗肿瘤药研发通常从后线向前线推进,精准治疗经生物标志物筛选患者人群,前期数据显示后线突出疗效,可减少前线人群探索性研究,直接开展前线人群关键研究;关键研究同时纳入前线及后线人群,满足不同治疗线数患者的临床需求。即使经生物标志物筛选人群,在后线疗效不突出时,同样应谨慎考虑前线研究策略。对于非精准治疗,治疗线数仍然需要关注。

研究终点
双终点选择的考虑包括两个终点之间的相关性决定同时达到还是达到其一;根据不同药物的作用特点,选择适合的双终点(化疗、抗血管、免疫治疗各不同);替代终点/中间终点的有效性幅度决定是否可以提前申报(显著的替代终点成功才有可能转化为临床终点的获益);多次分析的挑战;同时需考虑试验组的研究设计。对于一个药物而言,后线充分的数据可以支持前线的替代终点,仅仅是替代指标获益,不一定能最终获益。

目前而言,中国抗肿瘤药物的研究进步卓越,但即使如此,通过文献中快速追跑是"捷径”还是“死胡同”;文献中的机制发现是否都能成为有效的治疗靶点;在研靶点众多,是否都能成药;肿瘤患者需要接受多少种联合治疗以及哪些为最优组合;对于不同特征的患者,需要的治疗是否相同以及什么治疗最适合等都是肿瘤治疗领域的挑战性问题。
对致力于推动肿瘤治疗领域前进的同道而言,新药研发,学无止境。加强基础研究,夯实科学基础,加强对疾病的整体认识。基于患者为中心的新药研发,加强多学科合作,创新研究方法和工具,提高研发效率,关注儿科肿瘤、罕见肿瘤。中国创新药物研究的挑战和机遇并存,全球化是未来的研发趋势,我们需要以患者为中心,以临床价值为导向,使药品最大限度地发挥益处。
参考资料:
https://mp.weixin.qq.com/s/s2jgqTwsu2JeDoxv9cFskw
https://mp.weixin.qq.com/s/fr9VuwHal3as0tX5Xg8pww
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













