Cell metabo:癌症代谢蓝图综述
2022-10-19 解螺旋 解螺旋
为了在营养供应有限、代谢废物堆积的肿瘤微环境(TME)中竞争生长的空间,狡猾的肿瘤细胞会发生许多代谢适应性转变,倾向于产生更多的生物量,从而促进其增殖。随着肿瘤的生长和转移,甚至整个机体的营养分布和代
为了在营养供应有限、代谢废物堆积的肿瘤微环境(TME)中竞争生长的空间,狡猾的肿瘤细胞会发生许多代谢适应性转变,倾向于产生更多的生物量,从而促进其增殖。随着肿瘤的生长和转移,甚至整个机体的营养分布和代谢都会受到影响。为此,在今年3月1日斯隆凯特琳癌症中心的Craig B. Thompson教授及其团队在Cell metabolism(IF=31.373)上发表题为" The hallmarks of cancer metabolism: Still emerging “的综述来阐述他们对癌症代谢的最新认识。

摘要
癌细胞新陈代谢是为了生物量(biomass)的产生和增殖。由于局部组织内的代谢资源有限,这可能会导致营养消耗和代谢废物的积累。为了在这种条件下维持生长,癌细胞会利用各种代谢来适应,其性质由其起源细胞的生理学、病变的特性以及癌细胞所在的组织共同决定。此外,有些代谢物不仅可作为能量和生物量生成的底物,而且还可以调节基因和蛋白质的表达,并影响肿瘤附近非转化性细胞的行为。肿瘤在生长和转移的过程中,会影响体内的营养物质分布,同时也受其影响。在本文中,最近的研究进展被纳入整合到了一个概念性框架中,可能有助于指导探索癌细胞代谢的进一步研究工作。
简介
单细胞生物体会根据其生存环境中营养源的可获得性和质量来决定生物量和增殖。相比之下,多细胞生物体内单个细胞的生长和增殖,则是通过组织特定的可溶性生长因子和生物物理信号(biophysical cues)的组合,以非细胞自主的方式进行调节。这些信号输入的整合使细胞能够调控必需营养物质的输入,并利用这些营养物质产生必要的生物质成分。在正常细胞中,这些信号的范围(extent)和持续时间受到组织对稳态需求的限制。相反,转化了的细胞由于积累了选择性遗传和表观遗传的改变,使得它们能够通过保持主要的促生存和促增殖的信号,而处于持续的 "打开(on)"状态,从而逃避组织对其增殖的控制。这反过来又导致在受影响的细胞中建立了一种持久的促合成代谢状态,并使转化的细胞不受控制地聚集和发生肿瘤扩张。
在静止期细胞中,输入的营养物质主要用于产生能量。这个过程涉及营养物质来源中的碳原子发生逐步氧化。从这些氧化反应中提取的电子沉积到电子载体分子NAD+和FAD上,以生成NADH和FADH2,然后传递给线粒体电子传输链(ETC)的各个组成部分,最终传递给分子氧。电子连续通过ETC使细胞维持三磷酸腺苷(ATP)的生产,同时也再生NAD+和FAD载体。相反,被信号指示增殖的细胞不仅会从周围环境中摄入更多的营养物质,而且还会调整其代谢网络,将营养物质的剩余部分用于生产并积累生物质。
虽然促增殖的信号本身可以在转化的细胞中无限期地保持“打开”的状态,但肿瘤持续扩张对营养物质的需求最终会超过局部组织所能提供的营养资源。细胞外肿瘤微环境(TME)中营养物质的耗尽往往伴随着合成代谢副产物水平的升高。为了维持自身,转化的细胞依靠一系列不同的代谢适应性来突破对营养供应的限制。因此,一些癌细胞会吞噬和分解细胞外大分子,甚至整个细胞来作为所缺营养的来源。此外,一些类型的转化细胞会通过利用游离的铵,并重塑代谢,以优先使用氮供体进行核苷酸和非必需氨基酸合成,来适应其环境中较低水平的含氮营养物质消耗(由于氮在构建蛋白质和核酸中的作用,这些营养物质在增殖细胞中的需求量很大)。
除了结构构件外,一些关键的生物合成反应需要一个以电子供体形式存在的还原力来源,即NADPH。NADPH从NADP+再生的动力来自于碳原子的氧化,而碳原子的氧化是嵌入中央碳代谢的一组特殊反应。除了NADPH,对肿瘤细胞生存和/或生长至关重要的几个代谢反应也相应地由NAD+或NADH辅助因子所提供的氧化或还原能力所推动。在合成代谢活跃的细胞中,NADH/NAD+氧化还原对不仅被用于促进氧化磷酸化,而且还支持生物合成,特别是在糖酵解和三羧酸(TCA)循环中,NAD+需要当作电子受体以维持通路的通量。因此,这些还原型和氧化型辅助因子之间的平衡是至关重要的。事实上,尽管由于促生长信号的激活会增加可氧化的碳源涌入细胞而有利于NADH的产生,但过高的NADH/NAD+比率可能会干扰那些需要NAD+的反应。特别是,NADH的过量供应可能会超过ETC的NAD+再生能力,特别是当作为最终电子受体的氧气随着肿瘤的增大而变得有限时。因此,转化的细胞必须依靠强大的氧化应激防御机制来减轻自由电子基对细胞结构造成的损害。
虽然细胞对营养物质的输入和利用是由信号通路控制的,但已经很清楚的是,一些代谢中间物本身也是有效的信号调节剂。因此,某些代谢物水平的变化可以通过控制细胞DNA、RNA和组蛋白的表观遗传学变化,甚至直接调节蛋白质的产生,而引起对细胞基因和蛋白质表达的全面改变。此外,研究证明,随着肿瘤的生长,其周围环境中代谢物组成的改变可作为一个显著的信号,调节其附近的各种非转化细胞类型的行为,从而进一步促进肿瘤的生长。最后,人们也越来越认识到,肿瘤不仅与其周围环境中的细胞进行代谢交互作用,而且还能影响整个机体的代谢经济。
一个世纪以前,德国生物化学家Otto Warburg首次描述了肿瘤发生与代谢失调之间的联系。在过去的20年里,随着对细胞转化的遗传和表观遗传机制有了详细的新认识,以及现代实验技术的发展,癌症代谢领域已经进入了新时代。5年前我们提出了几个新兴的概念,但在癌细胞代谢方面已经出现了一些新的、转变范式的新发现。癌症代谢特征的最初概念也有了延伸。
葡萄糖和氨基酸摄取失调
葡萄糖是哺乳动物细胞消耗的主要碳源。通过糖酵解和TCA循环对葡萄糖进行分解,不仅可为ATP的产生提供动力,而且还产生了支持大分子生物合成的碳中间体。在哺乳动物细胞中,葡萄糖的摄取是通过生长因子信号和位置信号(positional cues)进行非细胞自主调节的。因此,正常细胞只有在受到细胞类型特异性生长因子(如胰岛素、血小板衍生生长因子(PDGF)或表皮生长因子(EGF))的刺激时才能获得足够的葡萄糖来支持生长和增殖。生长因子的刺激可导致下游信号事件的激活,包括受体酪氨酸激酶(RTK)PI3K-AKT1(也被称为蛋白激酶B)级联。RTK-PI3K-AKT1轴可促进葡萄糖转运体1(GLUT1)的表达及其从细胞内膜向细胞表面的转移,以促进葡萄糖的摄取。此外,AKT1的激活可增加己糖激酶的活性,使输入的葡萄糖可以被磷酸化,并被捕获用于糖酵解和下游代谢途径(图1)。除了可溶性生长因子,来自机械线信号的输入,包括由细胞与细胞外基质(ECM)的连接和基质的生物物理特性,也是正常细胞摄取和利用葡萄糖的守门员(gatekeepers)。
作为致癌突变的直接和间接后果,癌细胞往往表现为从细胞外环境中摄取葡萄糖的能力增强。在人类癌症中可经常观察到RTK编码基因的扩增,如EGFR、ERBB2和c-Met。同样,PI3K的致癌突变及其负调控因子PTEN和INPP4B的遗传缺失,也经常被认为是肿瘤发生的驱动事件。这些基因改变集中在PI3K-AKT1信号级联,并以独立于外部信号输入所提供的信号方式,允许细胞自主摄取足量的葡萄糖,以实现持续生长和增殖。
转化的细胞采用侵袭性表型会增加细胞维持肌动蛋白迁移所需的能量需求,因此进一步提高对葡萄糖摄取和分解的需求。反过来,最近发现与侵袭相关的ECM成分之一,透明质酸,的降解会增加细胞的葡萄糖摄取和上调糖酵解,这有助于产生足够数量的ATP以支持癌细胞的入侵。此外,局部细胞密度的降低本身就可以提高GLUT1转运体的表达,而增加葡萄糖的摄取和利用。
向合成代谢的转变会使很大一部分剩余的碳分配到生物合成途径中。因此,糖酵解的中间产物葡萄糖-6-磷酸可以直接转入磷酸戊糖途径(PPP),以支持核苷酸生物合成。在这个过程中,葡萄糖骨架逐渐被氧化,使细胞能够从其氧化形式(NADP+)中再生出还原形式的NADPH,以支持细胞液中的还原性代谢反应,如脂肪酸生物合成所需的反应。其他下游的糖酵解中间产物也可作为合成代谢的前体。这些包括果糖-6-磷酸,它产生葡萄糖-氨基-6-磷酸(这是合成葡萄糖胺聚糖的组成部分),以及二羟基丙酮磷酸(DHAP,它可产生甘油,也是甘油二酯和甘油三酯的主链)。此外,在糖酵解途径中产生的3-磷酸甘油酯可以通过磷酸甘油酯脱氢酶(PHGDH)催化的反应转入到丝氨酸的生物合成(图1)。癌细胞不仅需要丝氨酸作为蛋白质的组成部分,还需要含有磷脂酰丝氨酸的磷脂来组装细胞膜,并作为核苷酸产生的碳供体,以及线粒体NADPH产生的电子源。因此,PHGDH的基因组扩增经常在人类恶性肿瘤中观察到,包括乳腺癌和黑色素瘤,它们需要促进肿瘤的发生。
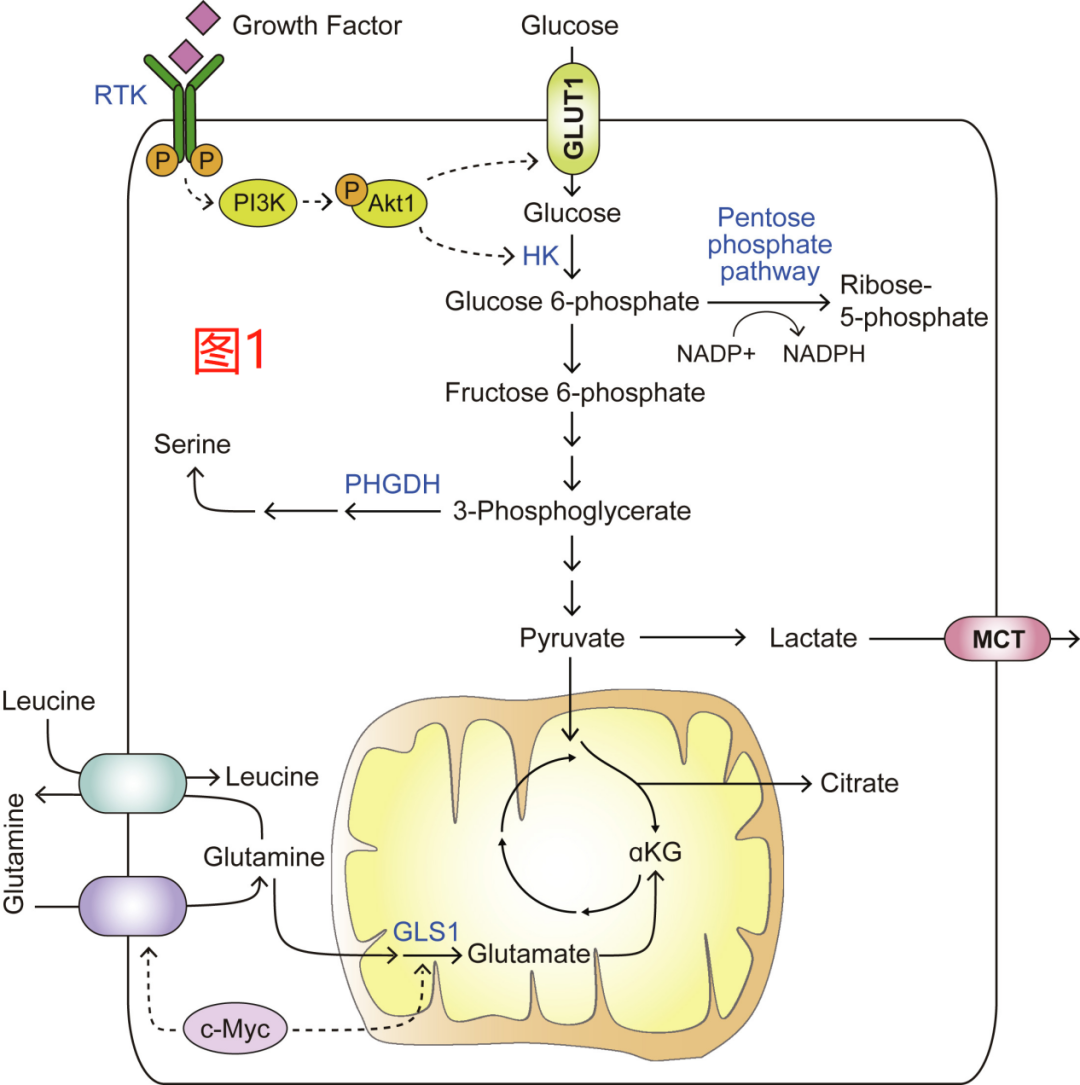
除葡萄糖外,对合成代谢的需要也增加了谷氨酰胺的输入。具体来说,促增殖的刺激因素会引发血浆中谷氨酰胺转运体ASCT2/SLC1A5和SN2/SLC38A5的上调。这两种转运体的表达受到增殖驱动转录因子c-myc的正向调节;此外,ASCT2的表达也受到另一个增殖相关转录因子E2F-3的促进。此外,EGFR信号传导也有助于ASCT2蛋白的质膜定位。除了参与蛋白质的合成,谷氨酰胺在细胞中还发挥了多种合成代谢作用。具体来说,多种定位于胞质溶胶的生物合成酶利用谷氨酰胺的酰胺基团来促进核苷酸、氨基己糖单元和天冬酰胺的生成,而谷氨酰胺的α-胺基被结合到其他从头合成的非必需氨基酸中。谷氨酰胺还可以在线粒体中被谷氨酰胺酶1(GLS1)分解,该酶也受c-myc的正向调节(图1)。GLS1对于为TCA循环提供线粒体的α-酮戊二酸来源至关重要;此外,GLS1及其位于胞质溶胶上的对应物GLS2通过为谷胱甘肽的产生提供谷氨酸,参与加强细胞的氧化应激防御。除了支持生物合成和生物能量外,细胞内谷氨酰胺的输出也有助于通过SLC5A7/SLC3A2异源二聚体双向转运蛋白从细胞外摄取一些必需氨基酸。
利用中心碳代谢来支持生物合成
TCA循环在传统上被认为是一个分解代谢过程,其中碳底物被氧化以产生能量。事实上,正如最近对体内葡萄糖转归的定量分析所揭示的那样,在大多数成人组织中,被氧化以支持氧化磷酸化的主要TCA循环底物是乳酸,它在细胞外液中的含量约为1mM。新陈代谢活跃的细胞也使用TCA循环的中间产物作为合成大分子的前体(图2A)。在葡萄糖摄取和细胞内丙酮酸合成水平提高的部分刺激下,由此产生的碳盈余使TCA循环的中间体离开碳代谢的中心,而在各种生物合成反应中被消耗。反过来,这不仅提供了一个新的生物量来源,而且还使新陈代谢活跃的细胞避免产生过多的NADH,而超过ETC将其转化为NAD+的能力。因此,释放部分TCA碳以支持生物合成的能力可以被认为是细胞接受促生长信号刺激并因此经历过量可氧化营养物质代谢的必要性。
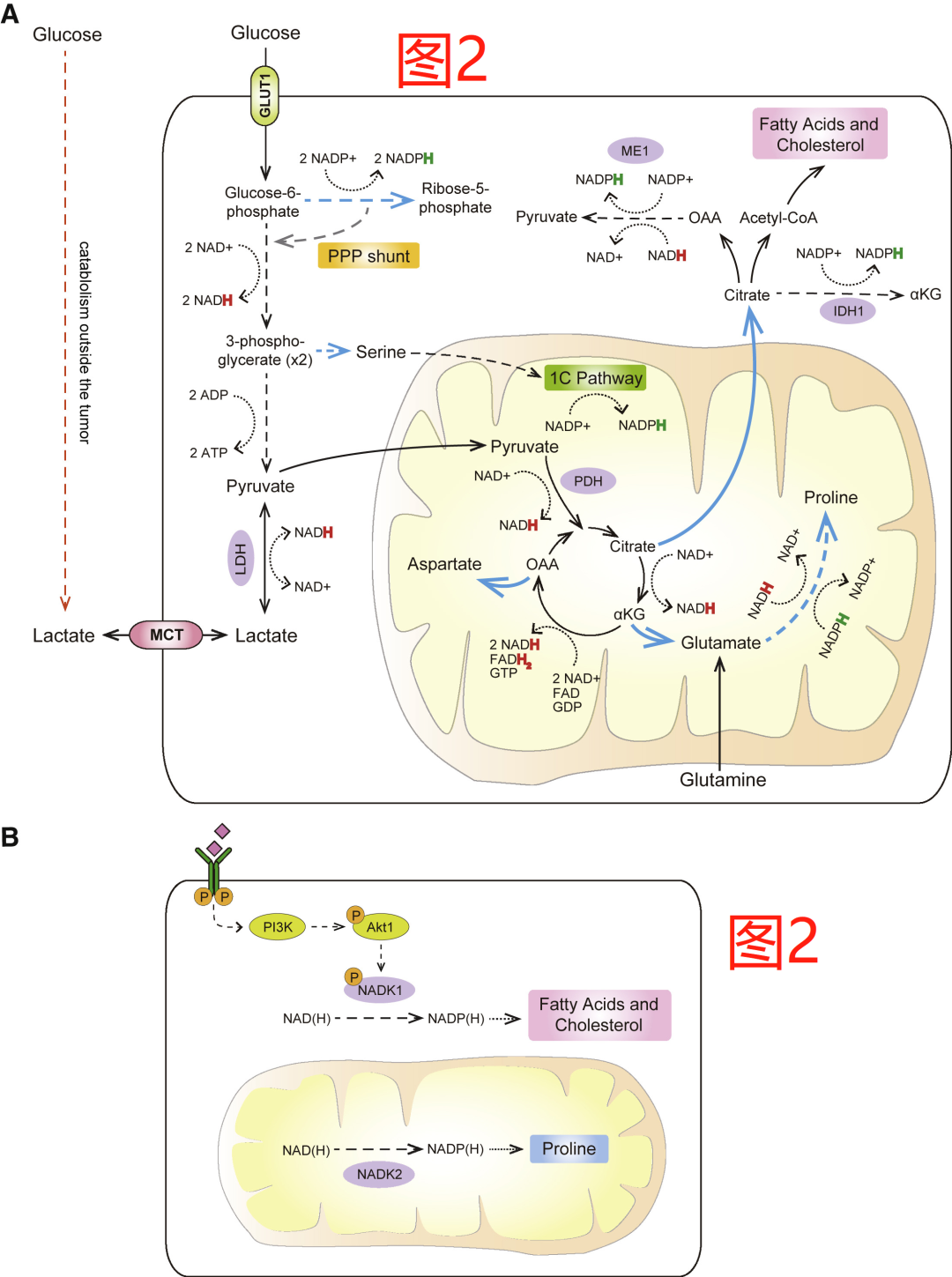
在发生合成代谢的细胞中,TCA循环中产生的柠檬酸盐可以从线粒体中输出,并用于生成可在细胞质中合成脂肪酸和胆固醇的基础物质。由于脂质是细胞膜的主要成分,由SREBP1转录因子协调的脂源性转录程序所激活,也是由mTORC1激活所协调的细胞促合成代谢程序的关键部分。此外,在ATP-柠檬酸酯酶(ACLY)催化的反应中,柠檬酸酯转化为草酰乙酸酯和乙酰CoA,这是脂肪酰基链和胆固醇从头合成的起始步骤,并受到AKT1的直接调节。此外,最主要的脂肪酸合成酶,脂肪酸合成酶(FASN)经常上调,并对肿瘤的发生起至关重要的作用。
脂肪生成是一个高度消耗NADPH的过程,例如,制造一分子棕榈酸需要14分子的NADPH。为了帮助平衡这些需求和细胞NADPH的供应,在ACLY介导的反应中,产生的草酰乙酸可以转化为苹果酸,它可以重新进入线粒体或在苹果酸酶1(ME1)催化的反应中被氧化为丙酮酸,产生NADPH。NADPH也可以从胞浆中的柠檬酸盐转化为异柠檬酸盐,然后通过胞浆定位的异柠檬酸脱氢酶(IDH1)转化为α-酮戊二酸产生。为了强调这些产生NADPH的反应在促进脂肪从头合成过程中所起的作用,在各种细胞环境中ME1或IDH1的耗竭被证明可以抑制脂肪的从头合成并抑制体内的肿瘤生长。
此外,除了将NADP+重新转化为NADPH的能力,细胞NADPH池的总规模也可以根据细胞的代谢需要进行动态调节(图2B)。两种NAD激酶亚型,胞浆定位的NADK1和线粒体定位的NADK2,可使细胞在其各自的细胞区室内将NAD+转化为NADP+。NADK1的活性由AKT1介导的磷酸化直接激活,这可能使得细胞可根据PI3K/AKT1驱动的信号输入来调整其进行NADPH驱动的细胞生物合成反应的能力,如脂肪从头合成。同样,NADK2被发现对NADPH依赖的脯氨酸从头生物合成是必不可少的,该反应发生在线粒体区。
另一个TCA循环中间物是α-酮戊二酸,它可以产生谷氨酸。谷氨酸反过来可以作为其他几种非必需氨基酸的前体,包括脯氨酸。值得注意的是,除了作为TCA循环碳的出口,生产一个分子的脯氨酸还需要消耗ATP、NADH和NADPH,而进一步抑制线粒体的电子负荷。在出口(vent)假说的支持下,阻断柠檬酸盐的输出或脯氨酸的合成都会增加氧化应激水平。最后,TCA中间产物草酰乙酸也可以从TCA循环中释放出来,进入天冬氨酸的合成,即嘧啶碱和天冬酰胺的前体。

尽管葡萄糖的摄取量可因增殖性刺激而增加,但其中较小一部分碳会进入线粒体中氧化。为了调节丙酮酸的碳进入TCA循环,将丙酮酸转化为乙酰CoA的限速酶丙酮酸脱氢酶(PDH)会受到显著的负调节,既通过其产物发生变构,也可通过四种丙酮酸脱氢酶激酶(PDKs)的抑制性磷酸化进行调节。值得注意的是,PDK1的过度表达或PDH磷酸酶(PDP2)的耗竭可导致PDH活性失调,从而触发KRAS转化细胞的氧化应激和衰老的启动。
作为在线粒体中氧化的替代方案,糖酵解产生的丙酮酸可以在胞浆乳酸脱氢酶(LDH)的驱动反应中被还原成乳酸。重要的是,产生乳酸会从NADH中再生出一个NAD+当量。此外,由于乳酸可通过单羧酸盐转运体(MCTs)而与细胞外空间迅速获得平衡,这种代谢途径可使整个糖酵解级联保持氧化还原的中性。由于没有NADH的消耗或生成,葡萄糖到乳酸的代谢完全可绕过对ETC和分子氧的需求,同时仍能产出2分子的ATP。
在缺氧条件下,葡萄糖向乳酸的代谢也是必要的,在这种条件下,ETC卸载NADH电子的能力受到低氧的限制。为此,作为主要的缺氧反应协调因子,HIF1α可同时上调葡萄糖转运体GLUT1、LDH和PDH抑制性激酶PDK1来实现这一过程。
缺氧并不是细胞优先将葡萄糖转化为乳酸的唯一情况。事实上,近100年前,Otto Warburg发现,肿瘤比正常组织消耗更多的葡萄糖,并优先将其转化为乳酸,而不是在线粒体中进行氧化(即使在有大量氧气存在的情况下)。由于选择不走线粒体的糖酵解碳氧化路线会丧失在葡萄糖碳中95%的能量,Warburg认为这种截断的糖酵解形式反映了致癌物对线粒体造成的损害,并假设其是导致癌症的根本原因。虽然Warburg的发现已经成为癌症代谢领域的基础,但他自己对这种效应的解释后来被驳倒了。事实上,大多数癌细胞继续氧化在线粒体中的碳,并需要功能性的ETC来维持生长。此外,非转化细胞,包括淋巴细胞和内皮细胞,在受到促增殖信号刺激时也会表现出Warburg效应,同时仍保留对氧化磷酸化的需求,从而揭示了Warburg效应是一种伴随细胞增殖的普遍代谢策略。
Warburg效应的适应性效用至今仍有争论。首先,有氧糖酵解使细胞再生ATP的速度比TCA循环更快。第二,乳酸的积累和伴随的细胞外环境酸化在建立有利于肿瘤发生的微环境方面也起着重要作用。第三,丙酮酸优先转化为乳酸,不仅使葡萄糖衍生的丙酮酸在线粒体中不被氧化,而且还通过直接从NADH中再生NAD+来帮助减轻电子负荷。第四,转向有氧糖酵解使细胞能够提高产生糖酵解中间产物的能力,以安全地支持积累生物量,而不会发生多余的电子压倒ETC的风险。
最近一系列研究对长期以来认为乳酸是肿瘤代谢的副产品的观点提出了挑战。事实上,追踪注射的13C同位素标记的葡萄糖和乳酸在癌症患者和基因工程小鼠肿瘤模型中的转化,发现循环中的乳酸是肿瘤TCA循环的重要贡献者。当肺部和脑部肿瘤患者接受13C同位素标记的葡萄糖进行全身输注时,发现葡萄糖衍生的13C碳素对肿瘤中乳酸和TCA循环中间产物-柠檬酸的贡献超过了它们对上游糖酵解中间产物的贡献,如3-磷酸甘油酯。这种标记模式与这些肿瘤类型一致,不仅直接利用葡萄糖,而且还吸收和代谢体内其他地方产生的乳酸。此外,当用13C标记的乳酸进行类似的输液时,发现乳酸的碳在肿瘤和非转化组织中都参与到了TCA循环的中间产物。评估乳酸盐来源的碳在各种组织中对TCA循环的贡献程度仍然是个存在激烈争论的话题;此外,关于乳酸范式在不同肿瘤类型中的适用性,以及产生乳酸和消耗乳酸的细胞和组织类型的特性目前仍在积极研究中。
鉴于转运乳酸的MCT1转运体普遍存在,这些最新发现将乳酸在全身碳经济中的作用定位为可氧化碳的固定来源,并在机体水平上保持平衡。相反,葡萄糖的摄取是一个高度受控的事件,与细胞的增殖状态密切相关。当考虑到晚期肿瘤中葡萄糖匮乏的微环境时,细胞外乳酸提供的可氧化碳源可能特别适用。在这种情况下,利用乳酸以及潜在的其他非葡萄糖来源的可氧化碳,虽然提高了ETC介导的从NADH再生的NAD+的负荷,但却为细胞提供了一个关键的优势,即把有限的葡萄糖供分配给生物量生产。虽然肿瘤细胞选择碳源的异质性范围仍在积极的研究中,但这些研究突出了细胞在肿瘤代谢的挑战性环境中进行合成代谢程序时,所必须要应对的、存在相互关联的代谢权衡。
利用机会主义获取养分
除了主要的低分子量营养物质,即葡萄糖和氨基酸,癌细胞还能够利用广泛的替代营养来源,对这些营养素的需求可由特定的代谢环境所驱动。自噬包括捕获和溶酶体介导的细胞内蛋白质或整个细胞内结构(如核糖体、线粒体和内质网[ER]的一部分)的降解。当低分子量代谢底物的摄取受到影响时,通过自噬提供的营养物质对细胞的生存则至关重要。除了作为紧急营养供应,细胞器特定的自噬可以帮助清除受损的细胞内结构,甚至通过减少分子聚集来改变细胞内部的生物物理特性。
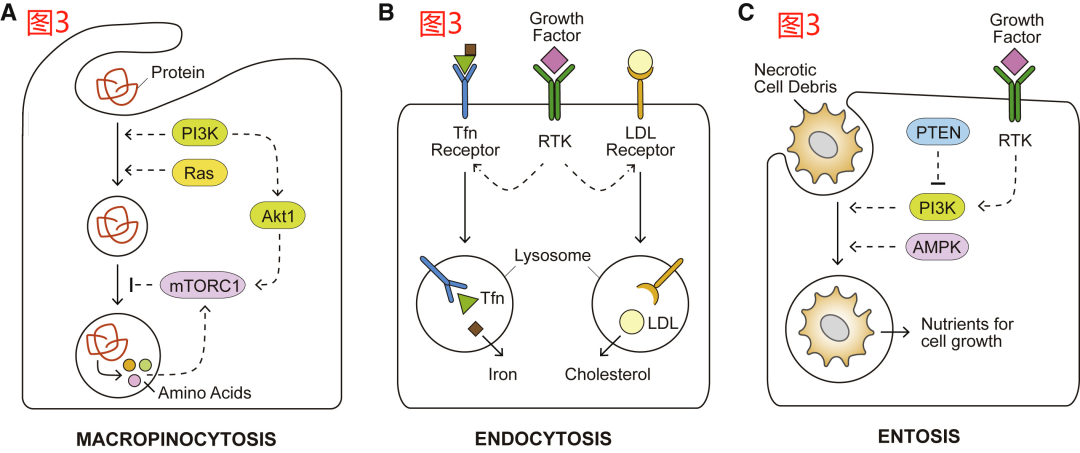
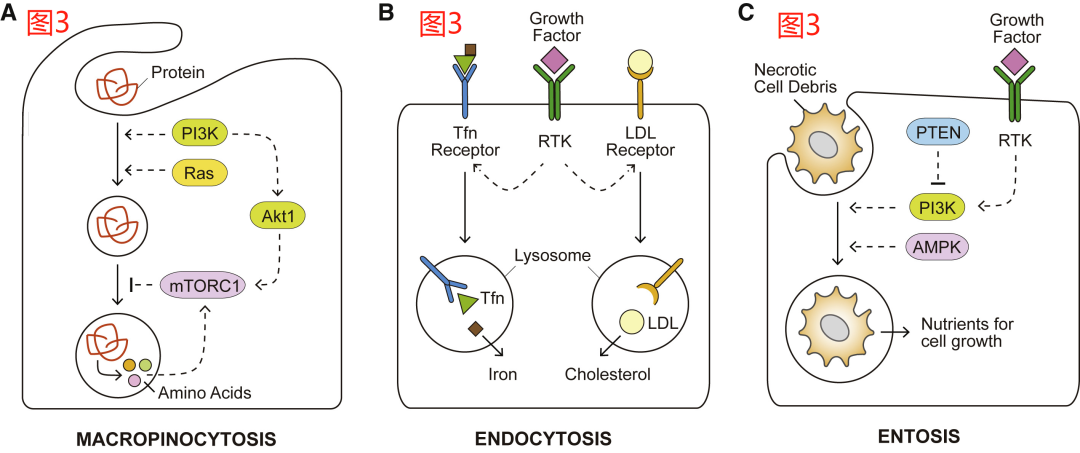
尽管自噬在细胞生理学中具有巨大且多层次的重要性,但有一件事是自噬无法做到的,那就是为细胞增殖提供足够的材料来产生新的生物量。然而,哺乳动物细胞也被发现可利用其溶酶体以一种单细胞真核生物的方式来无差别地消化细胞外来源的大分子物质。这是通过膜突起的延伸和巨胞饮体(macropinosomes)的形成来实现的,这一过程被称为巨胞饮(macropinocytosis)。以这种方式吞噬的大分子随后被运送到溶酶体中进行降解。位于生长因子信号下游的PI3K,它的激活是启动膜褶皱(membrane ruffling)和巨胞饮体关闭所必需的。在癌症中观察到的基因改变,如Ras GTPases的致癌突变形式,可增加巨胞饮发生的速度和体积,而与生长因子的刺激无关。因此,携带致癌性Ras突变的癌细胞显示出通过巨胞饮作用利用细胞外蛋白的能力增强,从而能够在氨基酸耗尽的TME中维持细胞的生存和增殖(图3B)。
内化的巨胞饮体受到额外的调控,因为它们可将“货物”送到溶酶体进行降解。活跃的mTORC1复合体可抑制作为氨基酸来源的细胞外蛋白质的分解;相应地,在面临营养物质耗尽的条件下,抑制mTORC1的活性有利于Ras转化细胞在氨基酸耗尽的条件下利用细胞外白的蛋白维持生存和生长。一致的是,当游离氨基酸丰富时,AKT1对mTORC1的激活会抑制对内化白蛋白的利用(图3A)。相比之下,PI3K活性下游的小GTPases Rac1和磷脂酶C(PLC)可以促进细胞的生长,而这种生长依赖于通过巨胞饮作用分解细胞外的蛋白质。
虽然对巨胞饮作用利用血清白蛋白作为氨基酸来源的研究最多,但其他细胞外大分子也可以被巨胞饮作用所吸收。胰腺导管腺癌(PDAC)细胞通常存在于含有致密胶原网络的促纤维化微环境中。据报道,PDAC细胞能够在葡萄糖或谷氨酸有限的条件下,部分通过巨胞饮作用来利用细胞外的胶原蛋白。脯氨酸是胶原蛋白的一个主要氨基酸成分。因此,PDAC细胞内化的胶原蛋白可以为细胞提供脯氨酸的来源,它可以被脯氨酸脱氢酶(PRODH)进一步分解,作为能量生产的电子来源和TCA循环底物。除了利用蛋白质外,还发现巨胞饮作用还参与清除其他细胞外成分,如外泌体和溶血磷脂。
值得注意的是,在缺氧条件下,细胞外脂质的清除率变得更高,这有助于恢复细胞膜中饱和(SFA)与单不饱和脂肪酸(MUFA)的平衡。事实上,将双键引入酰基链,将SFA分子转化为MUFA对应物,是由硬脂酰-CoA去饱和酶1(SCD1)驱动的,它需要分子氧作为电子接受体。低氧条件抑制了SCD1,从而改变了SFA/UFA的比例,有利于SFA。这反过来又改变了细胞膜的生物物理特性,使其流动性和柔韧性降低。ER膜似乎特别受到SFA/MUFA不平衡的影响,部分原因是与其他细胞膜结构相比,ER膜的形状复杂。事实上,缺氧相关的SCD1抑制被发现可在具有高活性mTORC1的细胞中引发ER应激,并因此产生高翻译负荷。因此,当细胞的脂肪酸去饱和能力因缺氧而受到影响时,吸收细胞外脂质或在其他情况下从内部脂质储存库中释放脂质等适应性措施可以维持脂肪酸平衡。
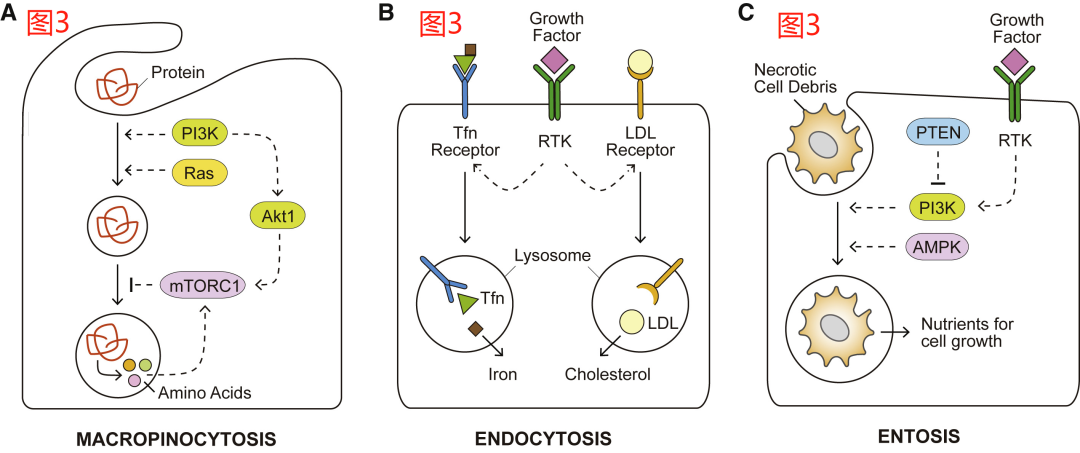
除了通过巨胞饮作用清除大量营养物质的模式外,细胞还可以通过选择性的、受体介导的内吞作用从细胞外环境中内化一些大分子。例如,低密度脂蛋白(LDL)是细胞外胆固醇的主要载体。哺乳动物细胞通过质膜上的低密度脂蛋白受体捕获低密度脂蛋白,这些受体被转运到内溶酶体区,释放细胞膜组装所需的胆固醇(图3B)。癌细胞中RTK-PI3K-AKT1信号的异常激活被发现可部分通过mTORC1和SREBP的活性来上调LDL受体。此外,外源性胆固醇可以通过清道夫受体B1(SCARB1)以其高密度脂蛋白(HDL)形式进入细胞。透明细胞肾细胞癌被发现是胆固醇营养缺陷型,主要依靠SCARB1介导的HDL输入作为胆固醇的来源。此外,铁对于各种代谢活动是必不可少的,如血红素合成基团和铁硫簇的生物合成。转铁蛋白(Tfn)受体对细胞外铁载体Tfn的内吞作用是细胞内铁的主要来源,在调节铁依赖的细胞铁死亡过程中至关重要。
最后,细胞能够吞噬整个活细胞和/或濒死细胞,这种非吞噬过程被称为“细胞套亡”(entosis),可在包括葡萄糖缺乏在内的代谢应激下被诱发。同样,据报道,PTEN缺陷的前列腺癌细胞以AMPK依赖的方式,通过巨胞饮作用清除坏死细胞碎片(图3C)。与可溶性蛋白质的吞噬类似,被吞噬的活细胞或死细胞的营养物质可以在溶酶体消化系统中回收,以进一步支持细胞增殖。
扩大对电子受体的需求
通过糖酵解和TCA循环的碳代谢需要NAD+作为电子受体。转化细胞的糖酵解活动的增强使其依赖于NAD+的不断再生。Warburg效应是合成代谢活跃的细胞通过LDH介导的反应从NADH再生NAD+时的一个显著特征。因此,乳酸分泌是表明高糖酵解率的癌细胞特征。以NADH的形式存在的胞质电子也可以通过专用的电子穿梭体,如苹果酸-天冬氨酸分流器和甘油磷酸酯分流体,被输送到线粒体,以促进ETC中NAD+的再生(图4)。最近,MCART1(由SLC25A51编码)被确定为线粒体的NAD+转运体,其功能也是在细胞质和线粒体之间传递NAD+和NADH。
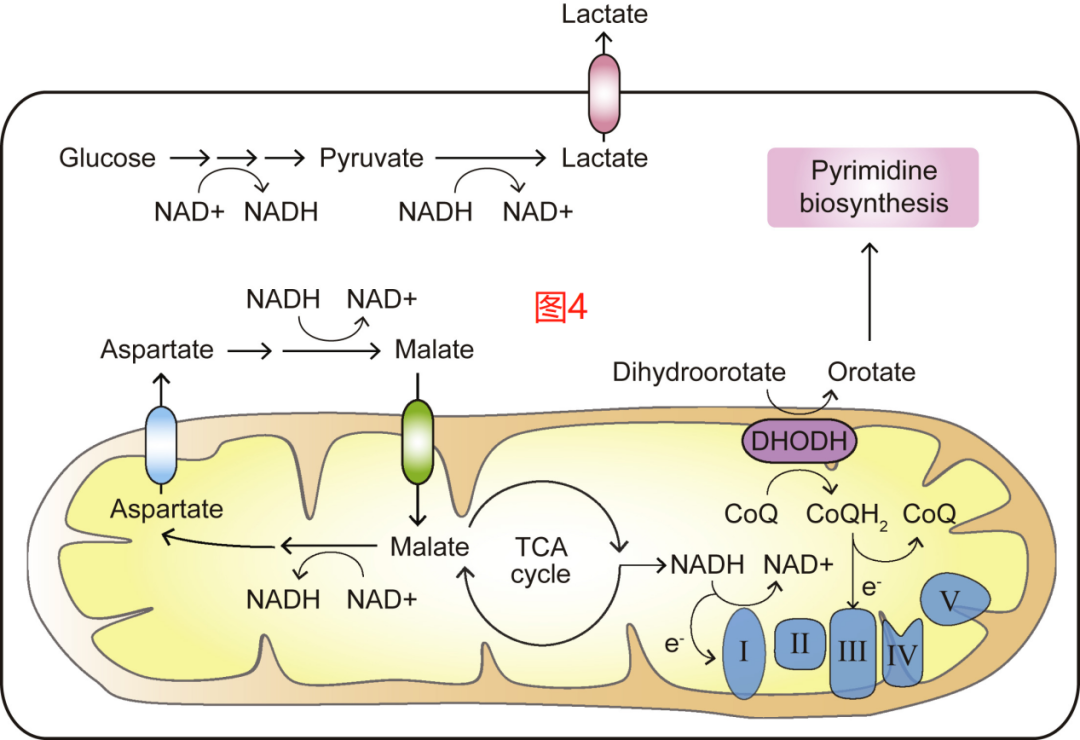
剖析线粒体呼吸在支持合成代谢和细胞增殖中的具体作用,发现ETC的一个基本功能是再生NAD+以支持天冬氨酸的生物合成。事实上,天冬氨酸的生产可能会因ETC的复合体I或复合体III的抑制而受到抑制。相反,补充电子受体底物,如丙酮酸或α-酮丁酸,有助于增加NAD+/NADH的比例,恢复天冬氨酸的生物合成,即使在ETC被抑制的细胞中,也能促进细胞增殖。天冬氨酸的产物天冬酰胺的可用性也受到ETC抑制剂的影响。有趣的是,当ETC抑制剂以低剂量应用时,天冬酰胺的补充足以恢复核苷酸的合成和细胞增殖,但不会“挽救”细胞天冬氨酸的丰度。
ETC的电子通量不仅有助于再生NAD+和FAD,而且还可通过二氢乳清酸脱氢酶(DHODH)的活动将线粒体的能量产生能力与嘧啶的生物合成直接联系起来。为此,ETC复合体III对可氧化泛醌使其再生,成为支持DHODH功能的关键电子受体,从而支持增殖细胞的嘧啶合成(图4)。综上所述,增殖期的癌细胞对电子受体的再生有着持续的高需求,以合成蛋白质和核酸生物合成的前体。
对氧化应激保护机制的依赖性增强
失调的合成代谢加上与TME相关的限制,使转化细胞会暴露于水平更高的还原性应激(例如,高NADH,低氧)。事实上,随着增殖的癌细胞输入更多的碳源,NADH的供应可能会增加,超出ETC处理的能力,特别是如果氧气或ADP受限时。上文概述了一些降低NADH/NAD+比率以避免还原性应激的途径。癌细胞也受到了氧化应激的影响。在环境氧化剂如H2O2、NO甚至氧气的存在下,大分子氧化物有能力损害细胞内的成分,如脂质,这反过来会导致细胞丧失完整性。癌细胞依靠多种抗氧化防御机制,包括谷胱甘肽(GSH)系统和硫氧还蛋白(TRX)系统,来保护自己免受这种氧化损伤。因此,在肿瘤中经常发现有利于这些保护机制的遗传和代谢改变。
NRF2(由NFE2L2编码)转录因子及其E3泛素连接酶KEAP1的突变形式存在于实体瘤中,在肺癌中最为普遍,肺癌的特点是氧化应激水平升高,部分原因是肺组织中存在高水平的细胞外氧。NRF2和KEAP1突变都会破坏KEAP1与NRF2蛋白的结合,使后者成为降解的靶标。这反过来又会增加NRF2蛋白水平,促进NRF2驱动的转录程序,导致参与GSH生物合成的酶上调表达(图5)。而GSH增加需要更多的限制性底物和半胱氨酸的供应。因此,NRF2驱动的转录反应也增加了xCT(由SLC7A11编码)的表达,促使半胱氨酸的氧化形式,即半胱氨酸,进入细胞。氧化应激时细胞内半胱氨酸储存的消耗导致其水平下降,并被GCN2激酶所感知。GCN2则反过来触发了ATF4(activating transcription factor 4)的积累。ATF4的增加进一步促进xCT的表达,促进胱氨酸的吸收。当细胞外胱氨酸的水平被耗尽时,就像在TME中经常看到的那样,ATF4还可以通过转硫途径上调参与从蛋氨酸从头合成半胱氨酸的酶(图5)。
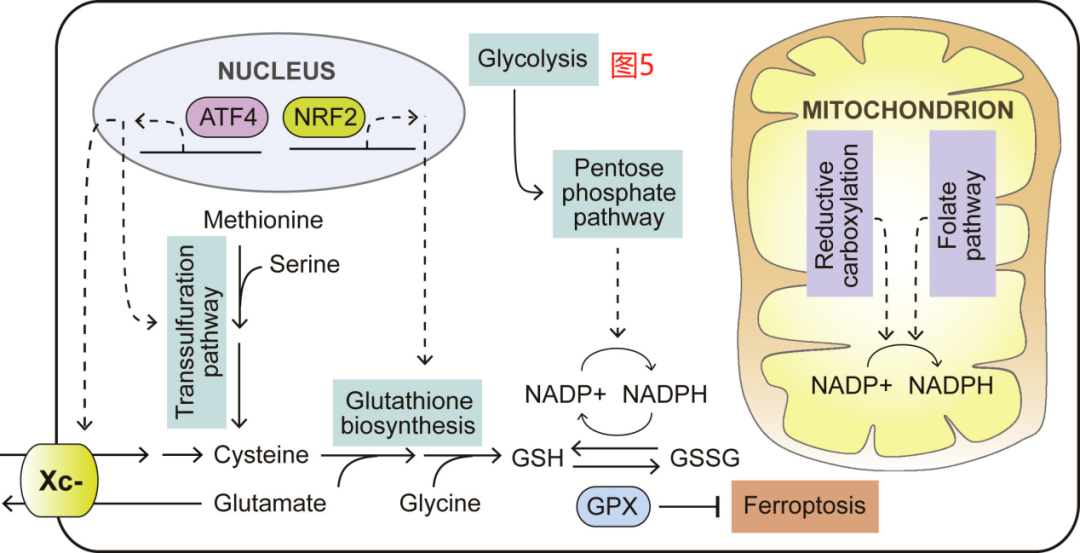
除了上调产生GSH,转化细胞还经常通过改变其代谢来应对氧化应激,以保持这些可清除活性氧(ROS)的分子的抗氧化能力。癌细胞在肿瘤发生过程中经常遇到的一个挑战是从ECM脱离而引起的氧化应激。研究发现,受体酪氨酸激酶和下游的PI3K途径的激活,可通过增加葡萄糖的摄取及其在PPP中的利用来支持NADPH从NADP+中再生,从而促进非锚定生长(图5)。
RTK驱动的IDH1的酪氨酸磷酸化也可以调节NADPH在胞质和线粒体之间的穿梭。据研究报道,IDH1的酪氨酸磷酸化有利于谷氨酸衍生的α-酮戊二酸的还原性柠檬酸,从而消耗胞质的NADPH。柠檬酸盐产生后被逆行转运到线粒体,在那里IDH1的对应物IDH2可以将输入的柠檬酸盐转化回α-酮戊二酸,从而在线粒体区间再生NADPH。也有报道称,在ETC受损的细胞中,IDH2会消耗线粒体NADPH来催化α-酮戊二酸还原成柠檬酸盐,形成反向循环。
当转移的细胞进入血液循环时,暴露在一个含氧量更高的环境中可能会进一步提高氧化应激负担。循环肿瘤细胞用来对抗氧化应激的一种适应性方法是依靠循环肿瘤细胞的聚集倾向。因此,聚集在一起的细胞在其核心部分产生了一个缺氧口袋,通过HIF1α的积累,它可能会限制碳的氧化代谢,而有利于呈氧化还原中性的糖酵解途径,以及触发线粒体自噬来清除氧化损伤的线粒体。
体内肿瘤发生模型的研究进一步支持了强大的ROS防御对促进转移的重要性。在黑色素瘤模型中,发现循环肿瘤细胞和来自转移性结节细胞的氧化应激水平比皮下肿瘤更高;相应地,通过一碳途径的较高通量和乳酸摄取增加被发现是成功转移生长的代谢决定因素。这两种适应性都有助于增强细胞的NADPH生产能力,一是通过一碳途径介导的NADPH生产,二是通过节省葡萄糖碳元素用于PPP的氧化分支反应(图5)。与这些发现不同的是,来自其他致瘤环境的研究结果显示,ROS水平的升高实际上可能会促进转移。来自小鼠胰腺癌模型的研究表明,TIGAR表达的缺失,会抑制细胞使用PPP作为NADPH来源的能力,增加细胞的ROS水平,促进细胞的侵袭性,并促进肺转移的定植。产生的ROS水平或位置的不同,或者细胞谱系背景本身是否促成了这些不同的结果,还有待进一步阐明。
氧化应激,特别是细胞脂质成分的氧化损伤,可导致细胞铁死亡。最近的研究揭示了细胞代谢活动对铁死亡的复杂调节模式,包括铁的储存和释放、硒的平衡、磷脂过氧化、半胱氨酸和GSH的可用性。有趣的是,在进入血液环境之前,淋巴系统的转运被发现可促进黑色素瘤的转移,因为它可使黑色素瘤细胞具有更好的能力来防御富含铁和氧的血液环境中较高的铁死亡风险。这种通过淋巴环境转运的保护作用可能存在多种机制,包括产生抗铁死亡性质的油酸和谷胱甘肽,这两种物质在淋巴中特别丰富。油酸在铁死亡过程中的保护作用是一个还需要进深入研究的课题,但至少部分可能是由于油酸,作为一种MUFA,与细胞膜上的PUFA竞争,从而减少胞膜上的PUFA。事实上,由于PUFA在其化学结构中含有多个双键,所以会经受铁死亡所带来的氧化损伤,并对膜的功能和细胞完整性及生存带来负面影响。
在临床前研究中,针对保护细胞免受铁死亡影响的代谢机制已成为一种颇有希望的治疗干预措施。例如,研究发现阻断SREBP介导的脂肪生成可与干扰GPX4防御机制起协同作用,诱导PI3K突变的癌细胞发生铁死亡。除了GPX4依赖的铁死亡防御机制外,最近还发现FSP1可从泛醇中产生泛醌,作为ROS清除剂,从而揭示了不依赖于谷胱甘肽的铁死亡防御机制。相应地,DHODH介导的泛醌合成也被报道为GPX4低表达癌细胞中的可靶向弱点。综上所述,肿瘤发生的过程往往使癌细胞暴露在较高的氧化应激水平中,这在未来有可能会被用来作为治疗性地方向。
对氮的需求增加
碳源可以作为生物合成的结构中间体,也可被氧化以产生能量或支持NADPH生产。相反,还原性的氮可被用于大分子合成或转化为废物。氮需求的增加与增殖有着特殊的联系。因此,癌细胞的增殖失调会优先消耗微环境中支持生长的首选氮供体,最突出的就是谷氨酰胺。因此,为了在用尽首选的外源性还原氮的供应后仍能维持生长和增殖,癌细胞必须依靠适应性,使它们能够使用和重复使用(reuse)替代氮源。
谷氨酰胺是动物中首选的供氮营养物质。鉴于对它的高需求,谷氨酰胺的水平在循环中维持在大约600-700μM,几乎比其他氨基酸高一个数量级。在受伤或全身感染期间,循环中的谷氨酰胺会被耗尽;此外,在实体瘤和愈合的伤口中都能观察到谷氨酰胺水平的局部耗竭。例如,最近的一项研究发现同种异体(allografts)乳腺肿瘤间质液中的游离谷氨酰胺水平低至100μM。然而,并不是所有肿瘤都会谷氨酰胺水平受限(glutamine-limited)。例如,在一些基因工程的小鼠肿瘤模型中,肿瘤间质液中的谷氨酰胺浓度与血液循环中相同。也有报道称,肿瘤可通过谷氨酰胺合成酶(也称为谷氨酸-氨连接酶,或GLUL)驱动的反应,从谷氨酸和游离铵中重新产生谷氨酰胺(图6A)。一些与肿瘤发生有关的转录因子,包括c-myc和Yap,可以在各种细胞背景下上调GLUL的表达。除了在基因表达水平上受到调节外,谷氨酰胺的耗竭也会导致在蛋白质水平上积累GLUL。事实上,在基因工程小鼠模型中,肿瘤特异性GLUL缺失被证明可以显著延缓肿瘤的形成。
在缺氧条件下,当氧分子水平低于维持电子流通过ETC从NADH再生为NAD+所需的水平时,对谷氨酰胺的需求会进一步上升。在这种代谢情况下,谷氨酰胺衍生的α-酮戊二酸可利用IDH1催化反应的可逆性(称之为还原性羧化反应)为癌细胞提供柠檬酸盐的来源,以支持脂肪的从头合成。据研究报道,由于EGFR驱动IDH1的Y42和Y391酪氨酸残基发生磷酸化,突变型EGFR驱动的非小细胞肺癌细胞系甚至可在氧气存在的情况下也能参与从α-酮戊二酸到柠檬酸的还原。这种适应虽然提高了对谷氨酰胺的需求,但也可能有助于减少TCA循环产生的还原性压力。
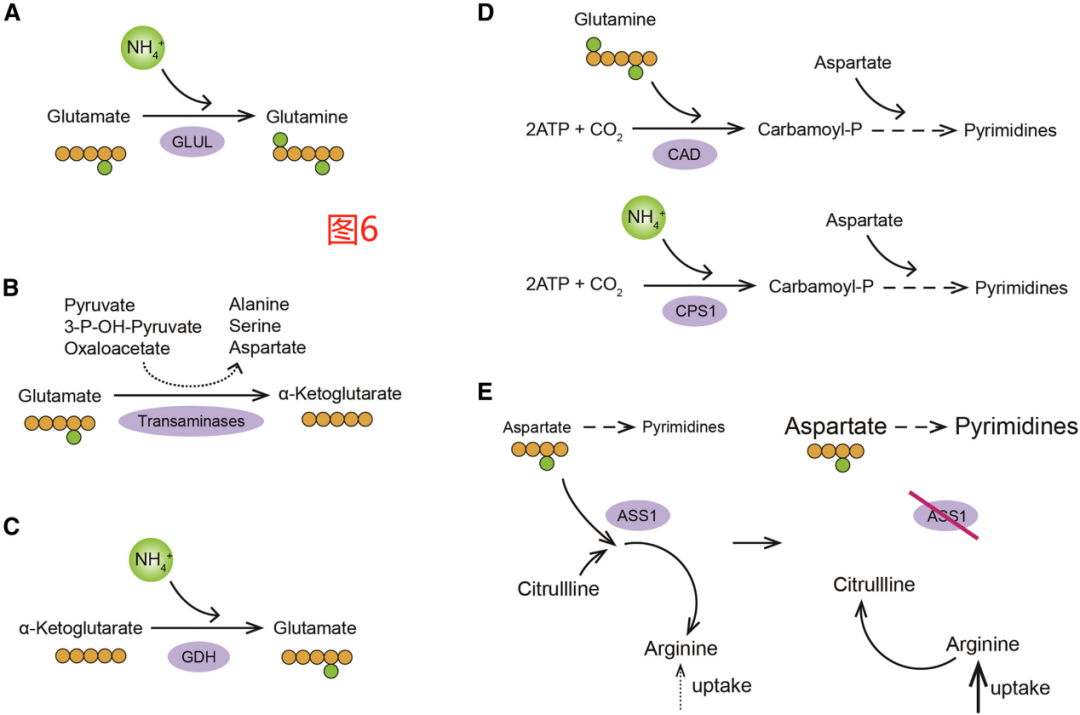
细胞在将谷氨酸转化为α-酮戊二酸时有不止有一种选择。其中一个选择是通过谷氨酸脱氢酶(GDH)催化的反应将谷氨酸氧化成α-酮戊二酸,从而释放出自由铵。另外,α-酮戊二酸可以通过转氨作用产生,其中谷氨酸的氨基通过转氨酶转移到酮酸受体上,产生非必需氨基酸,如天冬氨酸、丝氨酸和丙氨酸(图6B)。值得注意的是,研究发现增殖期的乳腺上皮细胞倾向于转氨路径而不是GDH驱动的脱氨路径,而静止期的细胞则倾向于选择GDH路径。这种适应可能会使增殖细胞能最大限度地利用可用的氨基酸储备,以最佳方式支持非必需氨基酸的合成。
TCA循环产生的α-酮戊二酸也可以利用GDH催化反应可逆性的产生谷氨酸。TME中经常会积累铵,浓度甚至可达3mM。在铵积累的这种情况下,研究发现细胞可利用GDH驱动反应的相反方向,这使得它们能够产生谷氨酸并利用它来促进其他非必需氨基酸的合成(图6C)。
携带特定致癌病变的转化细胞所特有的一种铵清除适应性,这一特性涉及到氨甲酰磷酸盐合成的非经典路线,即合成嘧啶碱基的起始步骤。增殖细胞通过多功能CAD酶合成氨甲酰磷酸盐,该反应需要谷氨酰胺作为酰胺供体。然而,人们发现携带突变的KRAS等位基因和肿瘤抑制因子LKB1缺失的非小细胞肺癌细胞可表达一种不同的氨甲酰磷酸盐合成酶,即CPS1。值得注意的是,相比CAD酶,CPS1以一种更经济的方式生产氨甲酰磷酸盐:CAD需要谷氨酰胺作为氮源,而CPS1可以使用铵离子作为替代(图6D)。正常情况下,CPS1仅在肝脏中表达,并通过尿素循环促进铵的清除。然而,在LKB1缺失的情况下,CPS1异常上调,并被癌细胞用来完成关键的合成作用。选择放弃“昂贵的”CAD催化反应,而选择更经济的CPS1催化路线,可以使细胞降低一部分对谷氨酰胺需求,并释放出剩余的谷氨酰胺可用于其他生物合成的需求。
一些肿瘤细胞也可以通过减少天冬氨酸进入尿素循环的通量来增加嘧啶的合成(图6E)。大多数正常细胞可以利用天冬氨酸来启动清除尿素循环中多余的还原氮,该反应由ASS1催化。然而,在许多实体瘤中,包括胰腺癌、前列腺癌和黑色素瘤,都失去了ASS1的表达,这其中主要是由于表观遗传沉默。与缺氧相关的细胞外环境酸化可以以一种非细胞自主的方式进一步促进ASS1的下调。如果不消耗天冬氨酸来启动清除过量的还原氮,增殖的癌细胞就可以将更多可用的天冬氨酸用于嘧啶的生物合成。然而,ASS1表达缺失是有代价的,因为它妨碍了细胞在尿素循环中从瓜氨酸再生为精氨酸的能力,使它们更容易受到外源性精氨酸耗竭的影响。因此,目前正在探索耗竭精氨酸的治疗策略,如利用PEG化重组精氨酸酶,作为潜在的代谢治疗干预措施。此外,ASS1或其他尿素循环酶下调的癌细胞会表现出典型的嘧啶/嘌呤比例失衡,而这又与该癌症亚型中较高的突变负荷有关,这一特征使转化细胞对抗肿瘤免疫攻击更加敏感,从而容易受到免疫检查点抑制剂疗法的影响。
代谢适应的异质性
癌症可能产生于各种组织和细胞类型,并在代谢方面有着明显的生理差异;此外,肿瘤也可能有不同的致癌病变组合。这些因素的组合可以帮助形成具有独特代谢特征的肿瘤。当癌细胞离开原发组织并定植于其他器官时,它们可能会受到转移所在器官组织微环境的制约。因此,与癌症相关的代谢特征多样性是由癌细胞的内在因素和它们所在代谢环境的具体情况共同决定的(图7)。
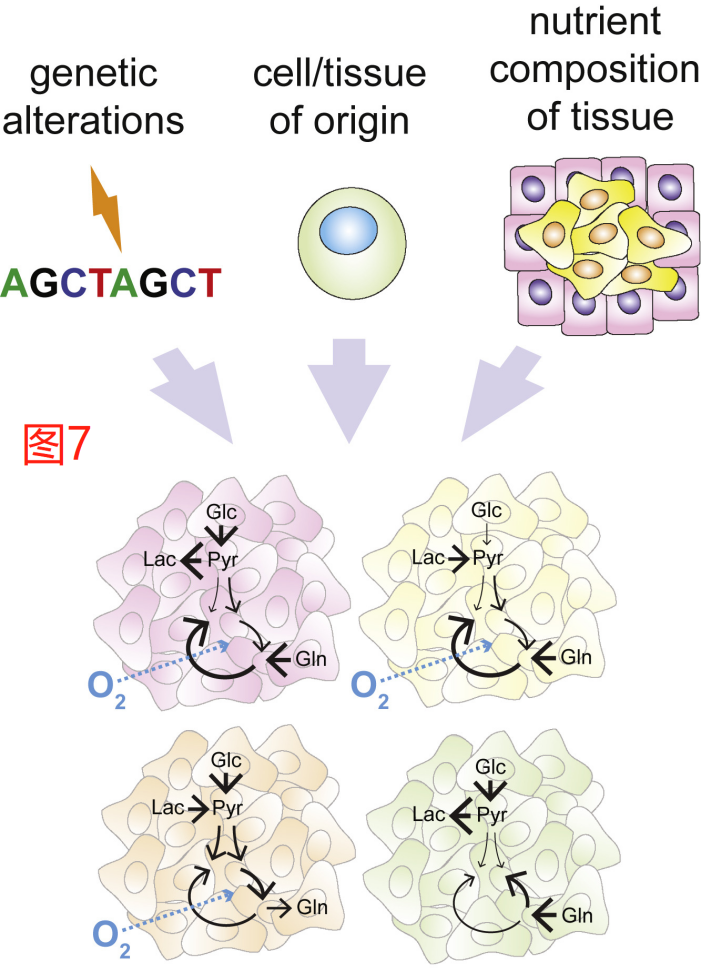
癌细胞所携带的一些致癌病变可直接以促进肿瘤发生的方式调节特定的代谢途径。目前已有多个例子,包括VHL缺陷型肾细胞癌中HIF1α和HIF2α转录因子稳态(stabilization)所造成假性缺氧状态。在失去KEAP1抑癌因子表达的肿瘤中,会更需要依赖于谷氨酰胺水解的谷氨酸供应以促进胱氨酸的输入,并在EGFR转化的非小细胞肺癌亚型中,α-酮戊二酸的还原代谢被激活。即使在相同组织起源的背景下,不同癌基因的表达有时不仅会导致不同的,甚至可能是相反的代谢结果。例如,c-Met受体酪氨酸激酶转化的肝脏肿瘤被证明会上调GLUL并积累谷氨酰胺,而相同起源的c-myc转化的肿瘤则被发现会从其环境中消耗谷氨酰胺。
起源组织是另一个决定癌细胞如何参与其代谢途径并支持生长的重要因素。如上所述,由转基因c-myc的表达来驱动肝脏肿瘤消耗谷氨酰胺;相反,c-myc驱动的肺部肿瘤发生则与GLUL的表达和谷氨酰胺的合成有关。同样,由KRAS癌基因和TRP53失活联合驱动的肺肿瘤的发生则依赖于支链氨基酸(BCAA)的分解代谢作为营养物质,而由相同转化基因组合驱动的胰腺肿瘤则不分解BCAA。
对人类肿瘤和相应正常组织转录组的进一步分析则证实了来自基因工程动物肿瘤模型的证据。这些研究显示,转化细胞仍保留了其原发组织所特有的代谢基因表达模式。因此,尽管会积累一些基因扰动,肿瘤仍会保留其原发组织的原有代谢特征。然而,在转化过程中,这些原先存在的代谢特性被重新用来支持合成代谢。在一些肿瘤中,这些先前存在的代谢表型在遗传上会被放大。例如,PHGDH是丝氨酸从头合成的限速酶,它的扩增经常出现在来自基底样乳腺上皮细胞亚型的肿瘤中,这些细胞具有PHGDH高表达的特点;同样,NARPT是驱动NAD+从头合成的酶,可以在NARPT高表达的癌症组织中发现NARPT扩增。相反,一些代谢酶在特定组织中充当真正的肿瘤抑制因子。例如,在起源于肝脏和肾脏的肿瘤中,都发生了限速酶FBP1的表达缺失,而这两种组织都存在糖异生作用。FBP1的缺失似乎起到了广泛的促肿瘤作用,其中包括促进有氧糖酵解,激活HIF1α转录因子,以及在肿瘤附近的其他细胞(如肝星形细胞)中培养促肿瘤特性的能力。
关于代谢适应异质性的一个突出例子是TCA循环中回补(anaplerosis)底物的特定偏好。两种截然不同的回补策略在转化细胞中占主导地位,一种是在谷氨酰胺分解代谢产生α-酮戊二酸的点进行TCA循环的再补充;另一种是通过丙酮酸羧化酶(PC)驱动的丙酮酸羧化反应来补充TCA的中间物质草酰乙酸。
尽管谷氨酰胺介导的回补反应在培养的细胞中几乎是普遍存在的,但当谷氨酰胺耗尽时,细胞可以重新调整其碳流方向,转为PC驱动的回补反应。例如,用含有13C碳同位素的葡萄糖输注进行的体内研究表明,对特定回补路径的偏好取决于肿瘤类型。事实上,胰腺和肺部肿瘤都倾向于由PC介导的回补路径,并且需要它来支持生长。相反,对结直肠来源的异种移植物的13C碳输注研究显示,这些肿瘤可利用谷氨酰胺作为其回补的来源。对特定回补策略的依赖可能进一步体现了原发组织的代谢特征和及其肿瘤之间的联系。例如,肺部肿瘤和正常肺组织都不是谷氨酰胺的净(net)消耗方,这种模式也与肺组织在循环中的谷氨酰胺水平受到影响的情况下为人体提供谷氨酰胺从头合成的作用相一致。
在新定植的器官中恢复生长,需要转移性癌细胞适应与其原发组织不同的营养微环境。根据不同的环境,这种适应可能需要利用转移部位具有的丰富底物,同时适应其他营养物质的有限性。例如,与其他转移生态位相比,中枢神经系统的营养物质(如脂质)是相对匮乏的。因此,转移到大脑的肿瘤会依赖脂肪酸的从头合成。此外,从头合成天冬酰胺的能力也被证明是乳腺癌细胞转移到肺部所必需的,但对原发肿瘤的生长却不是如此。
不仅是限制,而且某些营养物质的过剩也有助于塑造转移癌细胞的代谢特征。例如,转移到肺部或骨骼的乳腺肿瘤高度依赖PGC1α的表达和线粒体的碳代谢途径,而与此相反,它们在肝脏中的对应物则是高度糖酵解的,并依赖PDK1的高表达,从而减少了进入线粒体的葡萄糖碳。肝转移瘤的高度糖酵解性质可能表明细胞会利用肝组织中丰富的葡萄糖供应。相反,转移到肝脏的结直肠肿瘤显示出代谢果糖的能力,果糖在肠道中含量很丰富。为此,来自结直肠肿瘤的肝脏转移克隆会被选择出表达高水平的醛缩酶B(ALDOB),这使得它们能够利用果糖作为糖酵解底物。同样,与原发性肿瘤相比,转移到肺部的乳腺肿瘤细胞则会提高对丙酮酸作为回补底物的使用,而使它们能够利用肺组织中的高丙酮酸水平。这一发现表明,不仅是原发性的肺肿瘤,转移到肺部的肿瘤也能利用肺组织中含量较高的丙酮酸,也进一步强调了周围环境的营养成分在塑造肿瘤代谢特征方面的作用。
代谢物可驱动信号事件的改变
各种调节通路的活性可以受到特定代谢物的可用性和丰度的影响。例如,细胞可利用AMP/ATP比值并通过激酶(如AMPK)来发布信号事件。谷氨酰胺和糖酵解中间物,6-磷酸果糖,是氨基己糖生物合成途径的基本底物。这些代谢物的水平可直接影响到UDP-N-乙酰葡萄糖胺(UDP-GlcNAc)的产生,它对蛋白质糖基化和某些生长因子受体表面的表达至关重要。此外,O-linked GlcNAc转移酶(OGT)在多种癌症类型中通常表现为上调,并能通过参与信号转导的蛋白质丝氨酸/苏氨酸位点上的稳定糖基化来维持致癌信号通路。
营养供应也可影响DNA和组蛋白修饰,从而通过表观遗传上调节基因表达。乙酰-CoA和S-腺苷蛋氨酸(SAM)分别是乙酰转移酶和甲基转移酶的必要底物,均可参与组蛋白的翻译后修饰,并调节相关DNA的转录。其他可修饰组蛋白和非组蛋白的代谢物包括琥珀酰-CoA、巴豆酰-CoA和乳酸,尽管它们的生理学意义仍有待进一步确定。在组蛋白去乙酰化过程中,NAD+是支持Sirtuin家族去乙酰化酶起催化反应的必要反应物。同样,组蛋白和DNA的甲基化标记也可以被逆转;α-酮戊二酸是双加氧酶功能所必需的,包括TET DNA羟化酶/去甲基化酶和JMJD组蛋白去甲基化酶(图8)。这些依赖于代谢的染色质修饰过程紊乱也可以促进肿瘤的发生。由于与α-酮戊二酸的结构相似,琥珀酸盐和富马酸盐作为依赖于α-酮戊二酸的双加氧酶的竞争性抑制剂。琥珀酸脱氢酶(SDH)的突变在家族性副神经节瘤中多见,富马酸水合酶(FH)作为抑癌因子,通常在子宫肌瘤和肾细胞癌中发生缺失。这些基因的癌症相关突变可分别导致积累琥珀酸盐和富马酸盐,以及抑制DNA和组蛋白去甲基化酶。同样,异柠檬酸脱氢酶1(IDH1)或IDH2的致癌突变在胶质瘤、急性骨髓性白血病(AML)、胆管癌和软骨肉瘤中也很普遍。突变型IDH可将α-酮戊二酸转化为D-2-羟基戊二酸(D-2-HG),D-2-HG可竞争性地抑制α-酮戊二酸依赖性的双加氧酶(图8)。因此,这些癌症类型往往表现为基因组高甲基化,并抑制细胞分化、促进肿瘤发生。D-2-HG对映体L-2-HG的积累则可以引发类似的双加氧酶抑制及与之相关的高甲基化表观遗传学特征。L-2-HG的积累与异柠檬酸脱氢酶的活性无关,而是由至少两种脱氢酶(特别是乳酸和苹果酸脱氢酶)底物特异性的低pH值相关变化所驱动,以及在肾细胞癌细胞中,L-2-HG脱氢酶(L2HGDH)的损失,而这是降低L-2-HG水平所必需的。
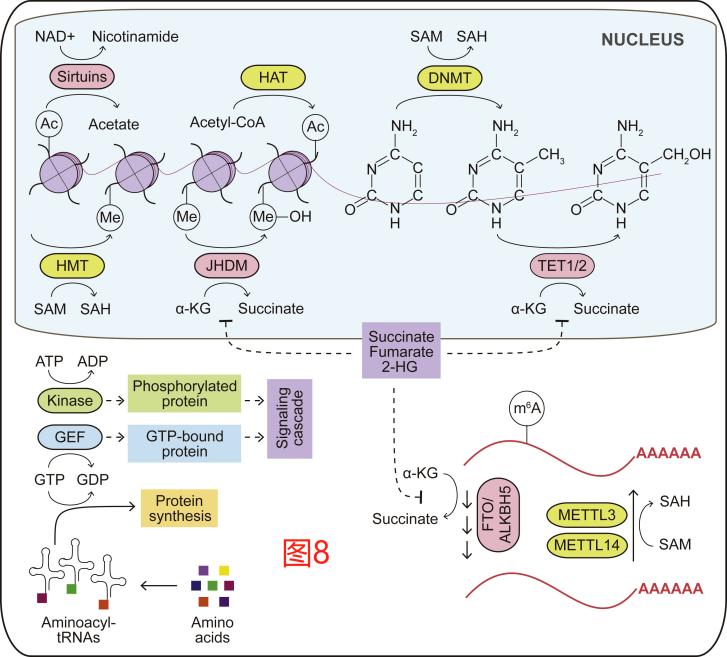
代谢物驱动的基因表达调节也延伸到了RNA修饰领域。限制蛋氨酸后,SAM与S-腺苷同型半胱氨酸(SAM/SAH)比例下降,也降低N6-腺苷甲基转移酶METTL16的活性,后者可甲基化mRNA并促进翻译。相反,生长因子或致癌信号下游的mTORC1激活则可以通过WTAP的表达和SAM的合成来刺激mRNA的m6A修饰,这反过来又可增强mRNA翻译而促进肿瘤细胞的生长。有趣的是,与DNA和蛋白质一样,RNA m6A去甲基化酶、FTO和ALKBH5是α-酮戊二酸依赖性的双加氧酶,α-酮戊二酸、铁和氧均可促进其活性,并被突变型IDH酶产生的D-2-HG所抑制(图8)。
蛋白质的合成也可不依赖于转录后的mRNA修饰而受到营养供应的调节。在氨基酸匮乏的环境中,谷氨酰胺特异性tRNA异构体变得选择性地不带电荷,而其他tRNA仍保留其同源氨基酸的电荷。带电的tRNA Gln减少后,可触发优先耗竭含有聚谷氨酰胺的蛋白质,而在占比很高的基因转录机制组件中含有聚谷氨酰胺的蛋白质,因此这可能会改变细胞的转录输出。综上所述,营养状态和代谢物丰度咳在多个层面上调节细胞内的信号级联和基因表达,因此可以促进肿瘤的发生。
与肿瘤微环境的代谢相互作用
后生动物(metazoan,可理解为多细胞动物)组织不仅包含有执行主要组织功能的细胞,还包括各种附属的或基质细胞类型,包括成纤维细胞、免疫细胞和内皮细胞。基质细胞发挥支持性作用,帮助维持组织的动态平衡,并在发生损伤时协调组织修复。转化细胞不会切断与这个支持网络的联系,相反,它们的促增殖状态可以影响基质细胞的行为,经常与基质细胞合作参与组织修复活动,从而促进癌细胞的生存和扩张/侵袭。虽然由多种生长因子和细胞因子所组成的复杂的信息传递系统与这种串扰有关,但人们也越来越认识到,在生长状态的肿瘤中,TME内的代谢因子在建立和维持伤口愈合样状态(wound healing-like state)方面也发挥着重要作用(图9)。
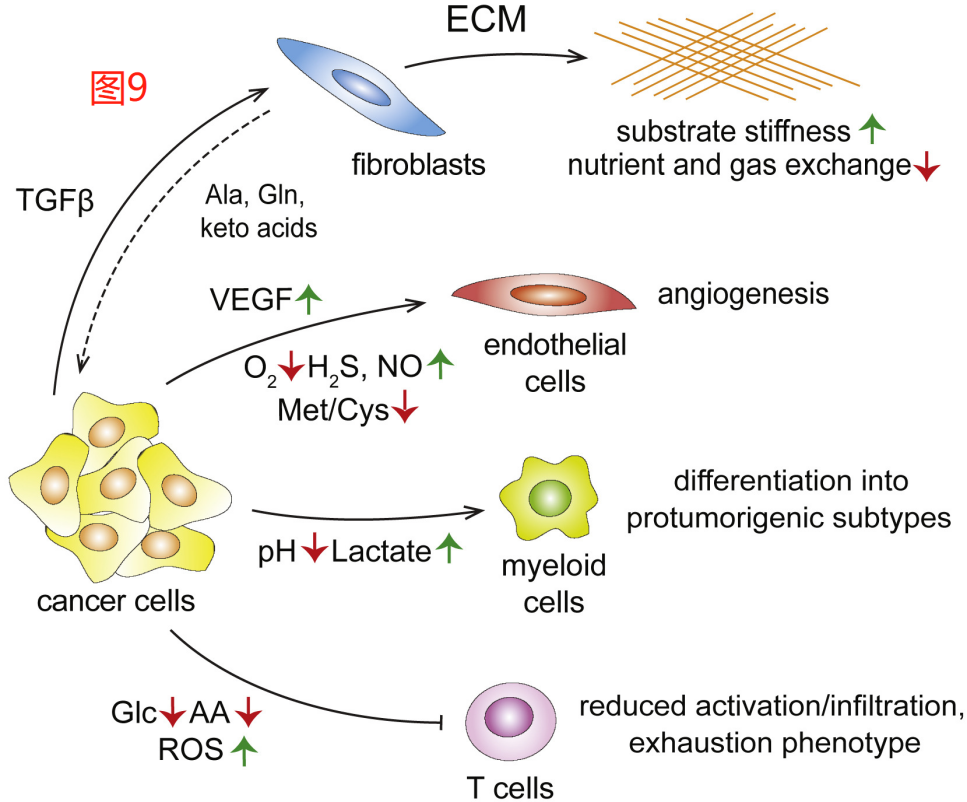
组织修复可以认为是一起庞大的(immense)合成代谢事件,而转化细胞并不是TME中唯一具有活跃合成代谢的细胞。事实上,在某些致瘤环境中,转化细胞在生长状态的肿瘤团块中只占少数。因此,基质成分的代谢活动可以作为TME中的一股强大的塑造力。然而,虽然转化细胞的代谢目标是复制增殖(build more of themselves),但肿瘤相关基质细胞的代谢表型则是由它们在组织稳态中发挥的有限作用所决定的。例如,许多实体瘤中包含有丰富的癌症相关成纤维细胞(CAFs),这些成纤维细胞是从局部组织的成纤维细胞群中招募来的,并合成大量的ECM。有趣的是,基质蛋白高度富含脯氨酸和甘氨酸,而肿瘤基质的产生刚好需要消耗大量的这些氨基酸。TGFβ是成纤维细胞产生ECM的有效诱导因子,被证明可以协调这些细胞的合成代谢过程,使其增加葡萄糖和谷氨酰胺的吸收,通过丝氨酸合成途径促进以葡萄糖合成甘氨酸,以及从谷氨酰胺产生脯氨酸。因此,CAFs的合成代谢可导致许多生长状态中的肿瘤发生葡萄糖和谷氨酰胺的耗竭。
在某些情况下,组织特异性成纤维细胞也可以通过合成和/或释放非必需氨基酸或必需氨基酸中的酮酸来为肿瘤提供营养支持。例如,卵巢CAFs可以合成和释放谷氨酰胺到TME,而胰腺癌相关的成纤维细胞,或星状细胞,则被发现可以为TME提供丙氨酸和BCAA的酮酸。为了支持在TME中生产和/或回收氨基酸和酮酸,似乎生长中的肿瘤中的一些成纤维细胞还会参与可溶性细胞外蛋白的巨胞饮作用,以帮助增加氨基酸的供应,用于合成基质并释放多余的氨基酸和酮酸到TME。
ECM致密晶格(the dense lattices)的沉积也可以改变TME的生物物理特性,导致细胞所固定的基质变硬。遇到坚硬而非柔软的基质可作为物理因素,改变所嵌入的癌细胞特性。过多的ECM堆积可能导致TME内现有的毛细血管网络崩溃,而进一步加剧(exacerbate)肿瘤和循环之间有限的溶质和气体交换。特别是与周围组织相比,实体瘤的氧气可用性较低,而可用性是塑造TME代谢特征的一个特别重要的参数。在其众多的影响中,氧气供应不足会促进葡萄糖的消耗及其向乳酸的转化。另外,由于依赖谷氨酰胺的还原羧化作用而增加了谷氨酰胺的消耗,使得肿瘤细胞外环境酸化,并导致表观遗传方面的变化。
富含乳酸的缺氧生态位可以诱导常驻的固有免疫细胞如II型巨噬细胞释放VEGF,这是一种可刺激内皮细胞募集和新毛细血管生长并分支的生长因子。除VEGF外,内皮细胞还将一些与TME相关的代谢刺激物整合到细胞的活动中。在促进血管生成的代谢刺激物中,也包括气体递质的积累,如精氨酸衍生的NO和半胱氨酸衍生的硫化氢,以及TME中氨基酸的消耗。综上所述,塑造TME的刺激因素及其影响的多样性导致形成了一种复杂的动态情况,其中多种与TME相关因子的活动可有助于消耗或恢复对肿瘤的营养供应。
对于效应性T细胞这种处于抗肿瘤免疫最前沿的免疫细胞群说,TME营养枯竭的代谢状况尤其具有限制性。在抗原刺激下,T淋巴细胞从静止状态转换为显著的合成代谢状态,这种适应性为其增殖和分化为杀伤肿瘤的效应细胞提供了动力。因此,相比于其他的细胞类型,营养物质的枯竭更容易破坏T细胞的激活和功能。例如,T细胞显著依赖于吸收外源性非必需氨基酸,如丝氨酸和丙氨酸,以代替从头合成这些营养物质的能力。T细胞的激活对谷氨酰胺和葡萄糖的耗竭也非常敏感。此外,效应T细胞对TME中氧化应激水平的增加也很敏感,并可引发所谓的衰竭表型。此外,转化细胞及其非转化的TME细胞,如II型巨噬细胞,可通过参与消耗用于维持T细胞效应功能所需的营养物质,进一步帮助抑制T细胞群。为此,癌细胞和肿瘤相关巨噬细胞都已被证明会分泌氨基酸代谢酶IDO1来降解色氨酸,这也进一步阻碍了T细胞的效应功能,并与葡萄糖的耗竭类似,也会导致出现具有免疫抑制性的Treg细胞群。
鉴于浸润有低效应(low effector)T细胞群的肿瘤对免疫检查点抑制剂疗法没有反应,调节TME的代谢状态,抑制促肿瘤的细胞群,增强T细胞的杀瘤活性,对提高免疫治疗的成功率和持久性(durability)具有重要意义。最近的一项研究表明,通过GLS1的缺失来阻断乳腺肿瘤细胞对谷氨酰胺的利用,可以使TME中的谷氨酰胺水平提高近一个数量级,从而促进T细胞的抗氧化能力,并增强其在肿瘤中的浸润。同样地,介导色氨酸降解的IDO1抑制剂也被报道具有抑制肿瘤的作用。
综上所述,TME代表了一个复杂的代谢生态系统,其中多种代谢活跃的细胞类型有助于肿瘤特异性代谢环境的出现,反过来还能调节TME细胞成分的行为并促进肿瘤的生长。尽管研究已发现了肿瘤各组成部分之间的许多代谢相互作用,但TME代谢经济的完整规则仍有待阐明。例如,最近在结直肠癌小鼠模型中进行的体内代谢示踪实验结果显示,TME的细胞对营养物质的利用并不均衡,例如转化细胞是谷氨酰胺的主要消费者,但绝大部分的葡萄糖被髓系细胞(如巨噬细胞)所消耗。最后,在支持转化细胞合成代谢的TME中,有新的细胞类型陆续被添加到名单中来。这些细胞类型包括有癌症相关脂肪细胞,它可为黑色素瘤提供脂肪酸,以及肿瘤相关神经元,它可为胰腺癌细胞提供额外的丝氨酸来源。
融入全身的代谢经济
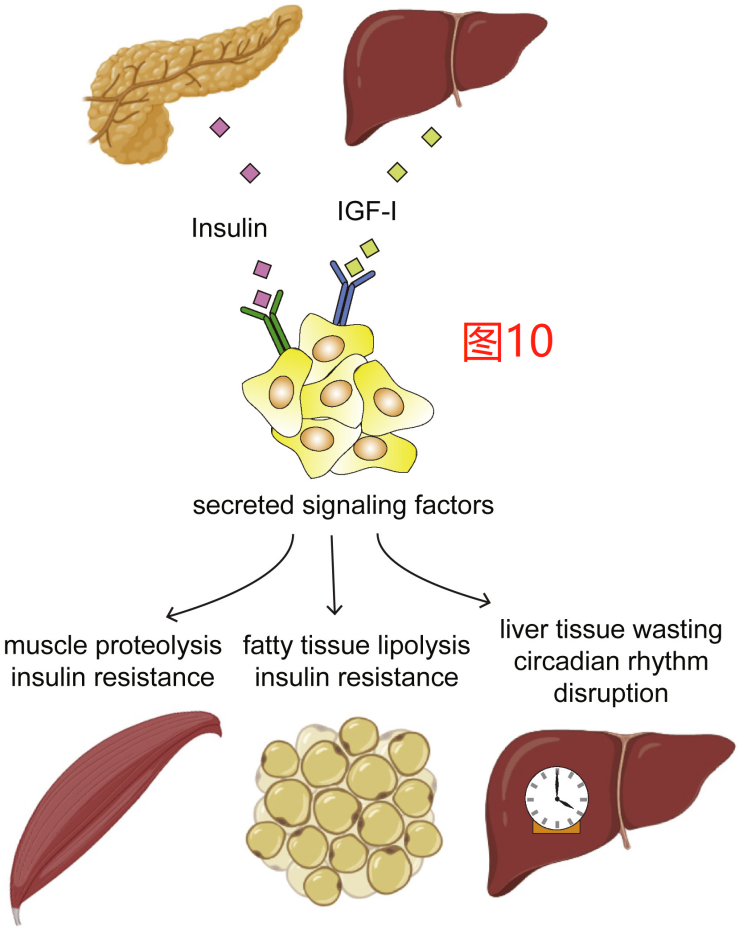
越来越多的证据表明,致癌作用受到机体代谢调节的影响。因此,与肥胖和2型糖尿病相关的代谢变化可能在促进肿瘤发生方面也起着重要作用。此外,研究发现,与衰老相关的血清甲基丙二酸的增加可直接促进癌细胞的侵袭行为。此外,一些肿瘤也表现出了有能力通过一些机制来影响整个机体的代谢状态(图10)。确定这些现象背后的机制可能有助于指导癌症预防、早检和新的治疗干预策略。
流行病学的研究证据表明,肥胖和2型糖尿病是许多癌症的显著风险因素。2型糖尿病患者的空腹血糖水平明显升高(从健康的4-5mM升高到7mM)。就其本身而言,这种增加不太可能为癌细胞提供额外的葡萄糖。这是因为GLUT1是癌细胞表达的主要葡萄糖转运蛋白,即使在葡萄糖生理水平下也已经是以最大的能力在运作了。因此,异常升高的血糖不太可能直接影响到癌细胞对葡萄糖的获取。
即使在胞外葡萄糖水平较高的情况下,葡萄糖进入大多数细胞主要是由细胞和组织特异性受体酪氨酸激酶的配体来介导的激活并控制的,而这些受体酪氨酸激酶反过来又可调节GLUT1的相对表达和在细胞表面的定位。虽然组织的特异性代谢是由局部产生的生长因子,如EGF、PDGF或FGF所控制的,但机体范围内的营养利用是由同时作用于各种组织的系统循环因子(systemically circulating factors)所控制的。这些因子包括胰岛素(几乎完全由胰腺产生),以及由肝脏和各种局部组织产生的胰岛素样生长因子(IGF-I),并受中枢神经系统的生长激素所影响。
在代谢综合征和2型糖尿病患者中,由于胰岛素可促进葡萄糖进入胰岛素依赖性组织(如肌肉)的能力受损,循环中的胰岛素和IGF-I水平会出现代偿性升高。遗传学和药理学的证据表明,IGF-I的全身性上调在肿瘤的发生中起重要作用。事实上,尽管IGF-I的受体很少发生突变,但在肿瘤中却经常过度活跃。例如,研究高达50%的乳腺癌有IGF-I受体活性增加的迹象,而这一迹象与低生存率相关。此外,在IGF-I水平升高的小鼠中,原位移植和致癌物诱导的肿瘤生长也有所增强。来自动物模型和人群中功能缺失的遗传证据也进一步支持全身性IGF-I信号传导参与了肿瘤的发生。IGF-I受体的纯合型缺失或其近侧效应体(proximal effectors)IRS1和IRS2的双重缺失也被证明可明显延缓Kras驱动的小鼠肿瘤的发生。来自人群研究的证据也表明IGF-I信号与肿瘤的发生有关。事实上,患有先天性IGF-I缺陷综合征(如Laron综合征)的人几乎不会发生癌症。
由于全身胰岛素和IGF-I的释放主要受食物摄入量的支配,饮食的调整可以帮助降低这两种因子的循环水平。事实上,Peyton Rous在1914年对喂养不足的(underfed)动物所进行的研究提供了早期的实验证据,即减少热量摄入有可能减缓肿瘤的生长。值得注意的是,通过注射重组IGF-I,可以很容易地逆转热量限制介导动物肿瘤发生的延缓现象,这进一步表明IGF-I水平的降低是饮食介导肿瘤生长延缓的一个关键因素。胰岛素/IGF-I正常化的饮食策略,如生酮饮食,也被证明在各种小鼠肿瘤模型中有类似的抑瘤效果。在人群层面上,采用降低细胞外葡萄糖和胰岛素水平的治疗,如二甲双胍,已被证明可以减少糖尿病患者的癌症发病率。然而,并非所有的肿瘤都对热量限制或葡萄糖水平降低敏感。特别是有PI-3激酶活性突变的肿瘤并不会受动物饮食限制的影响,这表明肿瘤的遗传特性可能在肿瘤对全身营养吸收信号的依赖程度上起着关键作用。
一方面,肿瘤会受到整个机体的代谢控制因素的影响,另一方面,一些肿瘤似乎还会影响到整个身体的代谢设定点(metabolic set point)。肿瘤调控全身代谢最突出的表现是多器官代谢的恶病质状态。恶病质的特点是许多组织丧失胰岛素的敏感性;骨骼肌、心脏、肝脏、脂肪和脑组织进行性消瘦;没有食欲;并抑制免疫系统。虽然恶病质不是一种完全与癌症相关的现象,严重创伤和艾滋病也与恶病质有关,但癌症晚期通常会伴随恶病质现象。据称至少有20%的病人死于癌症的直接原因是恶病质。恶病质可以由一些循环因素所诱导,包括TNFα、炎性细胞因子和糖皮质激素。这些因素或其他因素是否直接或间接导致了与特定癌症类型相关的恶病质,仍需进一步深入研究。
最近的研究发现,肿瘤可通过扰乱肝脏和脂肪组织中代谢基因表达的正常昼夜节律来影响机体的代谢状态。破坏伴随昼夜循环的代谢循环是否会促进肿瘤的生长或在癌症发展过程中肝脏、肌肉和脂肪的分解代谢状态,还有待研究进一步确定。
结论
与肿瘤发生有关的代谢变化使转化细胞能够通过逃避组织的稳态防御,并与内部信号机制和局部组织和全身资源协作,维持异常积累并定植于不同的组织。重要的是,不仅转化细胞本身,而且TME内的基质细胞,以及整个机体的代谢平衡,在癌症过程中都会发生重塑,共同促进癌细胞的积聚和播散,降低免疫系统对抗肿瘤生长的能力,并直接导致癌症相关的死亡。剖析肿瘤促进这些变化并在代谢不利的环境中维持生长的代谢适应性,有助于指导新的治疗方法,并且有可能有助于指导能与现有治疗干预措施(如化疗、靶向抑制剂和免疫检查点阻断治疗)起协同作用的饮食组合。
原始出处:
Pavlova NN, Zhu J, Thompson CB. The hallmarks of cancer metabolism: Still emerging.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






