Cell:解决抗体研究40年难题,孟飞龙/叶菱秀团队揭示抗体基因DNA的“刚柔相济”,为开发超级抗体奠定基础
2023-04-25 王聪 “生物世界”公众号 发表于上海
这项研究解决了困扰免疫学家40多年的科学难题,为优化现有动物模型及推动下一代抗体基因人源化动物模型的发展提供了全新的见解。
抗疫三年,相信大家对“抗原”和“抗体”的概念已经非常熟悉。日本科学家利根川进因解开了抗体基因如何从1到100亿的科学界难题,而荣获了1987年诺贝尔生理学或医学奖,这一成就也推动了科学研究进入分子免疫学时期。
多样化的抗体是进化赋予机体对抗外界病原体入侵的强有力的武器,千百年来,抗体帮助人类战胜天花病毒、流感病毒以及如今的新冠病毒等。小小的抗体分子之所以能够“以万变应万变”,是因为B细胞工厂内有多道多样化生产线。第一道生产线中的RAG重组酶负责随机拼接抗体基因的V(D)J片段,将其加工成初级抗体库。
然而这些初级抗体由于与抗原的亲和力较低,还不能为机体提供完善的保护。为了提高初级抗体库的亲和力和多样性,第二道生产线中的AID胞苷脱氨酶会对抗体基因进行二次加工,在抗体基因的互补决定区(CDR)引入高频点突变,使抗体基因进一步经历“七十二变”,打造“质”和“量”双升级的次级抗体库,为机体提供全面的免疫防护。
从进化的角度来讲,突变发生在负责结合抗原的互补决定区(CDR)而不是负责维持结构稳定的框架区(FR)是最佳的选择,因为这样既可以增加抗体基因序列的多样性,又不会对抗体的整体结构造成伤害。早在1982年,科学家们便提出了为什么CDR具有偏好性突变这个问题,但是四十多年来,领域内一直没有给出令人信服的答案。
2023年4月24日,中国科学院分子细胞科学卓越创新中心孟飞龙团队和上海交大医学院上海市免疫学研究所叶菱秀团队(博士生王燕燕为论文第一作者)在国际顶尖学术期刊 Cell 发表了题为:Mesoscale DNA Feature in Antibody-Coding Sequence Facilitates Somatic Hypermutation 的研究长文(Research Article)。
该研究系统揭示了抗体基因互补决定区(CDR)偏好性突变背后的生化机制,特别是抗体基因编码序列DNA柔韧性的重要生理作用。这项研究解决了困扰免疫学家40多年的科学难题,为优化现有动物模型及推动下一代抗体基因人源化动物模型的发展提供了全新的见解。

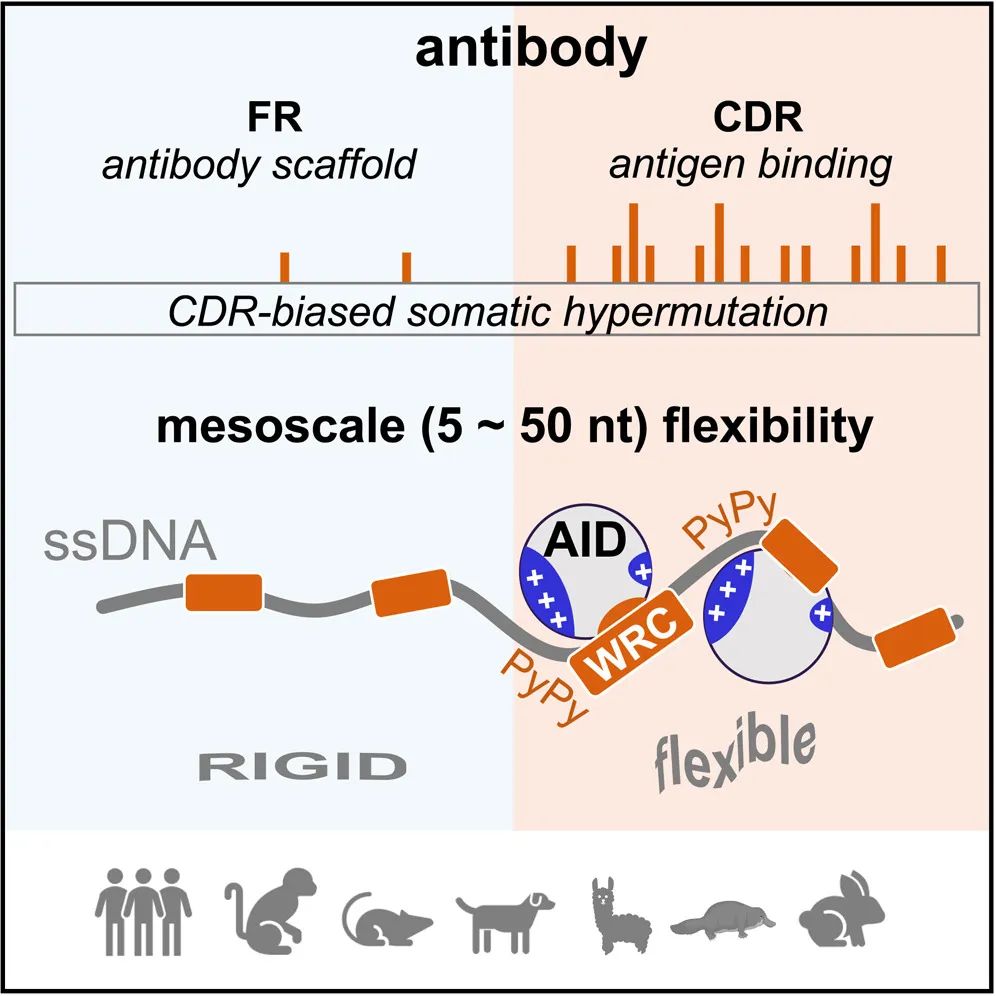
图1:CDR区序列的柔韧性决定了偏好性突变
研究团队首先从经典的生化方法出发,建立了AID体外生化反应新方法,通过分析27种有颌脊椎动物的超1000条抗体重链基因序列的体外突变特征,发现CDR突变偏好在使用体细胞高频突变(SHM)作为主要抗体多样化策略的四足动物(包括人、恒河猴、食蟹猴、小鼠、大鼠、狗、鸭嘴兽以及羊驼等)中高度保守(图2),暗示了CDR突变偏好受DNA序列上下文的影响。
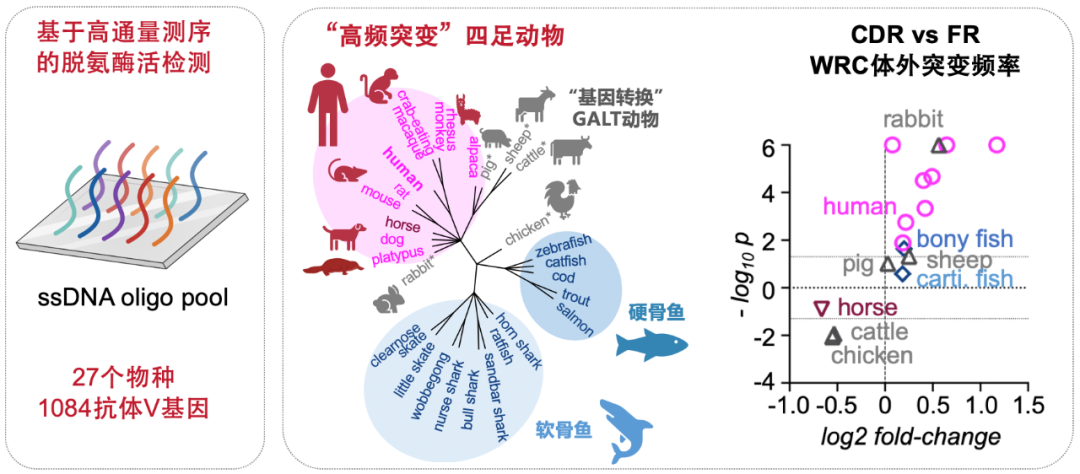
图2:CDR突变偏好具有进化保守性
随后,研究团队在体内进行了验证,将小鼠体内一段抗体基因DNA序列进行随机替换,发现新的序列环境显着改变了原始位点的突变频率。紧接着,研究团队进一步聚焦于一段CDR3序列,通过基因编辑快速获得携带不同CDR3上下文序列小鼠模型,发现序列改变对突变频率造成了不同程度的影响,并且序列改变越靠近AID的作用位点,对突变频率的影响越大。
为了深入挖掘DNA序列特征,研究团队结合分子动力学模拟及单分子荧光相关光谱实验证明了AID的靶向偏好受单链DNA底物柔韧性的直接调控,尤其是紧邻AID作用位点WRC(W=A/T,R=A/G)上游的6nt DNA序列组成。该位置富含嘧啶-嘧啶二核苷酸的柔性DNA序列([-PyPy-]WRC)有利于结合AID,进而有助于突变的发生(图3)。
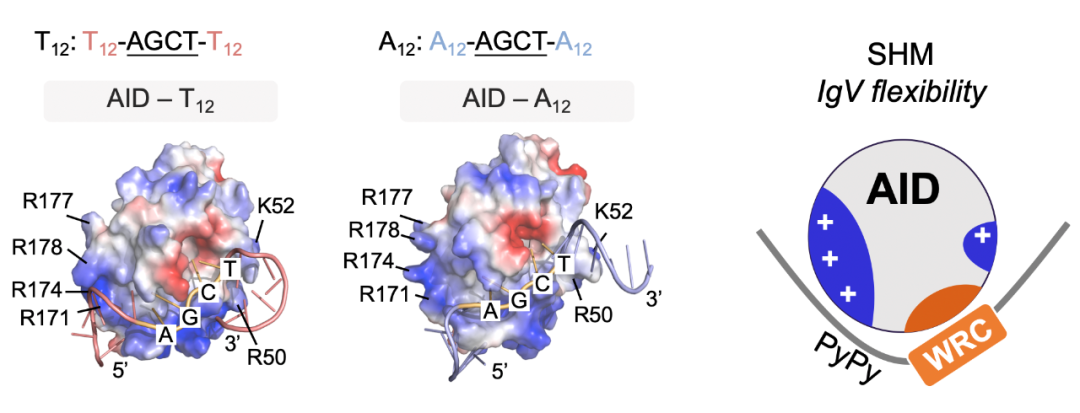
图3:柔性DNA序列更易结合AID
通过分析抗体基因序列特征以及突变谱式,该团队发现抗体可变区基因CDR编码序列在进化中获得了高度柔韧性特征。同时,AID也进化出了表面正电荷片区。这种酶和底物的协同进化促进了CDR偏好性突变的发生。最后,研究团队分别在B细胞系和小鼠体内将柔性DNA序列替换到低频突变区,成功地将该区域逆转为高频突变区(图4)。
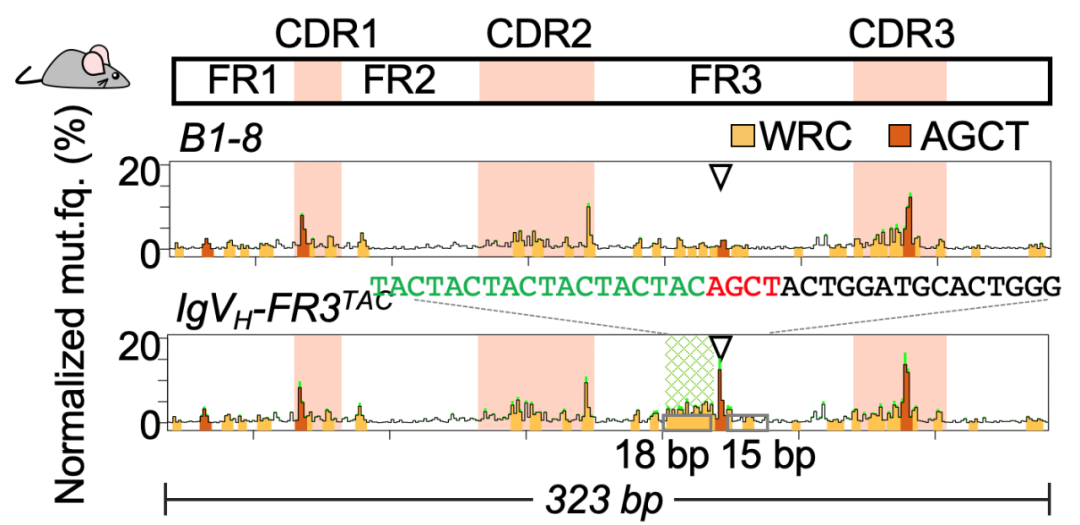
图4:柔性序列将FR区逆转为类CDR区
综上所述,这项工作从经典的生化方法出发,联合高通量测序技术、分子动力学模拟以及单分子荧光相关光谱技术等多种研究手段,在生化、细胞和小鼠模型三个层面,以全新的角度全面揭示了DNA柔性调控抗体多样化的分子机制,并且该机制在许多物种中都普遍存在。该研究为DNA力学性质调控细胞生命活动提供了有力的实证,揭示了密码子也有非编码功能。
该研究对如何发展下一代抗体基因人源化动物模型以及加速罕见抗体的发现具有关键性的指导意义,因为现有抗体基因人源化小鼠模型均适用胚系抗体基因序列,大大限制了体细胞高频突变过程,这无疑限制了高亲和力抗体产生的速度。相信这种中尺度序列特征的发现为从头理性设计抗体基因,针对性解除限速步骤以及打造超级抗体提供了坚实的理论基础。
中科院分子细胞科学卓越创新中心孟飞龙组博士研究生王燕燕为该论文的第一作者,孟飞龙研究员和叶菱秀研究员为该论文的共同通讯作者。该工作得到了哈佛医学院著名免疫学家Frederick W. Alt教授、上海交通大学达林泰教授、上海交通大学医学院郑小琪教授、中国农业大学赵要风教授、瑞典卡罗林斯卡研究所Qiang Pan-Hammarstro?m教授、中科院杭州医学所宋杰教授、中科院生物物理所黄绍辉教授、复旦大学曹志伟教授、中科院分子细胞科学卓越创新中心刘珈泉教授等合作者的大力支持。此外,上海师范大学博士研究生张森欣为该论文的数据分析提供了巨大帮助、上海交通大学博士研究生杨欣瑞为分子动力学模拟作出了重要贡献。
原始出处:
Yanyan Wang, et al. Mesoscale DNA feature in antibody-coding sequence facilitates somatic hypermutation. Cell, 2023.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言