Science:重磅!小胶质细胞吞噬神经周围网络介导疼痛行为
2022-05-30 周科 “神经周K”公众号
皮层中PNNs选择性包裹在快速尖峰放电的小清蛋白阳性抑制中间神经元的胞体和近端树突,调节神经可塑性。
中枢神经系统细胞外基质成分为神经元提供结构支持,调控神经元的兴奋性和突触可塑性。神经周围网络(PNNs)是细胞外基质的主要成分,主要由透明质酸,硫酸软骨素蛋白聚糖等组成。皮层中PNNs选择性包裹在快速尖峰放电的小清蛋白阳性抑制中间神经元的胞体和近端树突,调节神经可塑性。

2022年5月26日Science杂志以First release形式在线发表加拿大麦吉尔大学Arkady khoutorsky 研究团队的文章,发现周围神经损伤后引起脊髓大量的PNNs降解,并引起疼痛行为,这是由小胶质细胞介导的。
紫藤凝集素(WFA)可选择性结合PNN糖蛋白的糖胺多糖链(GAG)。PNNs可通过WFA和aggrecan进行荧光标记。
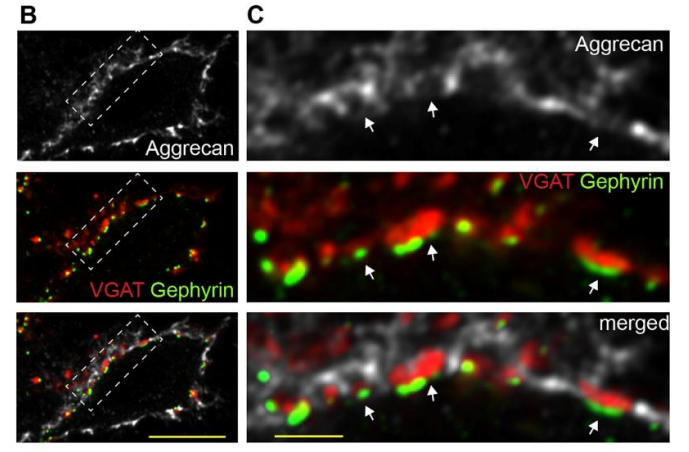
图1:抑制性突触结构位于PNNs内
免疫荧光实验发现PNNs主要围绕在脊髓背角神经元附近,抑制性突触前结构位于PNNs内。PNNs主要分布在I板层,稀疏分布在 III 板层,几乎不存在II板层中。
在臂旁外侧核注射逆行金颗粒发现I板层PNNs选择性包围在脊髓-臂旁核投射神经元附近,以下简称I板层投射神经元周围PNNs。在机械或热伤害性刺激下引起I板层PNNs阳性投射神经元激活,表明这类神经元参与编码疼痛相关的信息。

图2:小胶质细胞吞噬PNNs
周围神经损伤后3天后疼痛行为最为明显,此时I板层WFA标记的PNNs出现大幅度减少,损伤后1周和2周仍维持低水平,但aggrecan标记的PNNs并不受影响。
免疫荧光实验发现损伤后第3天大多数小胶质细胞(67.1%)胞体内出现WFA标记的PNNs和溶酶体的共标,在损伤后第1周和第2周,吞噬PNNs的小胶质细胞比例明显减少。
通过工具小鼠特异性清除小胶质细胞后,周围神经损伤不会引起机械痛觉,也不会引起PNNs的降解。损伤后第3天I板层神经元周围的PNNs也没有出现明显减少。
趋化因子受体CX3CR1介导小胶质细胞的激活和吞噬活性。研究人员发现CX3CR1敲除小鼠小胶质细胞吞噬活性减弱。在神经损伤后CX3CR1敲除小鼠并不会出现I板层神经元周围的PNNs大量的降解。这些结果表明小胶质细胞介导周围神经损伤后的PNNs降解。
正常小鼠在热板实验中出现舔爪,跳跃等反应,在通过病毒结合aggrecan-cre小鼠特异性敲除I板层投射神经元周围PNNs后上述反应的延迟时间缩短,表现对热觉超敏反应。
硫酸软骨素酶(ChABC)是一种细菌裂解酶,可裂解PNNs中的GAG。通过病毒策略特异性降解I板层投射神经元GAG可诱发自发性疼痛,引起热觉超敏反应。I板层PNNs阳性投射神经元接受的抑制性输入多于兴奋性输入。在敲除CAG后PNN周围的神经元微小抑制性突触后电流降低,表现为去抑制作用。
总的来说,本文揭示了在脊髓背角I板层存在一类投射到外侧臂旁核的神经元选择性被PNNs包裹,在神经损伤后小胶质细胞激活后吞噬了大量PNNs,引起疼痛反应。
原始出处:
SHANNON TANSLEY NING GU ALBA UREA GUZMáN, et al. Microglia-mediated degradation of perineuronal nets promotes pain. SCIENCE26 MAY 2022.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#细胞吞噬#
81
#SCIE#
98
#胶质细胞#
116
#重磅#
73