Nat. Commun:侯英勇/丁琛/贺福初团队合作发布中国人群鳞状细胞癌蛋白质组学图谱,揭示鳞状细胞癌和腺癌的分子差异
2022-08-10 测序中国 测序中国
泛SCCs的全面基因组学和转录组学分析拓宽了人们对这种恶性肿瘤相关分子事件的了解。研究团队通过深度蛋白质组分析揭示了中国人群SCCs的共同特和异性特征,进而对SCCs的临床、生物学和治疗有更深入的了解
导语
鳞状细胞癌(SCCs)和腺癌(ACs)是两种最常见的人类实体癌症组织学亚型:。近年来,通过对肿瘤发生发展的分子机制研究,ACs的诊断和治疗方案已取得较大改善;但对SCCs的研究目前尚不充足。SCCs具有共同的组织学特征,这些共性特征提供的有关预测转移发生时起源位置的信息却十分有限。因此,转移性SCCs的诊断标准和晚期SCCs的治疗在很大程度上仍然是未知的。
癌症基因组图谱(TCGA)研究已经生成了全面的分子图谱,包括体细胞突变、拷贝数改变、DNA甲基化、转录组等。这些研究确定了与细胞周期、细胞凋亡(TP53、CDKN2A、CCND1和RB1)、RTK信号通路(EGFR、FGFR1和PIK3CA)、鳞状分化(TP63、SOX2和NOTCH1)和染色质重塑(KMT2C和KMT2D)相关基因在肿瘤发生发展中的作用。
此外,转录组分析也识别出了癌症患者中活跃的信号通路,但由于转录组层面的调控并不能像蛋白质一样真实反映功能效应,针对这些通路的靶向治疗在很大程度上是不成功的。尽管蛋白质组学研究极具应用价值,但对SCCs功能蛋白组信息的深入研究依旧匮乏。
近日,复旦大学附属中山医院侯英勇团队、复旦大学人类表型组研究院丁琛团队以及北京生命科学研究所贺福初团队合作在Nature Communications发表了题为“Proteomic analysis reveals key differences between squamous cell carcinomas and adenocarcinomas across multiple tissues”的文章。研究团队通过系统地蛋白质组学分析揭示了中国人群SCCs和ACs之间的差异,并初步阐明了肿瘤发生机制和治疗策略。通过对蛋白质组数据进行深入分析,构建了包含19个蛋白的诊断分类器,并验证了PRKCE、SLC27A1和CPXM2的诊断价值。该研究证实深度蛋白质组学研究能够带来功能上的新见解,将有助于推动未来的机制探索和精准治疗。

文章发表在Nature Communications
主要研究内容
鳞状细胞癌的蛋白质组学分析
该研究共纳入来自未经治疗的中国SCCs患者的333个原发性肿瘤样本,包括10个常见的SCCs位点。蛋白质组学研究采用基于质谱(MS)的无标记定量策略,对验证研究中的样品采用组织微阵列(TMAs)和免疫组化(IHC)策略。研究人员对所有病例的临床和病理特征(包括性别、年龄、肿瘤分化、角化、细胞大小、有丝分裂像、基质比例、基质炎症等)进行了评估和总结。
研究团队筛选出具有>80%肿瘤细胞的SCC区域,并对其进行蛋白质组学分析。结果显示,平均每个SCC样本的蛋白组可检测到8,120个蛋白,从最少的甲状腺6,261个到最多的胸腺9,296个不等。
其中一些关键分子的蛋白质组数据,与先前的基因组学研究结论一致。例如,已知的SCCs诊断标志物KRT5和TP63在所有SCCs中均有较高且普遍的表达;EGFR和CD274 (PDL1)作为SCCs的有限治疗靶点,在所有SCCs中表达水平相似。上述结果肯定了蛋白质组数据的高质量,基于此,该研究建立了一个系统的中国SCCs蛋白质组学图谱。
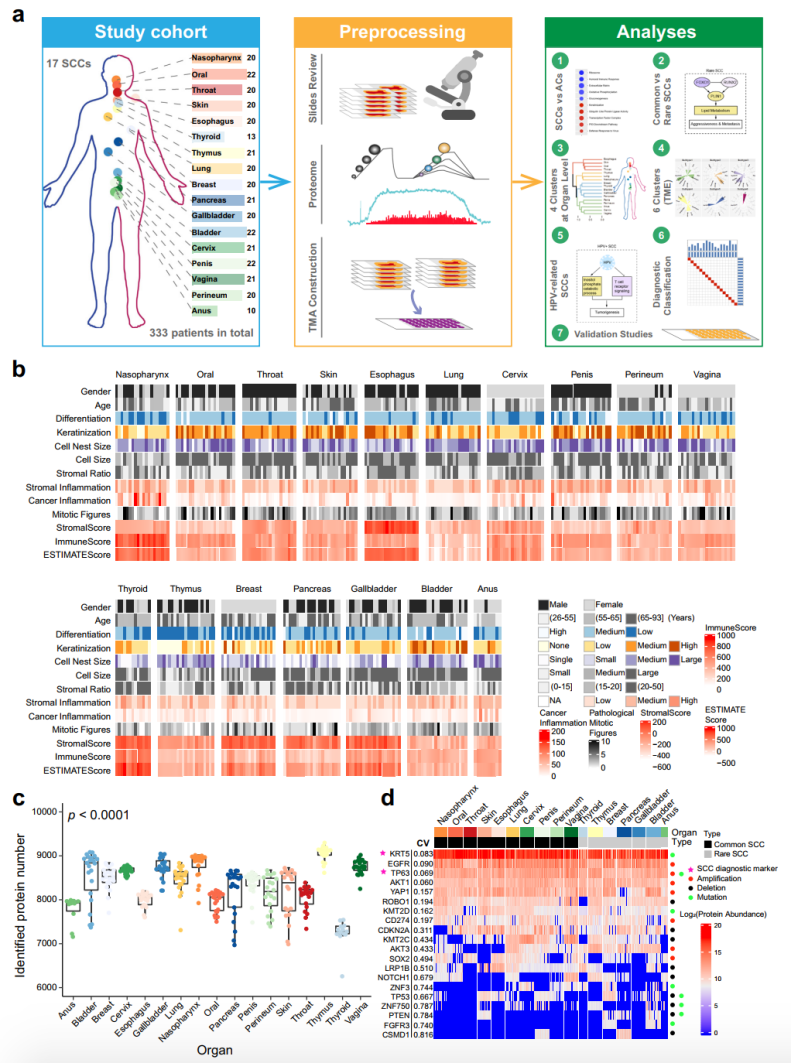
图1. SCCs蛋白质组学分析示意图和整体概况。来源:Nature Communications
SCCs与ACs的蛋白质组学特征比较
研究团队为了分析比较SSCs和ACs之间的功能差异,将333个SSCs与一个独立的ACs队列进行比较,该队列由69名ACs患者组成,包含乳腺、甲状腺、肺、胃、胰腺、胆囊和结肠7个部位。
为了探索SCCs和ACs的蛋白质组覆盖范围,研究团队对不同部位SCCs和ACs之间的蛋白组进行了配对比较发现,ACs中有643个蛋白过表达,SCCs中有895个蛋白过表达。基因集富集分析显示,ACs富集的蛋白也在核糖体、体液免疫反应、细胞外基质、氧化磷酸化和糖异生等通路中显著富集;而SCCs中富集的蛋白主要参与角化相关通路,泛素样蛋白连接酶活性、P53下游通路和对病毒的防御反应等。上述结果表明,SCCs和ACs之间的显著差异符合其起源的上皮组织不同这一特性。
为了进一步阐明ACs和SCCs之间差异的潜在机制,研究团队使用GENEMINIA工具来预测可能针对这些差异蛋白的激酶和转录因子(TFs)相互作用,发现参与细胞外基质和糖代谢的ACs中富集的差异蛋白是由一个8激酶-8TF网络介导;角化则由11激酶-5 TF网络介导。这些通路、差异蛋白和激酶-TF网络在SCCs和ACs中特异表达代表了独特或共同的生物学和临床病理特征。

图2. SCCs与ACs的蛋白质组学特征比较分析。来源:Nature Communications
SCCs基于蛋白质组的层次聚类
已有研究表明,可以通过基因组和转录组信息将SCCs聚类成亚组,但目前还缺乏基于蛋白质组的聚类研究。t-SNE降维分析显示,来自同一器官的样本倾向于聚集在一起,表明SCCs起源的组织类型更相似。为了识别基于蛋白质组特征的分类,研究团队对来自17个器官的333个SCCs样本进行了分级聚类,并根据1,500个高变的蛋白质确定了4种蛋白质组亚型,其与解剖部位显著相关,并揭示蛋白质表达和信号转导的显著模式。
此外,研究团队还分析了4个亚型的所有差异蛋白,发现了两个具有预后价值的蛋白。ATM蛋白与预后良好相关,而MMP19蛋白与预后不良相关。
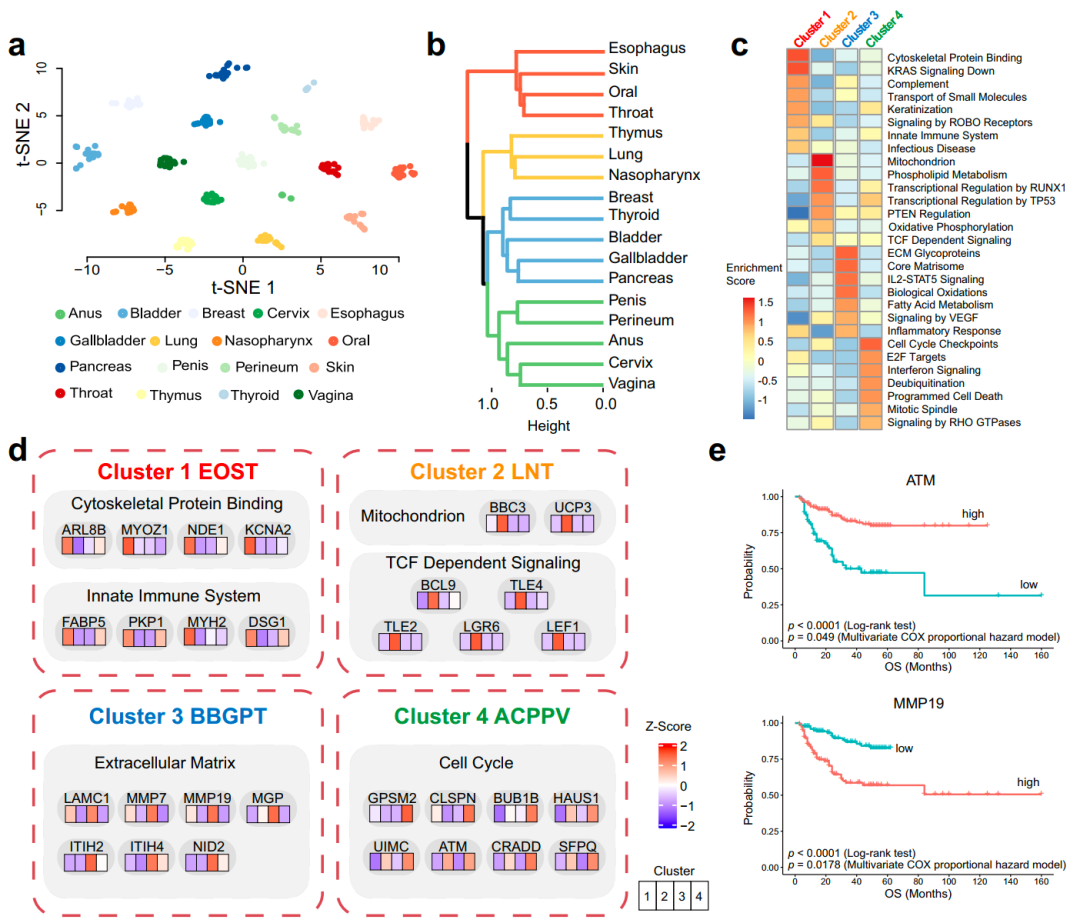
图3. 基于蛋白质组的鳞状细胞癌层次聚类。来源:Nature Communications
肿瘤类型分类器的构建和性能评估
对SCCs的有效管理应包括可靠的生物标志物和设计合理的预防、治疗药物。假设来自深度蛋白质组学分析的信息内容足够丰富,可以高精度地预测肿瘤的起源部位,研究团队开发了一种基于机器学习的分类器,以确定蛋白质组表达在SCCs患者诊断中的能力。结果显示,在249例患者的训练集中,基于10倍交叉验证,所有患者的SCC类型都被准确预测(敏感性和特异性均为100%);当应用于84例患者的验证集时,模型的敏感性和特异性也均达到100%。
考虑到这些蛋白质组标志物可能具有来自不同细胞群的平均信号,研究团队通过对SCCs队列患者的连续切片进行免疫组化,在组织水平上检测了3个生物标志物PRKCE、SL27A1和CPXM2的空间表达。
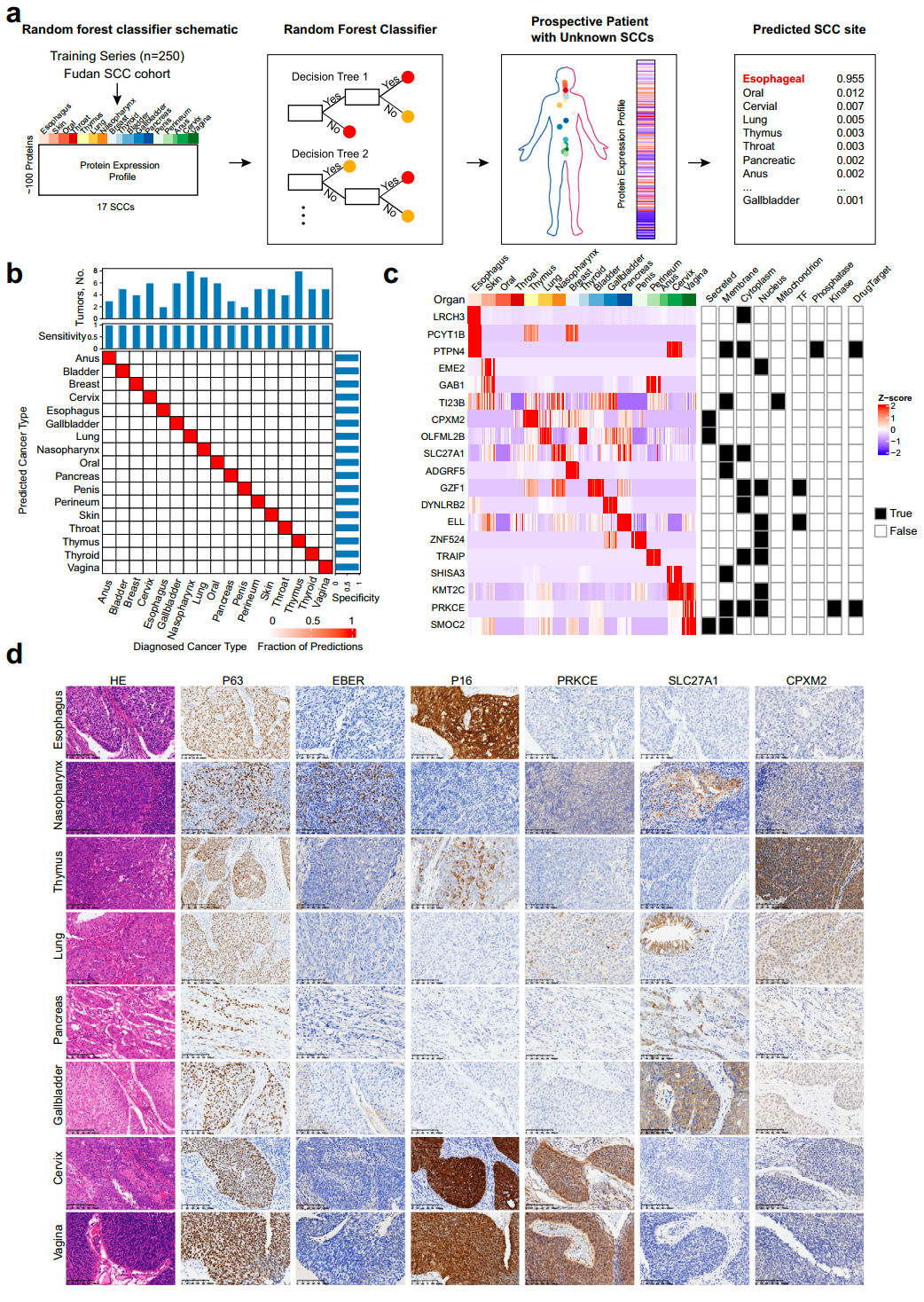
图4. 肿瘤类型分类器的构建和性能评估及验证。来源:Nature Communications
结语
综上所述,泛SCCs的全面基因组学和转录组学分析拓宽了人们对这种恶性肿瘤相关分子事件的了解。研究团队通过深度蛋白质组分析揭示了中国人群SCCs的共同特和异性特征,进而对SCCs的临床、生物学和治疗有更深入的了解。此外,SCCs和ACs样本的蛋白质组学图谱揭示了差异激活的关键信号通路、临床和治疗相关亚组等。该研究利用蛋白质组学平台对泛SCCs进行了系统、全面地分析,这些结果可作为临床蛋白质组学数据的资源为科学界服务,这对更好地理解SCCs具有重要的意义。
参考文献
1. Song, Q., et al. Proteomic analysis reveals key differences between squamous cell carcinomas and adenocarcinomas across multiple tissues. Nat Commun 13, 4167 (2022)
2. Bray, F. et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J. Clin. 68, 394–424 (2018).
3. Jiang, L. et al. A quantitative proteome map of the human body. Cell 183, 269–283 e219 (2020).
·END ·
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#白质#
94
#Nat#
0
#细胞癌#
36
#COMMUN#
55
#蛋白质组#
66
#贺福初#
64
#蛋白质#
89