近日,我国科学家在国际化学期刊Analytical Chemistry上发表了关于循环肿瘤细胞(CTC)定量检测的重要技术突破,该文章通过使用液滴分割代替富集来量化外周血中CTC的数量。

文章主要内容
循环肿瘤细胞是一种新兴的但至关重要的癌症伴随诊断生物标志物。由于CTCs的稀有性,寻找一种准确定量CTCs的有效方法具有非常大的挑战性。在本文中,作者开发了一种数字化CTC检测策略:使用液体分割代替富集来量化CTC。利用液滴微流控可快速生成大量平行独立反应单元的特点,结合泊松分布,实现对血液中CTCs的直接定量。数字化CTC定量检测法的检测限为每5 mL全血中5个细胞。通过同时检测多个基因突变,本研究实现了对NSCLC患者外周血CTC的高灵敏度和高特异性检测(AUC = 1),为CTC的定量检测提供了一种潜在的方法和策略,有助于提高癌症的治疗水平。
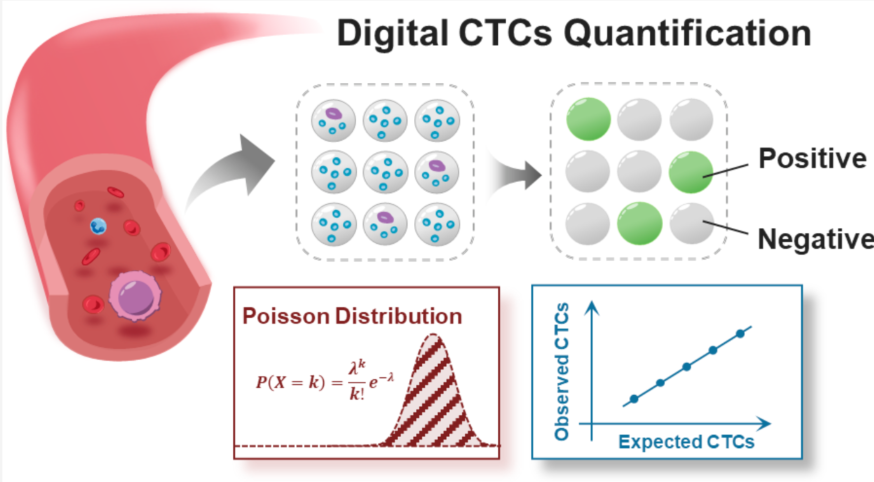
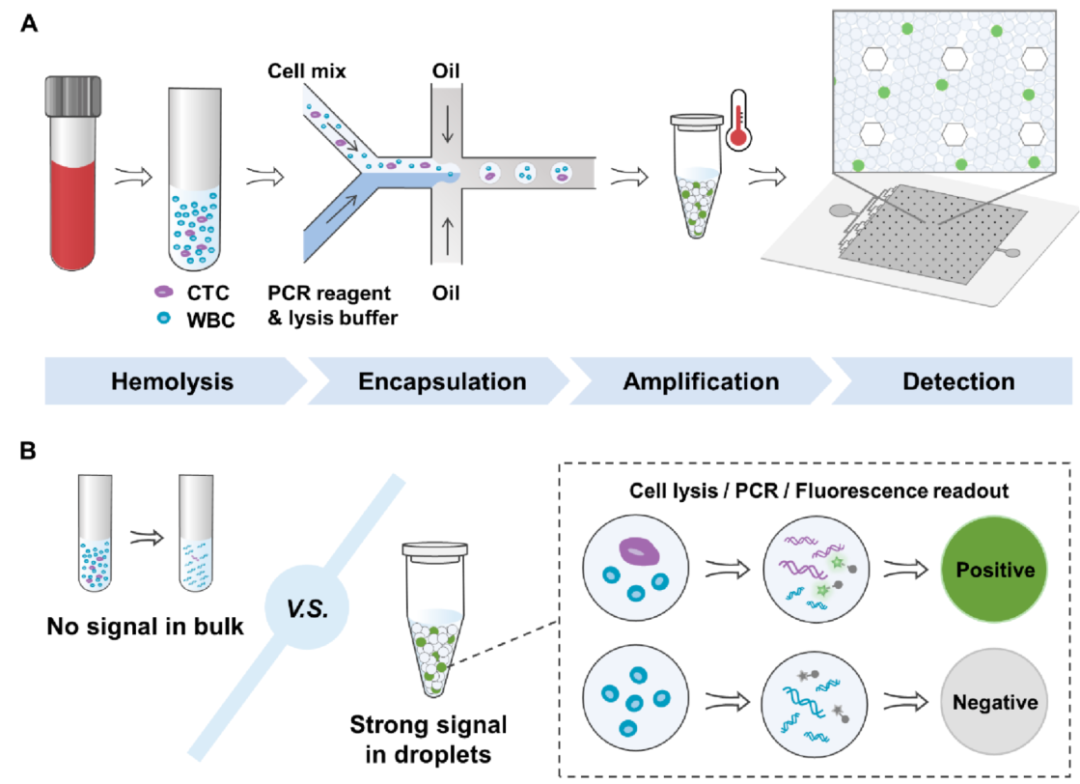
下图为数字化CTC定量分析原理图。图A为红细胞去除,用含细胞裂解缓冲液和PCR试剂将除红细胞外的其余血细胞包裹到数百万液滴中,在液滴中进行细胞裂解和基因扩增,并进行检测,通过荧光成像及泊松分布的算法,获得CTC的数量。图B中是CTCs定量采用液体分隔代替富集的策略原则,液滴约束效应可以提高单个反应器中CTC的浓度,有利于稀有细胞的检测。
数字化循环肿瘤细胞定量策略
数字化定量CTC的核心思想是分割,而不是富集。当将血液样本分成多个独立的液滴反应器时,一些液滴反应器不可避免地含有CTC,而另一些则不含有。此时,在含有CTCs的反应器中,CTCs相对于血细胞的丰度会增加。独立反应器越多,同一独立反应器中含有CTC的血细胞越少,相应的,CTC的相对丰度越高。由于液滴独立限制效应,它可以显著提高单个液滴中CTC的相对浓度,从而有助于CTC的定量。通过直接检测CTC的基因型,克服了CTC表型变异带来的挑战,如上皮-间充质转化(EMT),这可能导致传统方法中遗漏CTC。此外,在液滴内直接进行CTC检测可降低因移液导致的CTC丢失风险,确保提高灵敏度,并减少潜在的不准确性。
考虑到分析通量、可测量的液滴荧光强度,以及喷嘴尺寸过小容易导致微通道堵塞的潜在问题,最终选择了尺寸为~ 45 μm的液滴进行后续实验。

在微流控中裂解细胞的一种常见策略是使用蛋白酶或碱性使细胞蛋白非特异性变性。然而,蛋白酶或碱性也会使聚合酶变性,这是聚合酶链反应的关键成分。因此,使用这些化学物质的方法需要两步液滴反应:(a)用细胞裂解组分包裹细胞以裂解细胞,然后加热使蛋白酶失活或中和碱性物质。(b)将含有聚合酶的液滴与含有裂解产物的液滴合并,从而启动PCR。虽然这些方法非常有效,但需要仔细处理液滴,并且难以使两个液滴同步。复杂的操作降低了分析速度,并导致了显著的细胞损失。
考虑到CTCs的稀少性,作者尝试使用非离子型清洁剂(IGEPAL CA-630)裂解液滴中的细胞。为了测试裂解缓冲液,作者使用coflow微流控将裂解缓冲液与钙黄绿素预染色的细胞一起包裹。收集液滴并在室温下孵育30 s。有效的裂解液可使被染色的细胞破裂并释放荧光染料,使整个液滴呈现绿色荧光
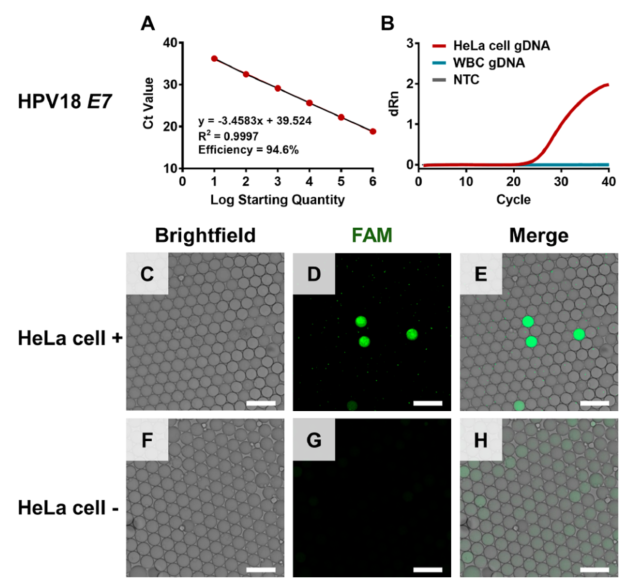
适用于血液中CTC数字定量的一种策略要求能够在液滴中存在血细胞的情况下特异性扩增肿瘤特异性基因。因此,在评估CTC定量性能之前,作者验证了在大量血细胞背景下扩增肿瘤特异性基因时的抗干扰能力。将HeLa细胞加入去除红细胞的全血细胞中,作为样本进行测试。应用液滴包封样品、裂解液和PCR试剂,在白细胞丰富的背景下扩增HPV 18 E7基因,检测HeLa细胞。结果表明,含有两种细胞的液滴在扩增后呈现绿色荧光,这意味着整个球形液滴发出绿色荧光(下图A−C)。而仅含有白细胞的液滴则出现不规则的荧光斑点,这可能与白细胞碎片富集Taqman探针有关。根据HeLa细胞与液滴数量的比例,大多数液滴仅含有不规则的荧光碎片。在没有HeLa细胞的样本中,只能在液滴中观察到不规则的荧光斑点(下图D−F)。
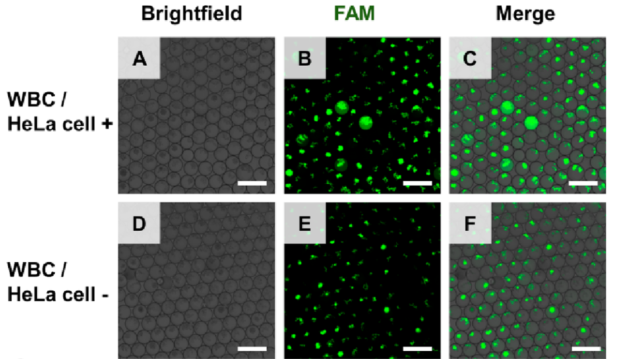
为了计数荧光液滴的数量并排除只有荧光斑点的液滴,作者引入了开源软件(CellProfiler)进行图像分析(下图G)。使用设置的大小范围和形状参数(软件中的FilterObjects),几乎消除了来自细胞碎片的所有干扰(下图H−K)。可准确获取有靶点的液滴数(阳性液滴)。同时,使用相同的软件获取液滴总数。在白细胞丰富的背景下对靶点的高效扩增和阳性液滴的精确计数是数字CTC定量的基础。结合泊松分布数据(阳性液滴数和总液滴数)可直接输出CTC数量。
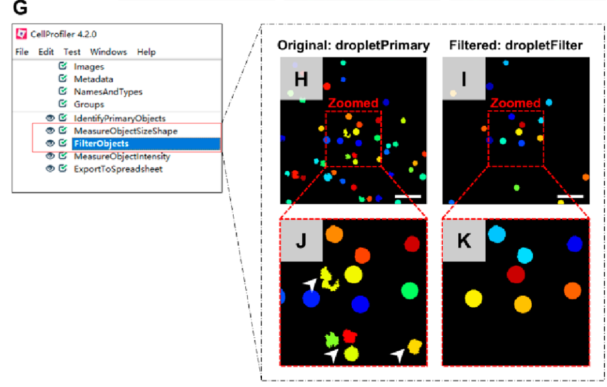
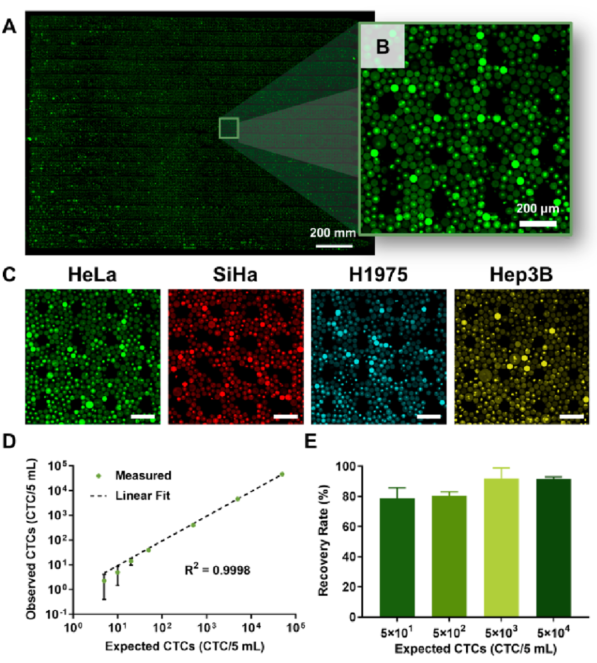
健康人外周血样本5 mL,加入不同数量的HeLa、SiHa、H1975和Hep3B细胞(5、10、20、50、500、5000和50 000个细胞),形成一系列模拟癌症患者外周血浓度。用红细胞裂解缓冲液裂解模拟样本中的红细胞后,用100 μL悬浮溶液重悬剩余细胞。随后,将细胞悬液、细胞裂解液和PCR试剂包裹在微流控通道内的20万个液滴中。与加标细胞数相对应,当液滴总数为20万时,每个液滴中的CTC数量仍服从泊松分布。由于液滴数量较多,作者专门设计了液滴阅读器,将放大后的液滴装入阅读器中进行显微镜记录。收集500多张显微镜图像后,将其组装成一张大图,通过软件(CellProfiler;下图a−C)。使用阳性液滴数和总液滴数结合泊松分布计算每个样本中的CTC数量。结果表明,检测的CTCs数量与预期附加值呈正相关,HeLa细胞、SiHa细胞、H1975细胞、Hep3B细胞的相关系数(R2)分别为0.9998、0.9999、0.9996、0.9997(下图D)。
通过比较添加的CTCs数量和所测得的数量来得到此方法的回收率。模拟血液样本中肿瘤细胞终浓度为50、500、5000、50 000个/mL时,HeLa细胞回收率分别为78.6% (CV = 9.1%)、80.3% (CV = 3.3%)、89.2% (CV = 7.4%)、92.5% (CV = 1.4%)。SiHa细胞在相应浓度下的回收率分别为80.7% (CV = 8.3%)、82.5% (CV = 7.9%)、92.0% (CV = 5.4%)、94.2% (CV = 1.1%)。H1975细胞的回收率分别为75.1% (CV = 8.0%)、80.1% (CV = 5.5%)、83.4% (CV = 4.5%)和90.1% (CV = 3.3%)。Hep3B细胞在相应浓度下回收率分别为77.8% (CV = 10.8%)、82.3% (CV = 7.1%)、87.7% (CV = 8.8%)、91.1% (CV = 1.9%)(下图E)。
临床评估
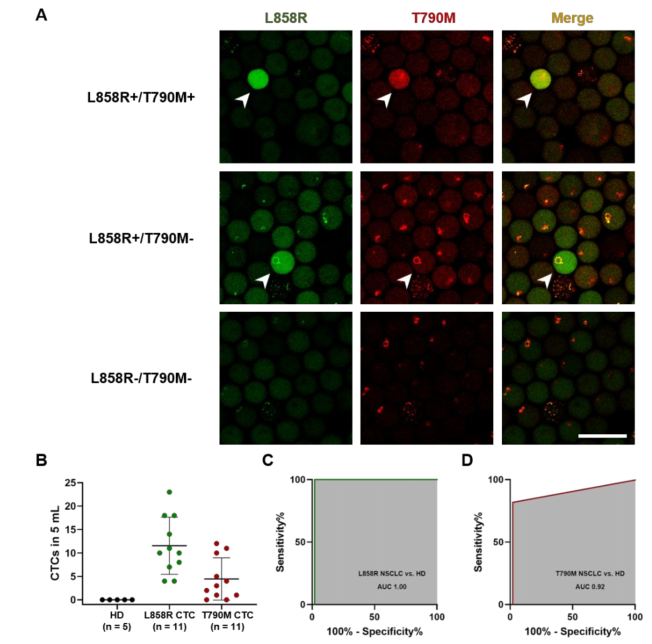
为了评估数字化CTC定量法检测临床肿瘤患者外周血中EGFR T790M耐药CTC的能力,作者检测了11例接受TKI治疗的NSCLC患者(组织测序证实EGFR L858R突变)的外周血CTC。11例NSCLC患者中,6例EGFR T790M突变,5例无T790M突变。采用两组针对EGFR L858R和T790M突变位点的引物检测CTC。当检测到EGFR L858R突变阳性时,证实存在CTC。此外,微滴中EGFR L858R和EGFR T790M同时阳性的检测表明存在携带EGFR T790M突变的CTC。100%的NSCLC患者检出携带L858R突变的CTC (≥1个/5 mL)。在100%的有T790M突变的NSCLC患者(6 / 6)和60%的无T790M突变的患者(3 /5)中检测到携带T790M突变的CTC (≥1个CTC /5 mL),而在健康供者中未检测到CTC。
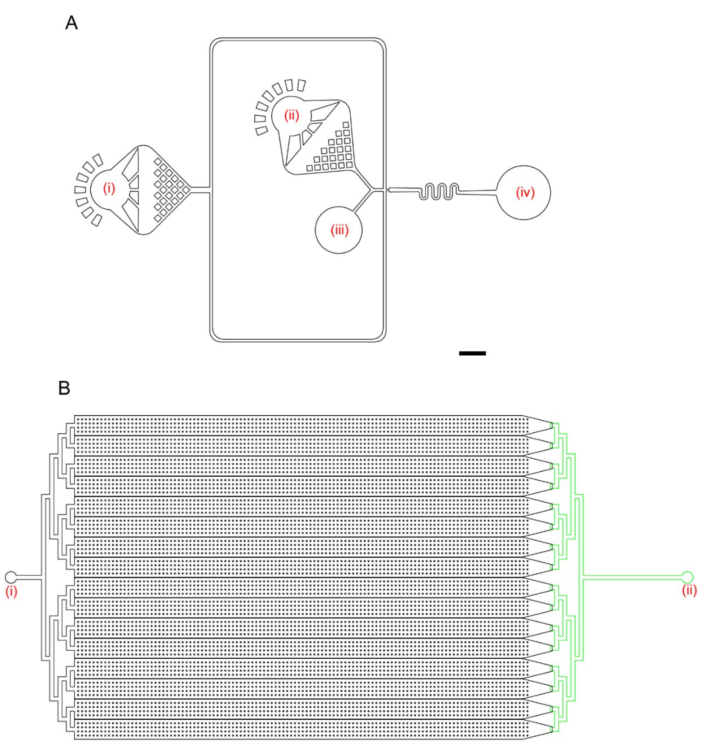
微流控器件的设计原理
(A)液滴发生器的设计。这些数字表示载体油入口(i)、PCR混合入口(ii)、细胞悬浮入口(iii)和液滴收集出口(iv)。微流控通道的深度为50 μm。比例尺:500 μm。(B)液滴阅读器的设计。数字表示液滴入口(i)和油出口(ii)。黑色微流体通道的深度为70 μm,绿色通道为30 μm。比例尺:2000 μm。
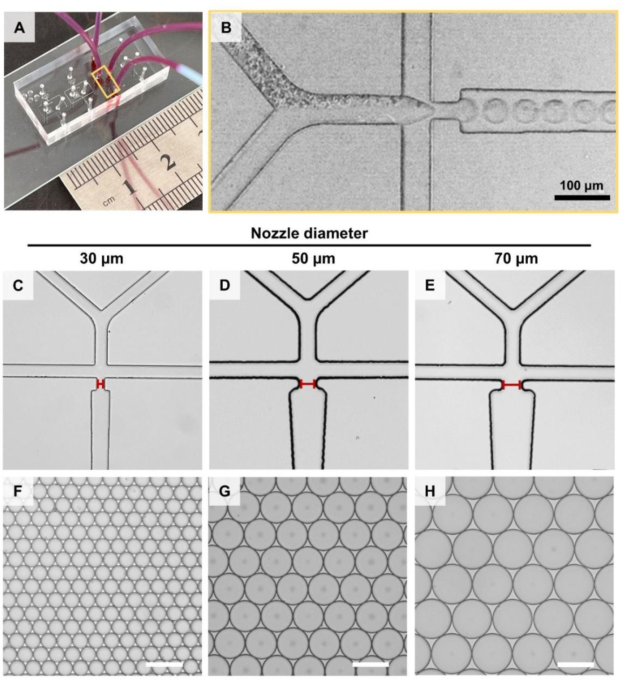
下图为微流控芯片图片,微流控芯片不同喷嘴的显微镜图像,微流控芯片液滴的显微镜图像。(A)微流控芯片制备液滴的图片。(B)放大(A)中黄色框的部分。(C)喷嘴为30 μm, (D)喷嘴为50 μm, (E)喷嘴为70 μm的微流控芯片显微镜图像。不同喷嘴大小(F) 30 μm、(G) 50 μm、(H) 70 μm的芯片产生液滴的显微镜图像。比例尺:100 μm。
液滴读取器芯片图片和充满液滴的液滴读取器芯片的一部分显微镜图像。(A)液滴读取器芯片图片。(B)充满液滴的液滴读取芯片的一部分显微镜图像。

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#循环肿瘤细胞# #定量检测#
88