Adv Mater:中国药科大学姜虎林团队发现调控肺部纤维化机械微环境治疗特发性肺纤维化
2024-11-18 iNature iNature 发表于上海
该研究构建了环(RGDfC)肽修饰的沸石咪唑酸盐框架-8纳米颗粒(ZDFPR NPs),靶向和修复病理肺中异常的机械力水平。
不良机械力会加剧特发性肺纤维化(IPF)的恶化,破坏肺机械微环境稳态,导致肺泡功能障碍。纤维化肺固有的机械敏感性使II型肺泡上皮细胞(AECII)受到持续拉伸,过度活化的肌成纤维细胞在机械转导过程中经历恶性相互作用,必须开发有效的策略来调节肺机械微环境。
2024年11月12日,中国药科大学/延边大学/韩国成均馆大学姜虎林唯一通讯在Advanced Materials 在线发表题为“Modulating Fibrotic Mechanical Microenvironment for Idiopathic Pulmonary Fibrosis Therapy”的研究论文。该研究构建了环(RGDfC)肽修饰的沸石咪唑酸盐框架-8纳米颗粒(ZDFPR NPs),靶向和修复病理肺中异常的机械力水平。
具体来说,pH响应性ZDFPR NPs通过释放锌离子和7,8-二羟基黄酮降低了的AECIIs中的机械张力,促进肺泡修复和分化。同时,fasudil抑制ROCK信号通路,破坏机械转导过程中肌成纤维细胞收缩力和细胞外基质刚度之间的恶性相互作用被破坏。结果表明,ZDFPR NPs恢复了博来霉素诱导的纤维化小鼠的肺机械稳态并终止了纤维化过程。该研究不仅为调节肺机械微环境提供了一种有效策略,而且为IPF治疗开辟了新方向。

特发性肺纤维化(IPF)是一种进行性且致命的肺部疾病,其特征是肺组织的结构、组成和刚度发生变化,导致肺功能永久性恶化。在新冠肺炎疫情之后,IPF的发病率和患病率逐渐增加,影响了全球约50万人,并造成了沉重的健康负担。虽然尚不清楚IPF的发病机制,但各种因素引起的机械力对其造成的有害影响持续存在。纤维化微环境中,来源于上皮-内皮屏障的破坏、细胞产生的力、外部拉伸的增加和间质压的变化等组织机械损伤,破坏了机械稳态,加剧了疾病的恶性进展,最终增加发病和死亡的风险。特别是,作为一个天生的机械敏感器官,肺受到巨大的机械力,在IPF过程中其结构和功能逐渐恶化。对肺泡的重复性机械损伤会重塑细胞骨架,激活成纤维细胞并引发细胞外基质(ECM)应力过度增加,从而破坏肺部机械微环境,损害肺泡功能,并加剧疾病的严重性。此外,机械刺激不仅影响细胞和器官功能,对发育和机械感知也必不可少。因此,有效解决机械刺激对IPF机械微环境的影响可以减缓甚至逆转纤维化进程。
在纤维化肺组织中,机械微环境会造成重大损伤,加速组织降解。一方面,II型肺泡上皮细胞(AECIIs)作为肺泡干细胞的再生能力受损,受到的机械张力逐渐增加,阻碍其分化为I型肺泡上皮细胞(AECIs)。进一步的研究表明,AECIIs的早期微损伤也会增加局部血管通透性并诱导细胞骨架重塑,从而改变细胞机械力。另一方面,虽然ECM蛋白创建了为细胞提供关键结构和生物力学信息的网络,但在机械转导过程中收缩肌成纤维细胞和致密的ECM之间恶性相互作用的生物力学调控仍有待解决。该过程中,外力刺激可以触发成纤维细胞周围整合素受体的聚集,从而改变其骨骼结构,并通过将α平滑肌肌动蛋白(α-SMA)纳入应力纤维中来产生高收缩力,从而激活肌成纤维细胞。肌成纤维细胞是纤维化发生的主要效应细胞,产生过量的ECM,导致基质变硬。随后,ECM机械应力增加触发正常成纤维细胞的再激活以进行机械转导,建立了一个由“肌成纤维细胞收缩力-ECM刚度-再激活成纤维细胞”构成的恶性循环。这种恶性循环导致肺组织内机械硬度累积,加速了IPF的恶性发展,导致呼吸衰竭风险增加。可以说,纤维化微环境的机械化既是纤维化进展的结果,也是诱因。值得注意的是,虽然目前IPF的治疗策略主要集中在调节生化信号上,但解决机械力改变对肺机械微环境造成的实质性破坏问题更为关键。
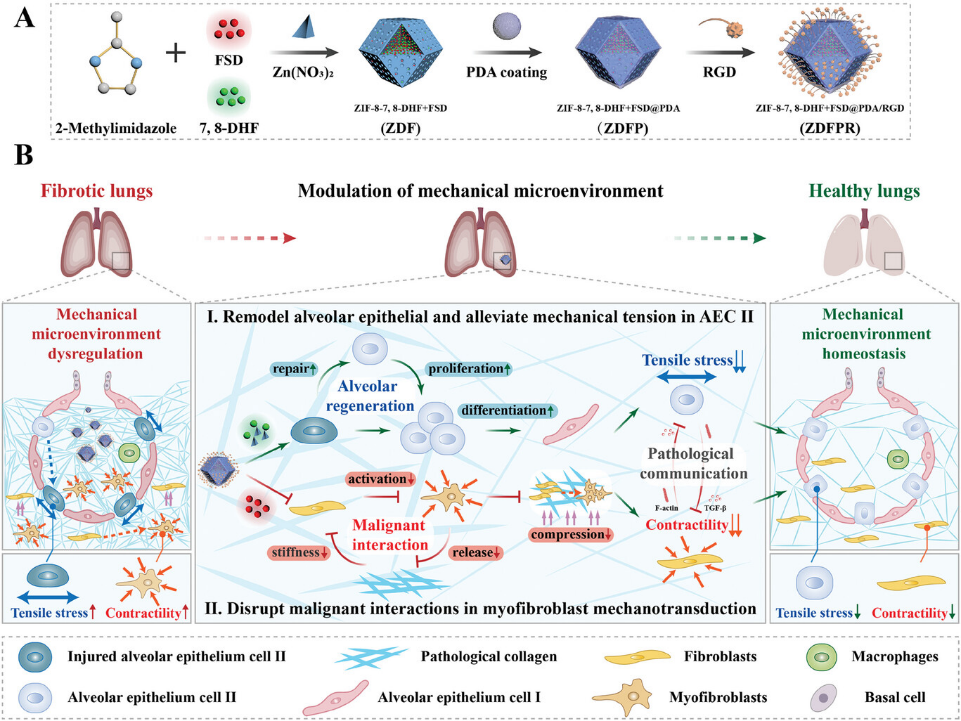
图1 ZDFPR NPs制备及IPF治疗示意图(摘自Advanced Materials)
该研究使用沸石咪唑酸盐框架8(ZIF-8)构建了一种纳米颗粒ZDFPR NPs,以解决IPF中肺机械微环境失调的问题,促进肺泡上皮重塑并减轻AECIIs中的机械压力,改善肌成纤维细胞机械转导中的恶性相互作用。生物相容性ZIF-8负载了治疗药物7,8-二羟基黄酮(7,8-DHF)和fasudil(FSD),外层包裹聚多巴胺(PDA)并用环(RGDfC)肽(RGD)修饰,靶向富含整合素-αvβ6的受损AECIIs和肌成纤维细胞。对博来霉素(BLM)诱导的纤维化小鼠进行雾化给药后,ZDFPR NPs响应pH变化释放锌离子并激活锌转运蛋白8/沉默信息调节因子1(ZIP8/SIRT1)通路以修复AECII。此外,7,8-DHF促使 AECIIs修复并分化为AECIs,并恢复正常肺泡间隙的机械微环境。Rho相关蛋白激酶(ROCK)抑制剂FSD破坏肌动蛋白细胞骨架,其对肌成纤维细胞的收缩性至关重要,同时抑制肌成纤维细胞内的机械敏感信号传导并破坏ECM和肌成纤维细胞之间的恶性相互作用。机械微环境中,ZDFPR NPs同样中断了AECIIs和成纤维细胞之间的病理通讯。因此,ZDFPR NPs可以调控受干扰的机械微环境,使其恢复正常的机械稳态,并提高IPF的治疗效果。
参考消息:
https://onlinelibrary.wiley.com/doi/full/10.1002/adma.202407661
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#特发性肺纤维化# #肺机械微环境#
32