新一代CSF-1R抑制剂vimseltinib治疗腱鞘巨细胞瘤 (TGCT) 关键3期达主要终点,ORR达40%!
2023-11-04 精准药物 精准药物 发表于加利福尼亚
Vimseltinib(DCC-3014)是一款强效、具高选择性的口服CSF1R激酶抑制剂,通过利用调节激酶构象激活的开关控制区的独特特征来选择性和有效地抑制CSF1R,用于治疗腱鞘巨细胞瘤(3期)、
腱鞘巨细胞瘤是一种罕见的局部侵袭性肿瘤,集落刺激因子1(CSF1)的过度表达会驱动巨噬细胞的招募,从而导致局部炎症和关节破坏。患者通常会出现使人衰弱的症状,造成严重的疾病负担,对于那些肿瘤不适合手术治疗的患者来说,治疗方案的需求仍未得到满足。Vimseltinib是一种口服、研究性、高选择性CSF1R抑制剂。
腱鞘巨细胞瘤(TGCT)对面临严重疼痛、僵硬和行动不便的患者的日常生活有很大的负面影响。患者需要一种既能提供强大临床疗效,又具有良好耐受性和安全性的新治疗方案。
2023年10月30日,Deciphera Pharmaceuticals(简称“Deciphera”)公布了在研药物vimseltinib在腱鞘巨细胞瘤 (TGCT) 患者中开展的关键3期MOTION研究的积极结果,预计将于明年向FDA、欧盟递交上市申请。
MOTION研究是一项随机、安慰剂对照、3 期试验,旨在评估 vimseltinib 对于既往未接受抗 CSF1/CSF1R 治疗,且不适合手术的 TGCT 患者的疗效和安全性。研究分为2个部分:在第 1 部分中,患者 (n=123) 被随机分配接受每周两次 30 mg 的 vimseltinib (n=83) 或安慰剂 (n=40),持续 24 周。主要终点是由盲法独立放射学委员会根据实体瘤 1.1版中的反应评估标准评估第 25 周时的 ORR。第 2 部分仍在进行中,所有患者均接受vimseltinib治疗。
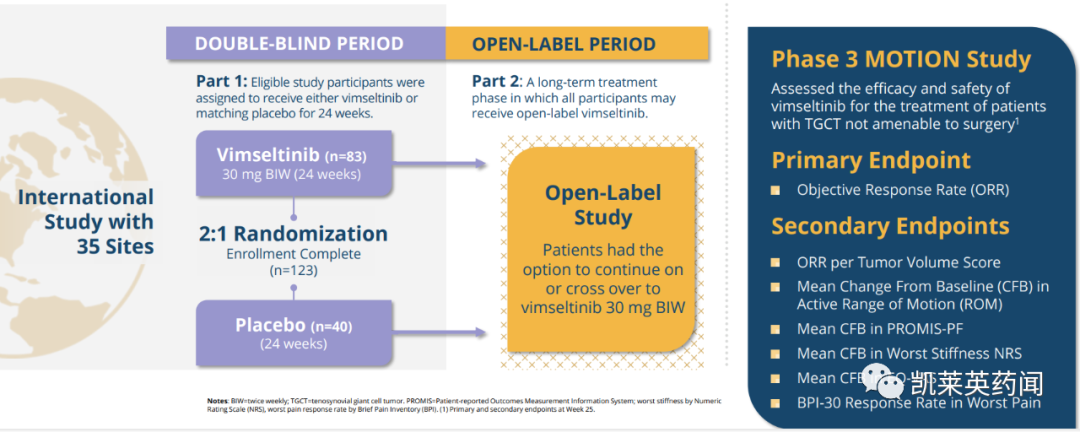
数据收集截止时间至2023 年 8 月 22 日,结果显示:
-
与安慰剂相比,使用vimseltinib 治疗的ORR 出现了统计学上显着且具有临床意义的改善。在意向治疗 (ITT) 人群中,vimseltinib 组在第 25 周的 ORR 为 40%,安慰剂组为 0%(p<0.0001)。
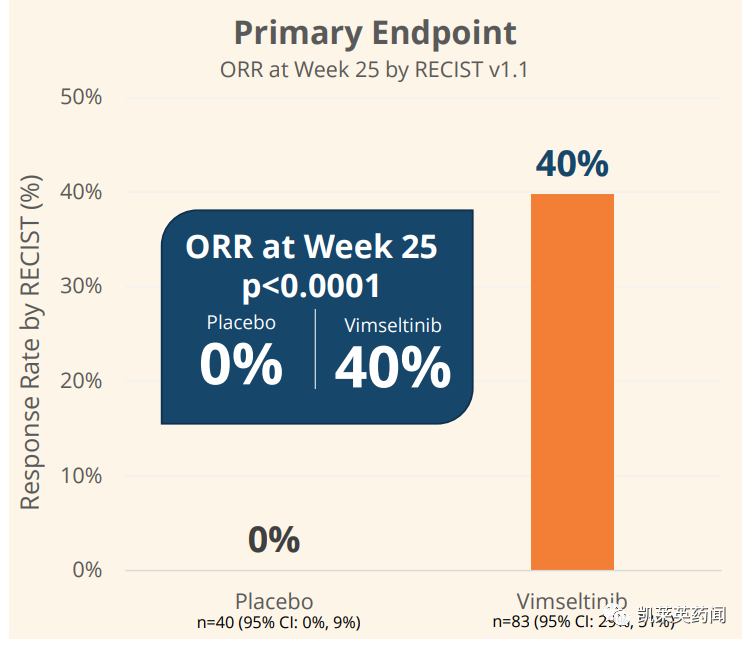
此外,该研究在第 25 周评估的所有关键次要终点上,与安慰剂相比取得了统计学上显着且具有临床意义的改善,包括肿瘤体积评分(TVS)、主动运动范围 (ROM)、身体功能、僵硬度、生活质量和疼痛。
-
其中vimseltinib组在TVS上的ORR为67%,安慰剂组为0%(p<0.0001);
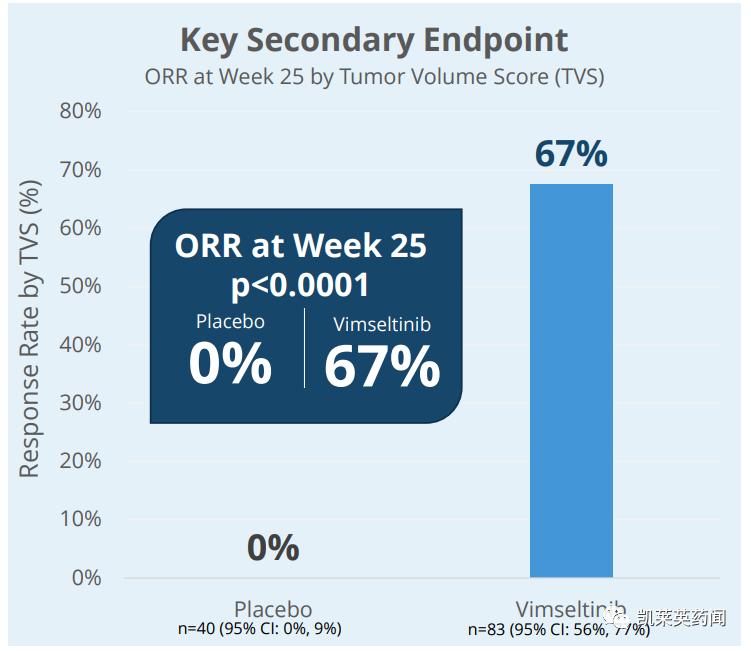
-
活性 ROM 相对于基线的平均改善了18.4%,而安慰剂则改善了 3.8% (p=0.0077)。
在安全性上,与之前披露的数据一致。没有证据表明接受vimseltinib治疗的患者存在胆汁淤积性肝毒性;有 6% 的患者因治疗引起的不良事件 (TEAE) 导致治疗中断。
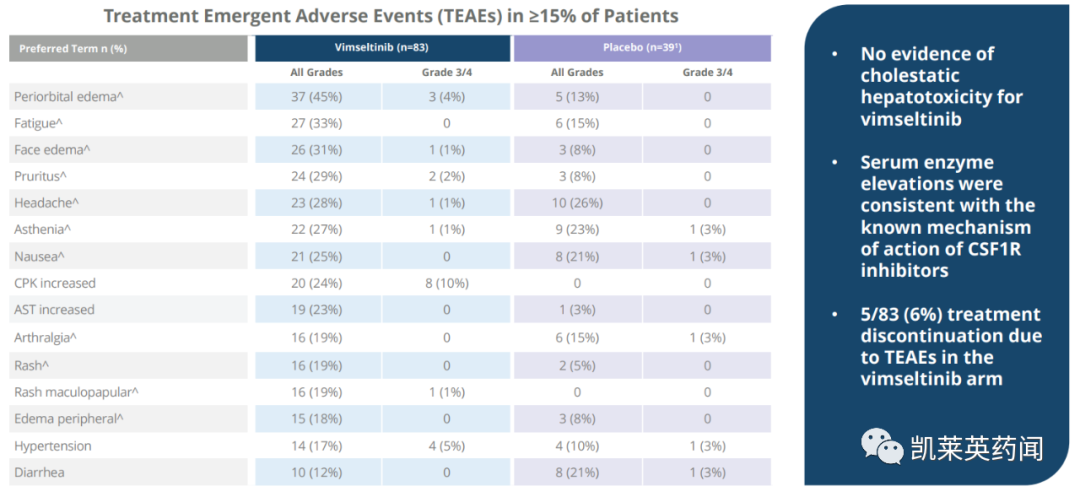
其他功效和安全性结果预计将在即将召开的医学会议上公布。
关于Vimseltinib
Vimseltinib(DCC-3014)是一款强效、具高选择性的口服CSF1R激酶抑制剂,通过利用调节激酶构象激活的开关控制区的独特特征来选择性和有效地抑制CSF1R,用于治疗腱鞘巨细胞瘤(3期)、色素沉着的绒毛结节性滑膜炎(3期)和实体瘤(2期)等。
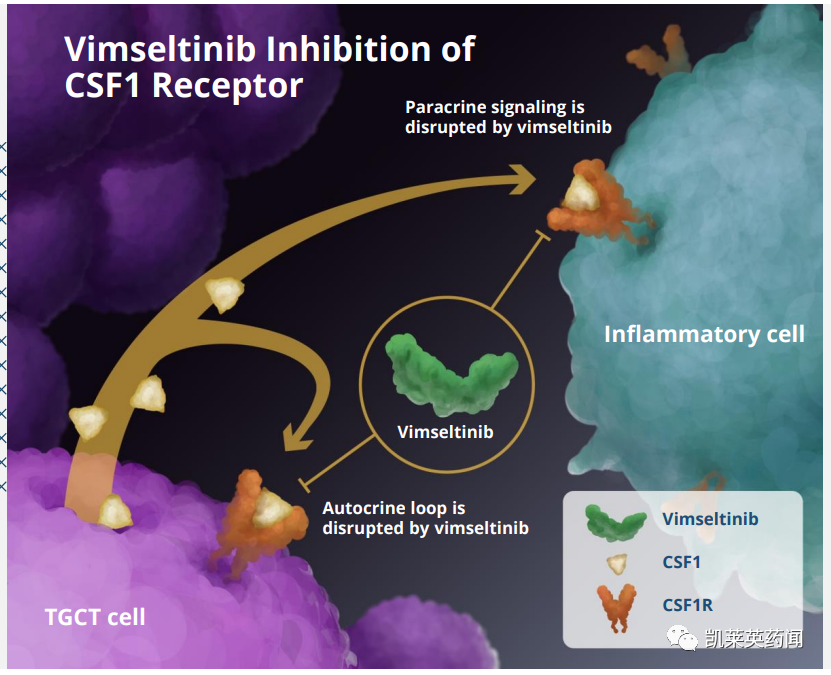
临床前研究显示,vimseltinib在体外和体内持久地抑制CSF1R活性,消耗巨噬细胞和其他依赖CSF1R的细胞,并导致在小鼠癌症模型中抑制肿瘤生长和骨退化。在一项I期临床研究中,vimseltinib治疗可调节CSF1R抑制的生物标志物,并降低TGCT患者的肿瘤负担。
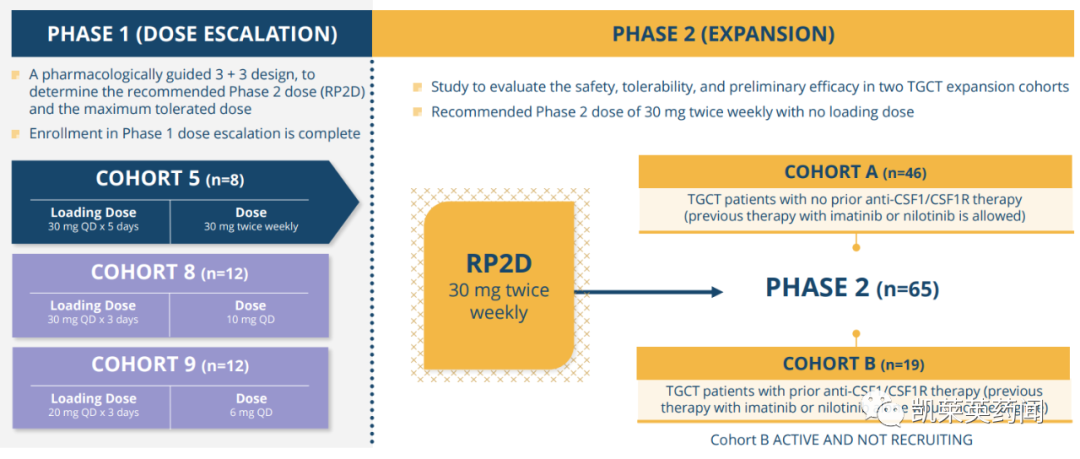
同日,公司还公布了一项国际、多中心、开放标签的1/2期研究的最新结果,该研究评估了vimseltinib对TGCT患者的安全性和有效性。截至2023年6月27日,共有97例患者入组,具体结果显示:
-
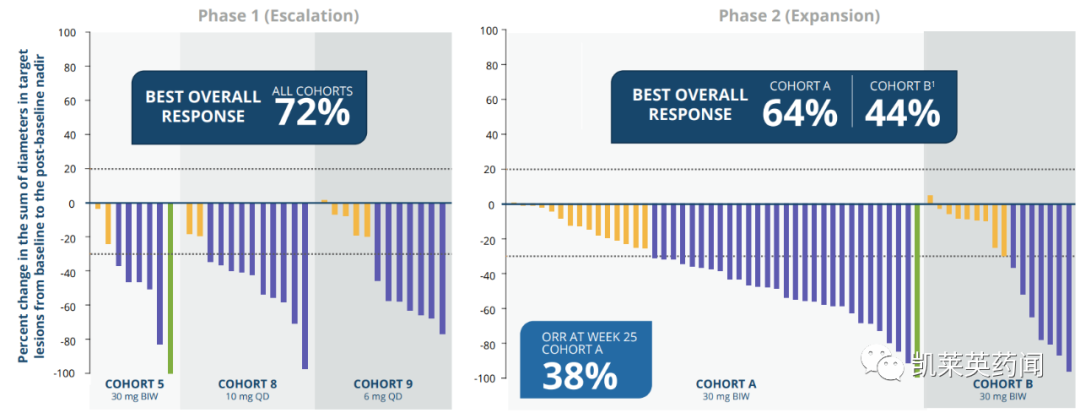
Vimseltinib的抗肿瘤活性随着时间的推移而增强;
-
在第25周,患者经历了有临床意义的症状性获益,包括每个TVS的最佳ORR (A组)、活动范围、身体功能、僵硬和疼痛。
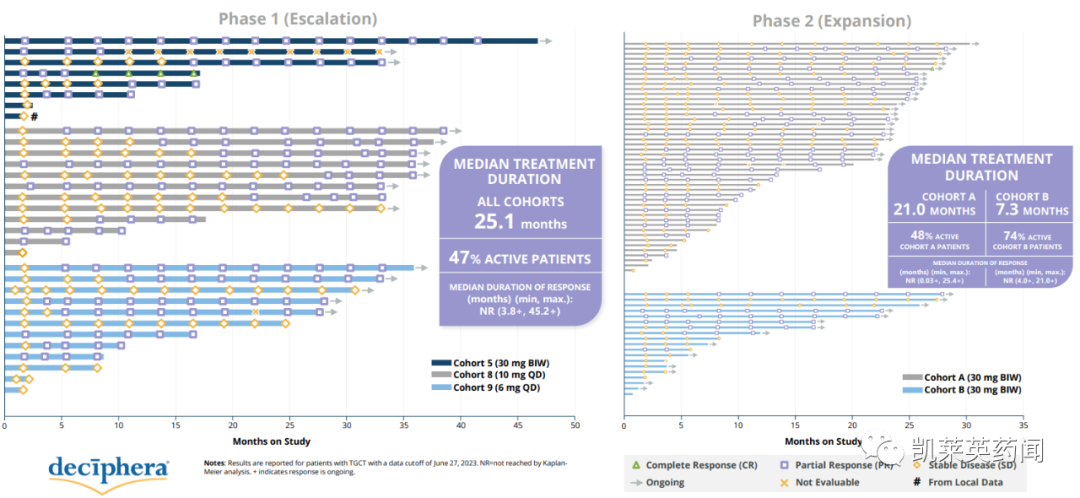
在安全性上,使用vimseltinib治疗耐受性良好,与先前披露的数据一致。没有胆汁淤积性肝毒性的证据;9%的患者因TEAE而停止治疗。
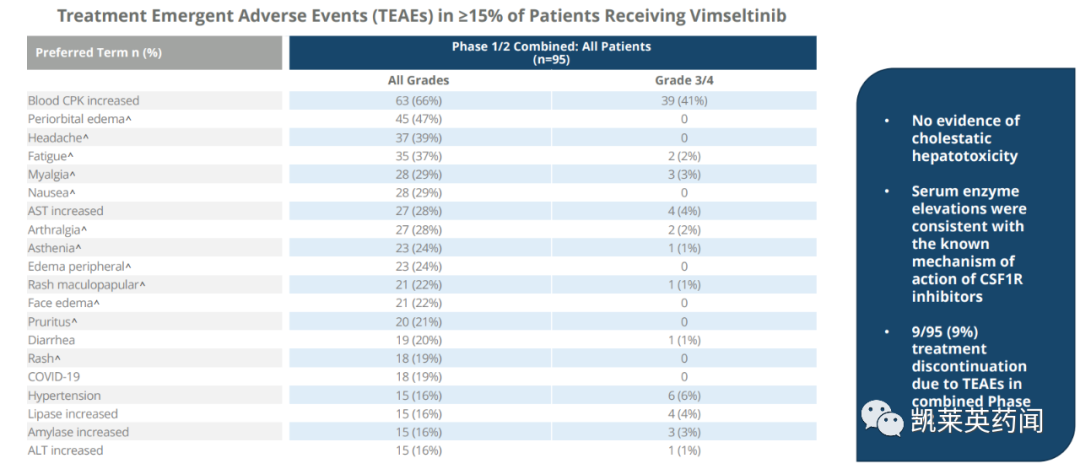
这项研究的完整数据将于2023年11月1日至4日,在爱尔兰都柏林举行的2023年结缔组织肿瘤学会年会上公布。
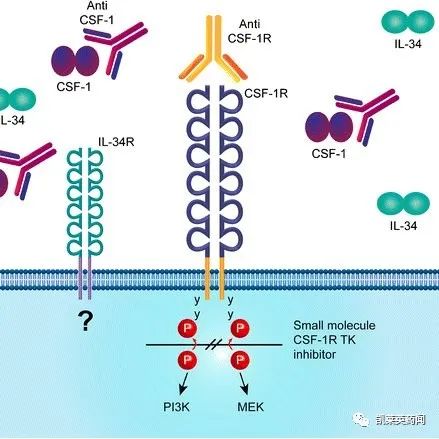
关于CSF-1R
CSF-1R是细胞因子CSF-1受体,同时是受体酪氨酸激酶中的重要一员,该靶点与炎症的发生、发展紧密相关。在肿瘤微环境(TME)中,CSF-1R与其配体CSF-1的信号可以传导诱导肿瘤相关巨噬细胞(TAM)的分化和存活,进而促进肿瘤细胞生长。
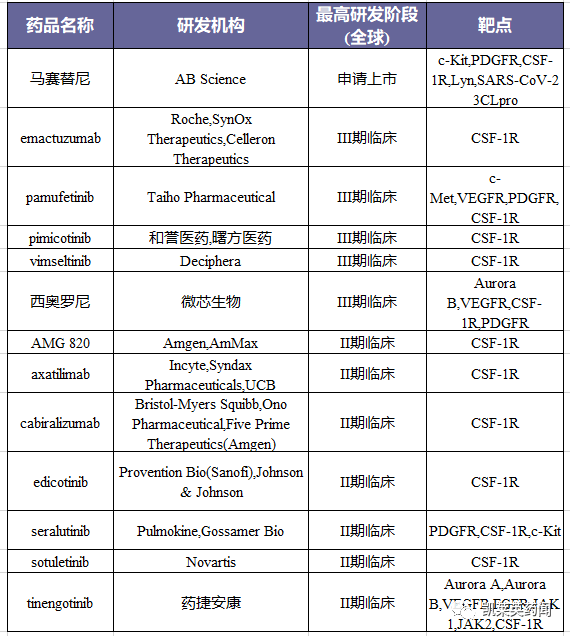
据不完全统计,目前获批的CSF-1R抑制剂有三种,分别是第一三共的pexidartinib、诺华的尼洛替尼,以及和黄医药的索凡替尼;中国尚未有高选择性CSF-1R抑制剂获批上市。将目前处于II临床以上阶段的在研药物统计如下:
关于腱鞘巨细胞瘤
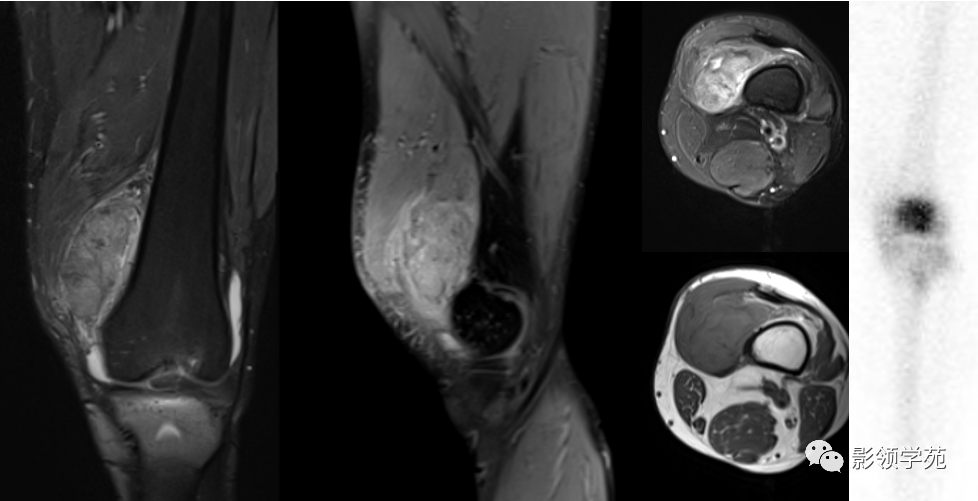
腱鞘巨细胞瘤(TGCT)是由关节滑液、囊或腱鞘滑膜引起的罕见良性增生性炎症性疾病,根据生长模式可分类为弥漫性腱鞘巨细胞瘤(D-TGCT)和局限性腱鞘巨细胞瘤(L-TGCT)。前者更具侵袭性,多发病于膝关节、踝关节和髋关节,后者更常见,多发病于膝关节、手和腕关节。
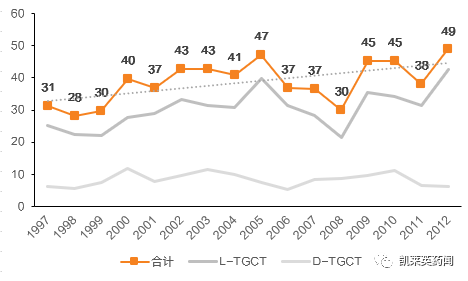
虽然TGCT属于一种罕见疾病,但根据流行病学数据,其发病率在1999-2012 年间总体呈增长趋势,2012 年发病率为49 人每百万人。
TGCT 每百万人发病患者数
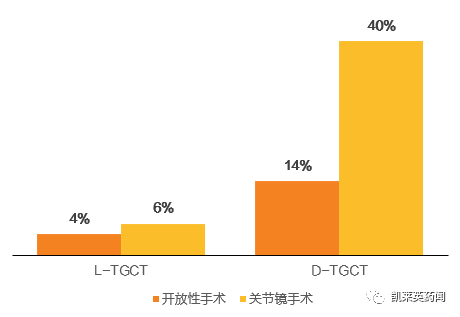
TGCT 的治疗方法包括手术、放射疗法、冷冻疗法、全身疗法。治疗结果表明,手术可以切除TGCT,但可能引起多种并发症多,且可能伴有有复发风险。一项荷兰的统计报告指出,2009-2014年间,近65%L-TGCT 患者与49%D-TGCT 患者使用开放性手术进行治疗,随访后计算复发率分别为4%与14%。另外有超过20%的TGCT 患者使用关节镜手术进行治疗,随访后计算复发率分别为6%与40%。
TGCT 复发率情况
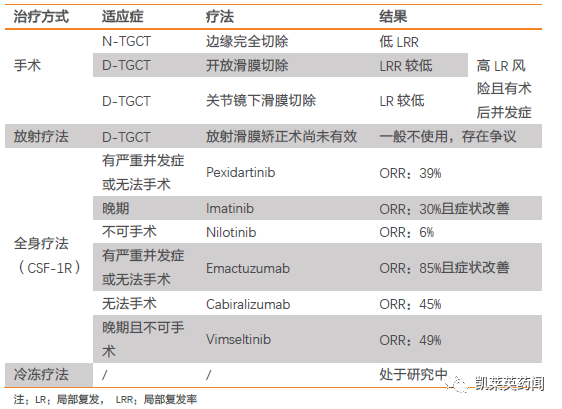
CSF-1 在所有TGCT 中高表达,为靶向CFS-1R 提供基础,使用CSF-1R 抑制剂,可以显著缩小肿瘤,改善症状,实现长期的疾病控制。
TGCT 的治疗范式
关于Deciphera
Deciphera是一家生物制药公司,专注于发现、开发和商业化改善癌症患者的新药,公司利用专有的开关控制激酶抑制剂平台和激酶生物学方面的深厚专业知识,开发广泛的创新药物组合。

公司有多种候选产品处于临床研究阶段,除vimseltinib外,公司Ripretinib(商品名:Qinlock,瑞派替尼)是一种开关控制酪氨酸激酶抑制剂,被设计用于广泛抑制 KIT 和 PDGFRA 突变激酶,目前已在澳大利亚、加拿大、中国(包括香港、台湾、澳门),欧盟、以色列、新西兰、新加坡、瑞士、英国和美国等多地获批;再鼎医药拥有其在在大中华区(中国大陆、香港、澳门和台湾)的开发和商业化权利。
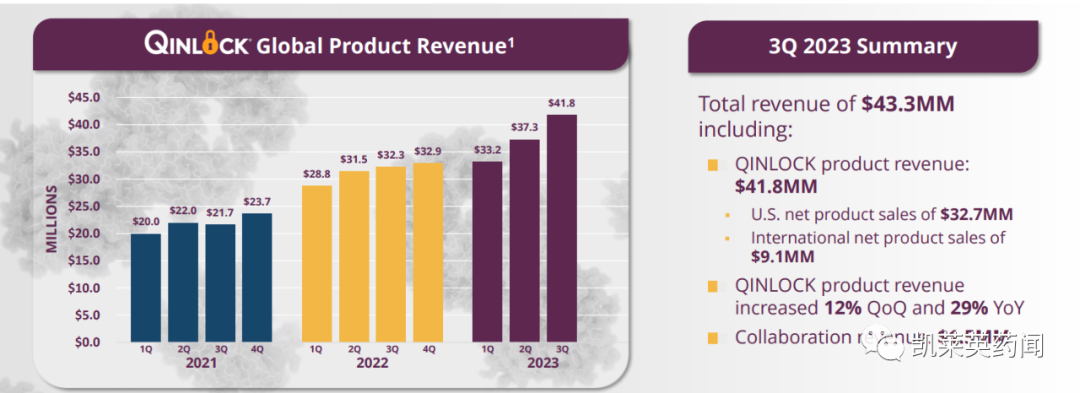
2023年Q3季度,公司总收入为 4330 万美元;与 2022 年Q3季度相比,Qinlock的产品净收入增长 29%,达到 4180 万美元。
参考资料
1、公司官网、天风证券
2、公众号:智慧芽新药科讯
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言