Nature Cancer:LCOR mRNA疗法联合PD-L1抑制剂成功挑战三阴性乳腺癌
2022-04-05 医药魔方 医药魔方
三阴性乳腺癌(TNBC)占所有乳腺癌的12%-20%,因雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)均为阴性表达得名;相对于其它类型的乳腺癌,在年轻女性中更为常见;死亡率高
三阴性乳腺癌(TNBC)占所有乳腺癌的12%-20%,因雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)均为阴性表达得名;相对于其它类型的乳腺癌,在年轻女性中更为常见;死亡率高、容易复发和转移;对激素疗法和靶向治疗都不敏感,能用的治疗方法几乎只有化疗,但大多数患者很快会产生耐药性,且预后不佳;如果扩散到机体的其它部位,生存期通常只有1年左右。
以PD-1/PD-L1抗体为代表的免疫检查点抑制剂能够释放机体的抗肿瘤免疫反应,进而发挥抗癌作用。尽管已有PD-1/PD-L1抗体(如帕博利珠单抗)被批准用于治疗三阴性乳腺癌(TNBC),但许多患者对这类免疫疗法无响应或会产生耐药性。近日,来自西班牙的一个科学家团队发现了一种能够提高免疫检查点抑制剂治疗这种侵袭性乳腺癌疗效的很有前途的方法。相关研究成果于3月17日发表在Nature Cancer杂志上。

来源:Nature Cancer
来自Hospital del Mar Medical Research Institute的研究小组发现,在三阴性乳腺癌(TNBC)中,癌症干细胞能够躲避免疫系统,而一种名为LCOR(ligand-dependent corepressor)的蛋白质的表达水平增加可以干扰这种免疫逃逸,使免疫系统“看得见”癌症干细胞,进而产生抗肿瘤作用。受新冠mRNA疫苗的启发,研究人员设计了一种mRNA疗法来生产LCOR。在小鼠中,这种mRNA疗法与抗PD-L1检查点抑制剂联合使用时,显著改善了抗肿瘤效果。
在三阴性乳腺癌(TNBC)中,肿瘤干细胞可能占肿瘤总数的5%-50%,并可引起新的肿瘤。LCOR介导乳腺癌干细胞的分化,因此研究团队想知道该蛋白是否在TNBC对检查点抑制剂的耐药中发挥了作用。
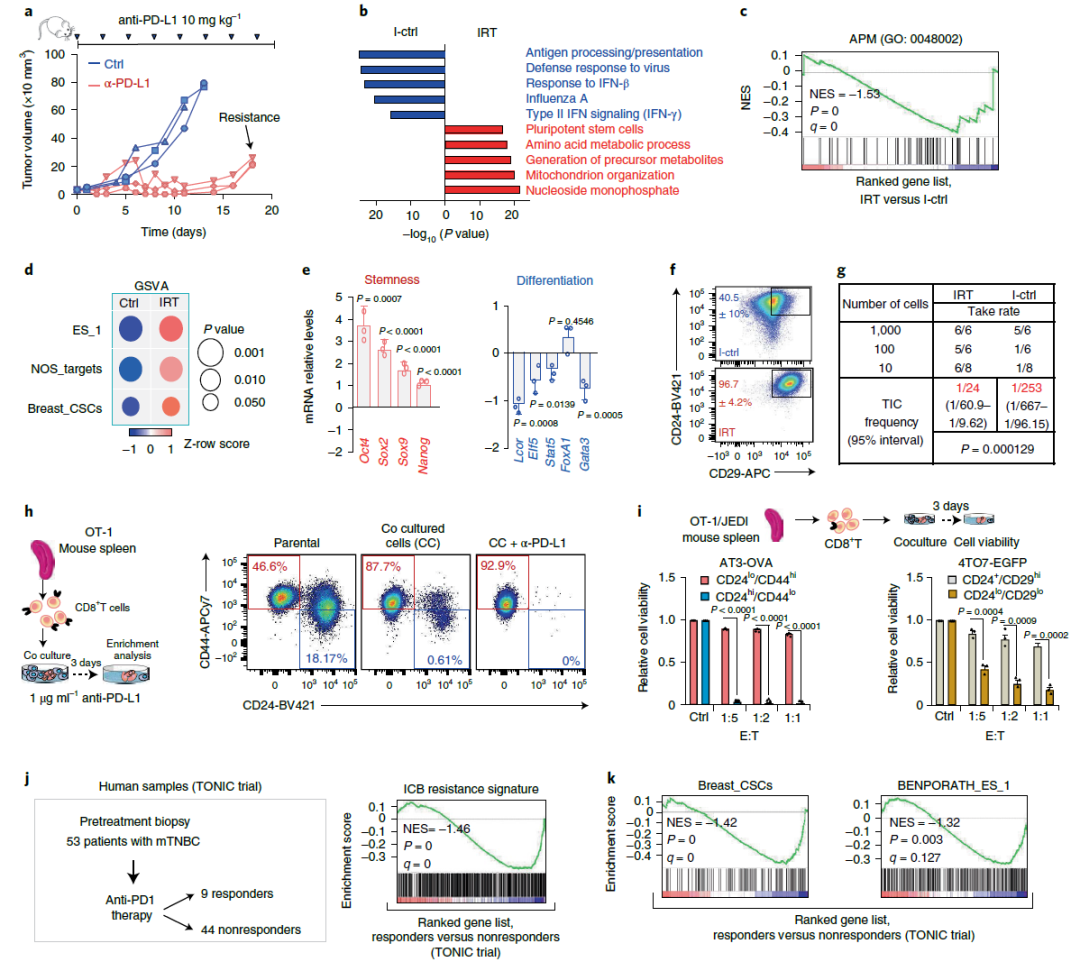
癌症干细胞(CSC)导致免疫编辑逃逸及免疫检查点抑制剂(ICB)耐药(来源:Nature Cancer)
通过对来自小鼠的PD-L1免疫疗法耐药肿瘤的研究,科学家们发现,LCOR表达水平低的癌症干细胞抗原加工和呈递机制减少。而将抗原呈递到癌细胞表面是免疫系统区分正常细胞和肿瘤细胞并攻击肿瘤细胞的关键步骤。
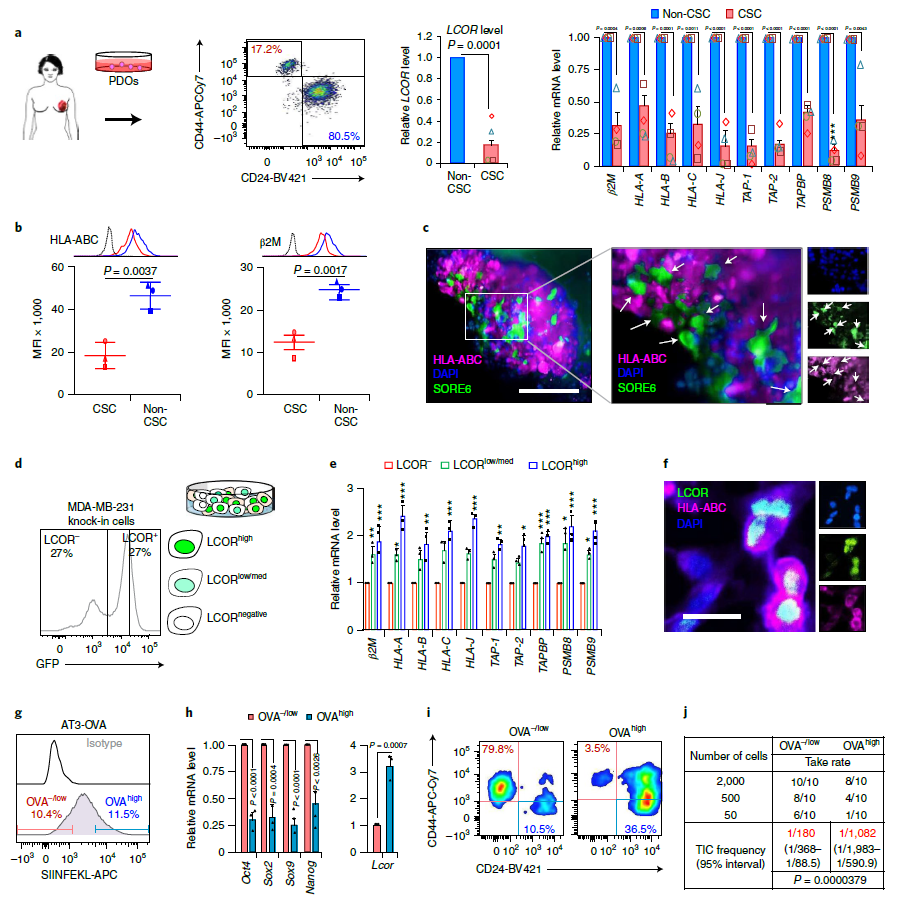
LCOR表达水平低的乳腺癌CSC抗原呈递机制活性低(来源:Nature Cancer)
接着,研究发现,在实验室研究中,LCOR过表达的TNBC肿瘤细胞增加了T细胞的激活,具体表现为,有更多的T细胞进入肿瘤并发挥杀伤作用。
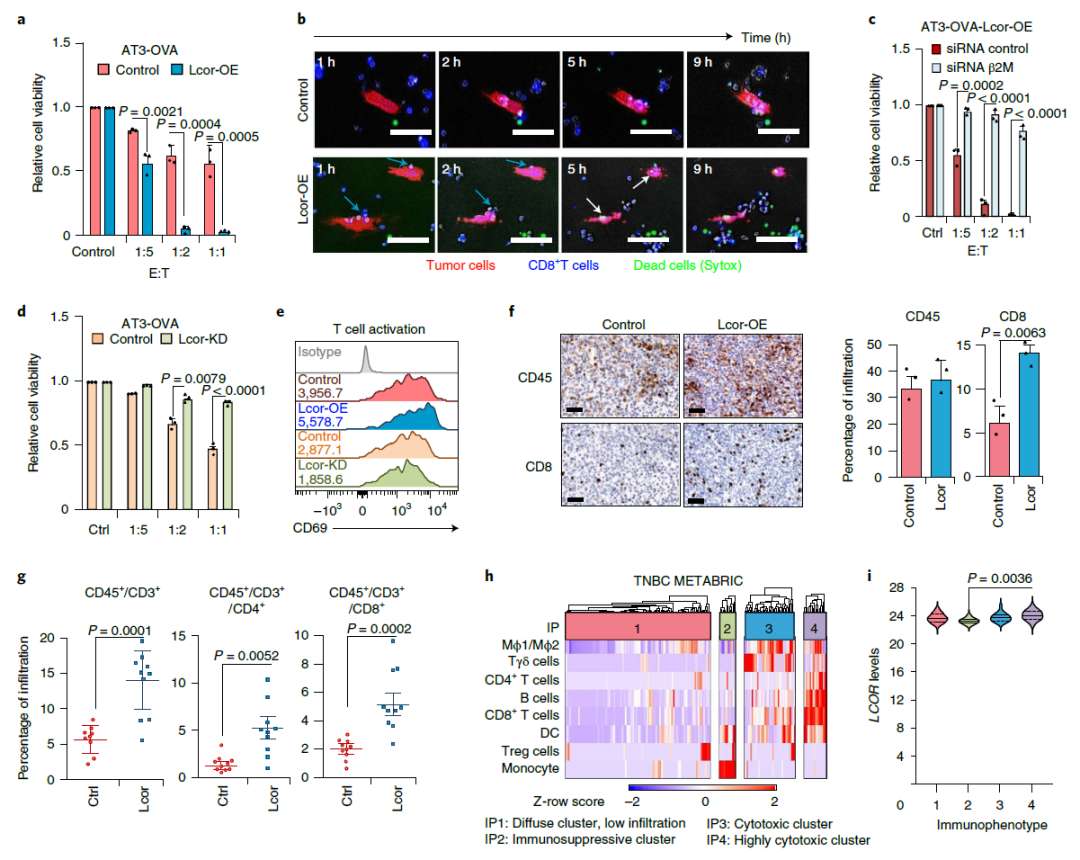
LCOR促进肿瘤免疫浸润和杀伤(来源:Nature Cancer)
进一步,科学家们还研究了一些来自TNBC患者的肿瘤样本,这些患者参与了不同的PD-1/L1抑制剂(包括Tecentriq、Opdivo和Imfinzi)临床试验。分析结果显示,更高的LCOR表达与患者对这类检查点抑制剂响应更好有关。
为了验证这一发现,科学家们在三阴性乳腺癌(TNBC)小鼠模型中应用了抗PD-L1疗法。结果显示,与继续生长的对照肿瘤相比,接受抗PD-L1治疗的、过表达LCOR的肿瘤完全消退,所有小鼠在20天内不再有癌症迹象,达到完全缓解。
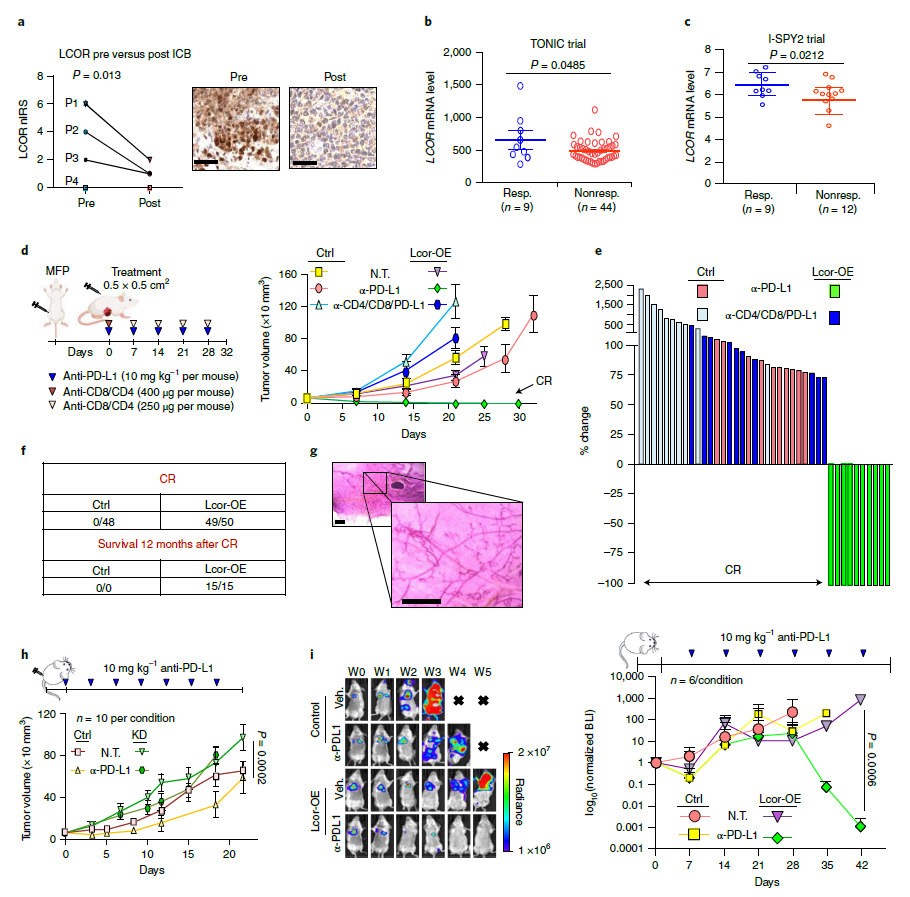
LCOR联合ICB的临床前和临床意义(来源:Nature Cancer)
在5个独立的实验中,研究团队观察到50个LCOR过表达肿瘤中有49个完全缓解(CR)。值得注意的是,唯一没能实现完全缓解的肿瘤以某种方式LCOR表达丢失。在抗PD-L1治疗停止2个月后,所有49个达到CR的乳腺均保持无瘤状态。研究人员对其中15只小鼠进行了长达1年的随访,没有小鼠肿瘤复发,所有小鼠的腺体都是无瘤状态(上图f,g)。“这表明我们已经不可逆转地根除了肿瘤,治愈了这些小鼠。”研究人员在论文中写道。
受新冠mRNA疫苗的启示,研究小组认为,通过递送mRNA来表达治疗性蛋白是一种可行的策略,因此,他们设计了一种mRNA疗法来恢复肿瘤细胞中的LCOR表达。
在小鼠中,与PD-L1抑制剂单独治疗或对照疗法相比,LCOR mRNA疗法(通过细胞外囊泡递送)联合PD-L1抑制剂克服了肿瘤的耐药性,导致小鼠生存期显著延长,并完全清除了肺转移。
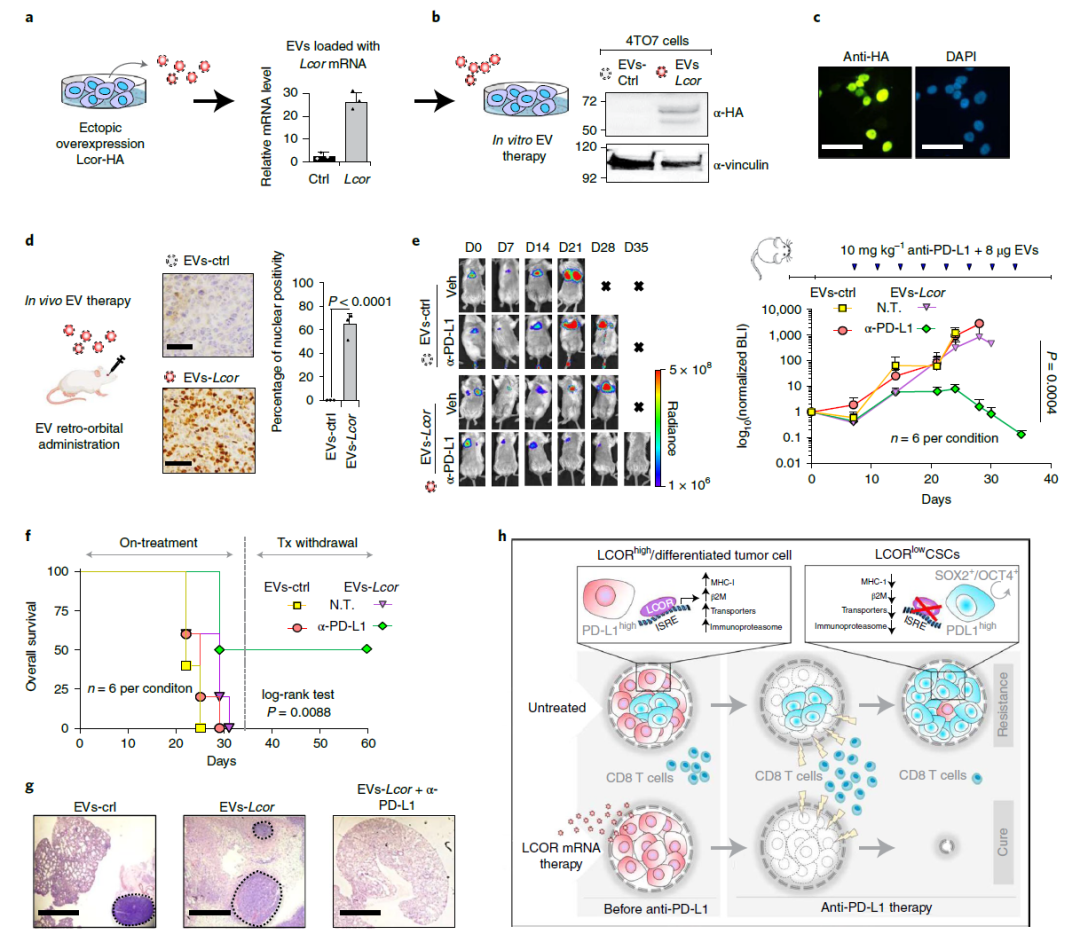
EV递送Lcor mRNA疗法联合ICB治疗乳腺癌转移的疗效
总结来说,科学家们认为,这些数据支持LCOR作为提高检查点抑制剂治疗TNBC有效性的一个有希望的靶点。通过增加肿瘤细胞的抗原呈递,LCOR mRNA疗法可与PD-1/PD-L1抑制剂联合使用,这种策略有望大大提高免疫疗法治疗TNBC的成功率。
“我们的实验结果表明,基于LCOR的治疗策略使TNBC对免疫疗法产生了前所未有的敏感性,让这类耐药肿瘤几乎被治愈了。这些积极结果鼓舞我们往临床试验迈进,同时我们将探索这种策略是否能够适用于其它肿瘤。”共同领导该研究的Joan Albanell博士说道。
据悉,Hospital del Mar Medical Research Institute已经就该发现(LCOR联合免疫疗法)申请了专利,并计划创建一个衍生公司,以进一步开发这类抗癌mRNA疗法。
原始出处:
Iván Pérez-Núñez et al. LCOR mediates interferon-independent tumor immunogenicity and responsiveness to immune-checkpoint blockade in triple-negative breast cancer. Nature Cancer(2022).
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#阴性乳腺癌#
122
#Nat#
95
#抑制剂#
0
#RNA疗法#
91
#PD-L1抑制剂#
96
#PD-L1#
77
#mRNA疗法#
90
#三阴性#
127