tRF-Pro-CGG对小鼠胰腺癌细胞生物学行为的影响及其分子机制
2023-05-16 中国癌症杂志 网络 发表于上海
过表达tRF-Pro-CGG可能通过抑制PI3K/AKT信号转导通路,从而抑制胰腺癌裸鼠移植瘤的生长。
1. 材料和方法
1.1 材料
小鼠胰腺癌细胞系pan02、人胰腺癌细胞系Capan-2和正常胰腺细胞HPDE6-C购自中国科学院上海生命科学研究院细胞资源中心,小鼠胰腺癌细胞系LTPA购自上海弘顺生物科技有限公司,胎牛血清(fetal bovine serum,FBS)、DMEM培养基、胰蛋白酶、青链霉素购自美国Gibco公司,tRF-Pro-CGG mimics、NC mimics、tRF-Pro-CGG inhibitor、NC inhibitor质粒、抗tRF-Pro-CGG及riboFECTTMCP转染试剂购自广州锐博生物技术有限公司,RTFQ-PCR试剂盒购自日本Takara公司,细胞计数试剂盒(cell counting kit-8,CCK-8)购自美国MCE公司,Matrigel购自美国BD公司,免疫印迹化学发光试剂购自美国Millipore公司,β-actin抗体、抗Ki-67抗体、抗vimentin、抗E-cadherin、抗PI3K、抗P-PI3K、抗AKT及抗P-AKT购自英国Abcam公司,BALB/c裸鼠购自杭州子源实验动物科技有限公司。
1.2 方法
1.2.1 细胞培养和转染
上述细胞在37℃、CO2体积分数为5%的DMEM培养基中培养,该培养基含有10%的FBS、100 U/mL链霉素和100 U/mL青霉素。将处于对数生长期的细胞以每孔2.5×105个细胞/mL的密度加入到6孔板中,用完全培养基培养1 d,直到密度达到80%。根据LipofectamineTM3000的使用说明书,用tRF-Pro-GG mimics及inhibitor转染相关细胞后培养24 h,进行后续实验。
1.2.2 RTFQ-PCR实验
利用TRIzol试剂(美国ThermoFisher公司)分离细胞中的总RNA,通过反转录总RNA和扩增试剂盒制备cDNA模板,并进行RTFQ-PCR扩增,扩增条件为:95℃ 5 min;95℃ 15 s,58℃ 30 s,72℃ 30 s,共40个循环。本研究使用的引物购自广州锐博生物技术有限公司,U6被用作内部参考。tRF-Pro-CGG引物的正义链为5‘-GGCTCGTTGGTCTAGGGGTATG-3‘,反义链为5‘-ACGTGTGCTCTTCCGATCTGAA-3‘;U6引物的正义链为5‘-GCTTCGGCAGCACAT ACTAAAAT-3‘,反义链为5‘-CGCTTCACGAA TTTGCGTGTCAT-3‘。利用2-ΔΔCt计算tRF-Pro-CGG的平均相对表达水平。
1.2.3 CCK-8实验
将对数生长期的细胞以1×104个细胞/孔均匀铺设于96孔板中,每孔体积为100 μL,细胞附壁后分别于第0、24、48、72和96 h加入10 μL CCK-8试剂,外围孔填充磷酸缓冲盐溶液(phosphate-buffered saline,PBS),将96孔板置于37℃、CO2体积分数为5%的培养箱中温育2 h,测量450 nm处细胞的吸光度(D)值。
1.2.4 Transwell迁移和侵袭实验
将处于对数生长期的细胞饥饿6 h,用无血清培养基将50 mg/L的matrigel按1∶8的比例稀释,使用前与培养基混合,用胰蛋白酶消化细胞后用含有10%FBS的完全培养基终止消化,细胞以10 000 r/min离心5 min后弃去上清液,PBS洗涤2次后用无血清培养基重新悬浮。细胞计数后在含有基质和不含基质的上腔室中分别加入5×104个细胞,体积均为500 μL。将腔室放入24孔板中,并在下腔室中加入700 μL含有10%FBS的完全培养基,细胞在37℃、CO2体积分数为5%的条件下培养24 h,随后取出腔体放入新的孔中,并用PBS清洗2次,用4%多聚甲醛溶液固定15 min后,用800 μL 0.5%结晶紫染色液染色20 min,干燥后在显微镜下对细胞进行计数并拍照。
1.2.5 动物实验
选取5周龄雌性BALB/c裸鼠随机分为4组(每组9只),将过表达tRF-Pro-CGG(tRF-Pro-CGG mimics组和NC mimics组)的pan02细胞及敲低tRF-Pro-CGG(tRF-Pro-CGG inhibitor组和NC inhibitor组)的LTPA细胞分别经皮下注射到裸鼠体内,每只裸鼠注射浓度为5×106个细胞/mL的0.2 mL单细胞悬液,建立胰腺癌裸鼠皮下移植瘤模型。利用动物活体成像系统观察并记录肿瘤生长情况,取下瘤体后称重,将瘤体在4%多聚甲醛溶液中固定后常规做H-E染色。建立裸鼠胰腺癌肝转移模型,随机分为4组(每组5只),将过表达tRF-Pro-CGG(tRF-Pro-CGG mimics组和NC mimics组)的pan02细胞及敲低tRF-Pro-CGG(tRF-Pro-CGG inhibitor组和NC inhibitor组)的LTPA细胞分别经尾静脉注射到裸鼠体内,每只裸鼠注射浓度为2×106个细胞/mL的0.2 mL单细胞悬液,每隔4 d经尾静脉追加上述各组细胞,10周后处死解剖裸鼠并观察胰腺癌肝脏转移瘤的结节个数。
1.2.6 蛋白质印迹法(Western blot)实验
收集各组稳定转染tRF-Pro-CGG的细胞或液氮研磨肿瘤组织,添加裂解液(美国Sigma-Aldrich公司)后从细胞或组织中提取总蛋白,用二辛可宁酸(bicinchoninic acid,BCA)试剂盒检测蛋白浓度,用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)将蛋白转移到PVDF膜上,用5%脱脂牛奶密封4 h,加入抗tRF-Pro-CGG、Ki-67、抗vimentin、抗E-cadherin、抗PI3K、P-PI3K、抗AKT及P-AKT的一抗4℃温育蛋白过夜,含有吐温-20三乙醇胺缓冲盐溶液(tris-buffered saline Tween,TBST)洗涤后加入二抗,在常温下温育1 h,最后加入免疫印迹化学发光试剂后凝胶成像曝光,以β-肌动蛋白为内部对照,用ImageJ软件分析目标蛋白的灰色值。
1.3 统计学处理
服从正态分布的计量资料采用x±s表示,两组比较采用独立样本t检验,多组间比较采用单因素方差分析。计数资料两组比较采用Fisher确切概率法。P<0.05为差异有统计学意义。
2. 结 果
2.1 tRF-Pro-CGG在胰腺癌细胞系中的表达
RTFQ-PCR结果显示,tRF-Pro-CGG在小鼠胰腺癌细胞系pan02、LTPA和人胰腺癌细胞系Capan-2中的表达低于在正常胰腺细胞HPDE6-C中的表达,在pan02细胞中的表达最低,在LTPA细胞中的表达相对较高,故选用pan02细胞和LTPA细胞进行tRF-Pro-CGG的过表达及敲低实验(图1)。
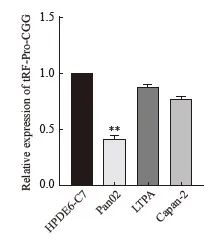
图1 tRF-Pro-CGG在小鼠胰腺癌细胞系pan02、LTPA及人胰腺癌细胞系Capan-2中的表达
Fig. 1 tRF-Pro-CGG expression in mouse pancreatic cancer cell lines pan02 and LTPA, as well as human pancreatic cancer cell line Capan-2
**: P<0.01, compared with HPDE6-C cell line.
2.2 tRF-Pro-CGG稳定过表达及敲低细胞系的构建
RTFQ-PCR结果显示,与NC mimics组相比,tRF-Pro-CGG mimics组中tRF-Pro-CGG的表达水平显著升高(P<0.001);与NC inhibitor组相比,tRF-Pro-CGG inhibitor组中tRF-Pro-CGG的表达水平显著降低(P<0.001)。Western blot结果显示,与NC mimics组相比,tRF-Pro-CGG mimics组中tRF-Pro-CGG蛋白表达水平显著升高(P<0.01);与NC inhibitor组相比,tRF-Pro-CGG inhibitor组中tRF-Pro-CGG蛋白表达水平显著降低(P<0.01,图2)。
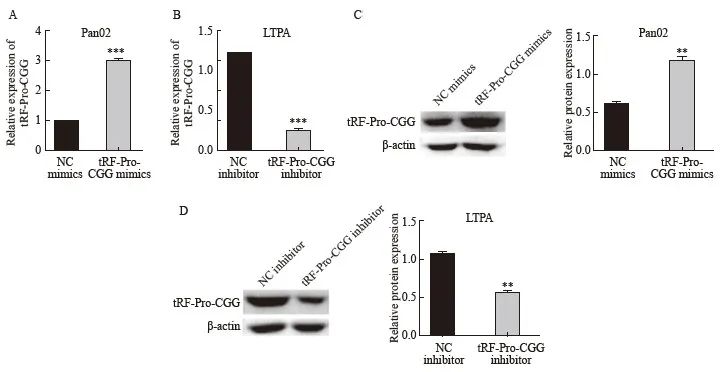
图2 过表达及敲低tRF-Pro-CGG后pan02细胞tRF-Pro-CGG表达
Fig. 2 Expression of tRF-Pro-CGG in pan02 cells after overexpression and knockdown of tRF-Pro-CGG
A, B: RTFQ-PCR was used to detect mRNA expression of tRF-Pro-CGG in each group; C, D: Western blot was used to detect protein expression of tRF-Pro-CGG in each group. ***: P<0.001, compared with NC mimics or NC inhibitor by RTFQ-PCR; **: P<0.01, compared with NC mimics or NC inhibitor by Western blot.
2.3 tRF-Pro-CGG影响小鼠胰腺癌细胞增殖
tRF-Pro-CGG mimics组中pan02细胞增殖能力与NC mimics组相比显著降低(P<0.01);tRF-Pro-CGG inhibitor组中pan02细胞增殖能力与NC inhibitor组相比显著升高(P<0.01,图3)。
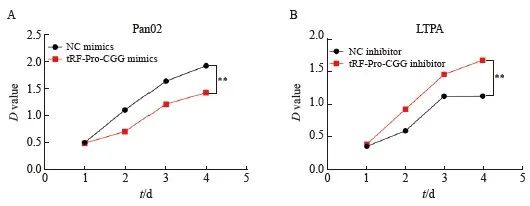
图3 过表达及敲低tRF-Pro-CGG对pan02细胞增殖的影响
Fig. 3 Effects of overexpression and knockdown of tRF-Pro-CGG on the proliferation of pan02 cells
A, B: CCK-8 was used to detect changes of cell Proliferation in each group. **:P<0.01, compared with NC mimics or NC inhibitor.
2.4 tRF-Pro-CGG影响小鼠胰腺癌细胞迁移和侵袭能力
与NC mimics组相比,tRF-Pro-CGG mimics组中细胞迁移和侵袭数目显著减少(P <0.001);与NC inhibitor组相比,tRF-Pro-CGG inhibitor组中细胞迁移和侵袭数目显著升高(P<0.001,图4)。
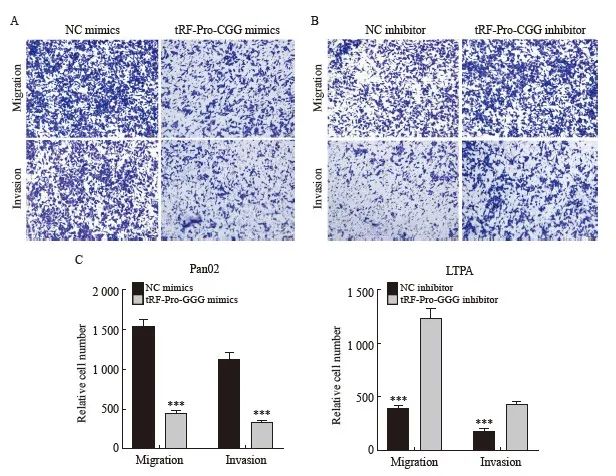
图4 过表达及敲低tRF-Pro-CGG对pan02细胞迁移和侵袭能力的影响
Fig. 4 Effects of overexpression and knockdown of tRF-Pro-CGG on migration and invasion ability of pan02 cells
A-C: Transwell was used to detect changes of cell migration and invasion in each group; ***: P<0.001, compared with NC mimics or NC inhibitor.
2.5 tRF-Pro-CGG影响胰腺癌裸鼠移植瘤的生长
与NC mimics组相比,tRF-Pro-CGG mimics组中裸鼠瘤体的体积和重量均显著降低(P <0.01),然而两组裸鼠的体重变化差异无统计学意义(P>0.05);与NC inhibitor组相比,tRF-Pro-CGG inhibitor组中裸鼠瘤体的体积和重量均显著升高(P<0.01),然而两组裸鼠的体重变化差异无统计学意义(P>0.05,图 5)。

图5 过表达及敲低tRF-Pro-CGG对裸鼠胰腺癌移植瘤生长的影响
Fig. 5 Effects of overexpression and knockdown of tRF-Pro-CGG on the growth of pancreatic cancer transplant tumors in nude mice
A-C: Effects of overexpression of tRF-Pro-CGG on tumor volume, weight and body weight of nude mice; D-F: Effects of knockdown of tRF-Pro-CGG on tumor volume, weight and body weight of nude mice. **: P<0.01, compared with NC mimics or NC inhibitor.
2.6 tRF-Pro-CGG对胰腺癌裸鼠移植瘤组织形态结构的影响
与NC mimics组相比,tRF-Pro-CGG mimics组坏死组织明显增多,大部分为凝固性坏死,坏死周围可见凋亡细胞及坏死细胞残影;与NC inhibitor组相比,tRF-Pro-CGG inhibitor组坏死组织明显减少,坏死周围可见凋亡细胞及坏死细胞(图6)。

图6 过表达及敲低tRF-Pro-CGG对裸鼠胰腺癌移植瘤组织形态结构的影响
Fig. 6 Effects of overexpression and knockdown of tRF-Pro-CGG on the morphological structure of transplanted tumor tissues in nude mice with pancreatic cancer
A, B: H-E staining was used to detect changes of histomorphological structure of pancreatic cancer transplantation tumor in nude mice in each group.
2.7 胰腺癌移植瘤组织中增殖、侵袭转移相关蛋白的表达情况
Western blot结果显示,与NC mimics组相比,tRF-Pro-CGG mimics组的移植瘤组织中Ki-67、vimentin的表达明显降低,而E-cadherin的表达明显升高(P<0.001);与NC inhibitor组相比,tRF-Pro-CGG inhibitor组的移植瘤组织中Ki-67增殖指数、vimentin的表达明显升高,而E-cadherin的表达明显降低(P<0.001,图7)。
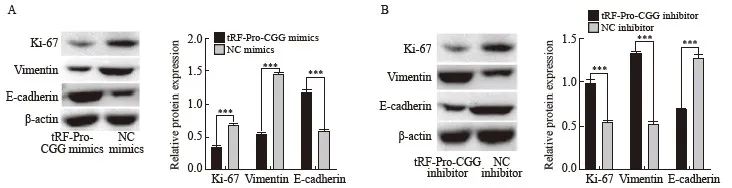
图7 过表达及敲低tRF-Pro-CGG对Ki-67增殖指数、vimentin和E-cadherin表达的影响
Fig. 7 Effects of overexpression and knockdown of tRF-Pro-CGG on Ki-67, vimentin and E-cadherin expression
A, B: Western blot was used to detect Ki-67 proliferation index, expression of vimentin and E-cadherin in each group. ***:P<0.001, compared with NC mimics or NC inhibitor.
2.8 胰腺癌移植瘤组织中PI3K/AKT通路蛋白的相对表达量
PI3K/AKT信号通路是调节肿瘤发生、发展的重要途径之一。Western blot分析移植瘤组织中P-PI3K/AKT的表达情况显示,与NC mimics组相比,tRF-Pro-CGG mimics组的PI3K、P-PI3K、AKT和P-AKT的表达明显被抑制(P<0.001);而与NC inhibitor组相比,tRF-Pro-CGG inhibitor组的PI3K、P-PI3K、AKT和P-AKT的表达明显升高(P<0.001,图8)。
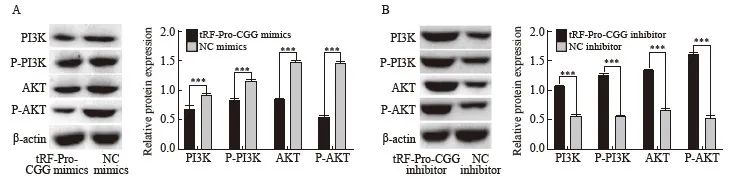
图8 过表达及敲低tRF-Pro-CGG对PI3K、P-PI3K、AKT和P-AKT表达的影响
Fig. 8 Effects of overexpression and knockdown of tRF-Pro-CGG on the expression of PI3K, P-PI3K, AKT and P-AKT
A, B: Western blot was used to detect protein expression of PI3K, P-PI3K, AKT and P-AKT in each group. ***: P<0.01, compared with NC mimics or NC inhibitor.
2.9 tRF-Pro-CGG影响裸鼠胰腺癌肝转移情况
tRF-Pro-CGG mimics组4只裸鼠发生胰腺癌肝转移,1只裸鼠在4周时死亡,而NC mimics组5只裸鼠都发生胰腺癌肝转移,两组相比差异无统计学意义(P>0.05);tRF-Pro-CGG inhibitor组3只发生胰腺癌肝转移,NC mimics组3只发生胰腺癌肝转移,期间1只裸鼠在3周时死亡,两组相比差异无统计学意义(P>0.05, 图9)。

图9 过表达及敲低tRF-Pro-CGG对裸鼠胰腺癌肝转移的影响
Fig. 9 Effects of overexpression and knockdown of tRF-Pro-CGG on liver metastasis of pancreatic cancer in nude mice
3. 讨 论
随着高通量二代测序技术的快速发展,大量的sncRNA尤其tRF分子被发现广泛存在于人类疾病中,如癌症、遗传性代谢疾病、神经退行性疾病及病毒感染等。tRF在不同疾病中发挥着不同的生物学功能,特别在各类肿瘤中的表达及生物发生机制也略有差异,且对于肿瘤发生、发展的探索仍停留在初步阶段。随着人们生活方式的改变及工作强度的增加,患消化道肿瘤的概率也显著提高。胰腺癌是恶性程度高、预后差的消化系统恶性肿瘤之一,其患病率和死亡率均较高,手术是治愈胰腺癌的唯一希望,但超过80%的胰腺癌患者就诊时已丧失了手术治疗的机会[6-7]。胰腺癌转移早、进展快、局部浸润等特点使其治疗效果并不显著,因此寻找新的肿瘤标志物和有效的治疗靶点非常必要。
近年来tRNA中衍生出一类独特的sncRNA,其被分为tiRNA和tRF两大类,在人体内有着重要的生物发生和肿瘤特性[8]。根据匹配的区域和长度大小,其tRF可分为tRF-1、tRF-2、tRF-3、tRF-5和i-tRF亚型[9]。tRF在许多癌症中发挥重要功能。在乳腺癌中,2-tRF可以与YBX-1相互作用,对乳腺癌细胞增殖产生抑制作用[10]。在前列腺癌中,Zeng等[11]研究发现,tRF-1001表达水平升高,促进癌细胞从G2期到M期,提高癌细胞的增殖速度。在结直肠癌中,tRF/miR-1280可以阻止结直肠癌细胞增殖、侵袭和转移[12]。在胃癌中,tRF-38和tRF-18则充当促癌基因的角色[13]。此外,tRF-03357可明显促进卵巢癌的进程[14]。大多数tRF在缺氧环境中产生致癌应激反应,这与胰腺癌的缺氧微环境相匹配[3],说明tRF的形成条件与胰腺癌密切相连。然而,tRF在胰腺癌中的相关机制研究报道较少。
本课题组前期研究[4]发现,tRF-Pro-CGG在人胰腺癌组织与癌旁组织中差异表达最明显,京都基因和基因组百科全书数据库(Kyoto Encyclopedia of Genes and Genomes,KEGG)功能富集分析显示,tRF-Pro-CGG下游的PI3K/AKT通路的富集密度最高,相关性最大。此外,tRF-Pro-CGG的低表达与胰腺癌患者的不良临床结局密切相关,也预示着tRF-Pro-CGG作为抑癌基因影响胰腺癌的发生、发展[5]。本研究采用tRF-Pro-CGG转染tRF-Pro-CGG mimics或tRF-Pro-CGG inhibitor,采用RTFQ-PCR和Western blot实验检测了tRF-Pro-CGG在pan02及LTPA细胞中的表达量,CCK-8和transwell实验表明,过表达tRF-Pro-CGG可以抑制小鼠胰腺癌细胞增殖、迁移和侵袭能力。体内裸鼠移植瘤实验结果显示,过表达tRF-Pro-CGG能显著抑制瘤体重量和体积。Ki-67增殖指数可反映肿瘤细胞的增殖水平,其与癌症分期密切相关,癌症的侵袭和转移常伴随着vimentin的增加和E-cadherin的减少[15]。本研究表明,过表达tRF-Pro-CGG可有效抑制移植瘤组织中Ki-67增殖指数和vimentin的表达,而促进E-cadherin的表达。PI3K/AKT信号通路是调控肿瘤增殖和凋亡的重要通路之一,参与人类许多肿瘤的发生、发展[16]。Ebrahimi等[17]指出, PI3K/AKT信号通路在胰腺癌的发生、进展和转移中发挥着关键作用。本研究的Western blot实验证明,过表达tRF-Pro-CGG明显抑制PI3K、AKT的磷酸化水平,抑制PI3K/AKT信号通路的激活,抑制小鼠胰腺癌移植瘤的生长。
综上,过表达tRF-Pro-CGG能抑制小鼠胰腺癌细胞增殖、迁移和侵袭。过表达tRF-Pro-CGG可能通过抑制PI3K/AKT信号转导通路,从而抑制胰腺癌裸鼠移植瘤的生长。过表达tRF-Pro-CGG抑制胰腺癌移植瘤中增殖、侵袭转移蛋白的表达。本研究表明,tRF-Pro-CGG在裸鼠胰腺癌的发生、发展中发挥重要作用,有望为胰腺癌早期诊断和治疗提供新的线索。
[参考文献]
[1] 朱鑫哲, 李 浩, 徐华祥, 等. 2021年胰腺癌研究及诊疗新进展[J]. 中国癌症杂志, 2022, 32(1): 1-12.
ZHU X Z, LI H, XU H X, et al. Advances in basic research, clinical diagnosis and treatment of pancreatic cancer in 2021[J]. China Oncol, 2022, 32(1): 1-12.
[2] MIZRAHI J D, SURANA R, VALLE J W, et al. Pancreatic cancer[J]. Lancet, 2020, 395(10242): 2008-2020.
[3] SHEN Y J, YU X C, ZHU L W, et al. Transfer RNA-derived fragments and tRNA halves: biogenesis, biological functions and their roles in diseases[J]. J Mol Med, 2018, 96(11): 1167-1176.
[4] JIN L, ZHU C F, QIN X H. Expression profile of tRNA-derived fragments in pancreatic cancer[J]. Oncol Lett, 2019, 18(3): 3104-3114.
[5] LI J, JIN L, GAO Y, et al. Low expression of tRF-Pro-CGG predicts poor prognosis in pancreatic ductal adenocarcinoma[J]. J Clin Lab Anal, 2021, 35(5): e23742.
[6] DROUILLARD A, MANFREDI S, LEPAGE C, et al. Epidemiology of pancreatic cancer[J]. Bull Cancer, 2018,105(1): 63-69.
[7] CABASAG C J, FERLAY J, LAVERSANNE M, et al. Pancreatic cancer: an increasing global public health concern[J]. Gut, 2022, 71(8): 1686-1687.
[8] YU M Q, LU B J, ZHANG J S, et al. tRNA-derived RNA fragments in cancer: current status and future perspectives[J]. J Hematol Oncol, 2020, 13(1): 121.
[9] XIE Y Y, YAO L P, YU X C, et al. Action mechanisms and research methods of tRNA-derived small RNAs[J]. Signal Transduct Target Ther, 2020, 5(1): 109.
[10] CUI Y Y, HUANG Y, WU X W, et al. Hypoxia-induced tRNAderived fragments, novel regulatory factor for doxorubicin resistance in triple-negative breast cancer[J]. J Cell Physiol, 2019, 234(6): 8740-8751.
[11] ZENG T Y, HUA Y J, SUN C X, et al. Relationship between tRNA-derived fragments and human cancers[J]. Int J Cancer, 2020, 147(11): 3007-3018.
[12] HUANG B Q, YANG H P, CHENG X X, et al. tRF/miR-1280 suppresses stem cell-like cells and metastasis in colorectal cancer[J]. Cancer Res, 2017, 77(12): 3194-3206.
[13] LIN C F, ZHENG L W, HUANG R L, et al. tRFs as potential exosome tRNA-derived fragment biomarkers for gastric carcinoma[J]. Clin Lab, 2020, 66(6).
[14] ZHANG M M, LI F F, WANG J, et al. tRNA-derived fragment tRF-03357 promotes cell proliferation, migration and invasion in high-grade serous ovarian cancer[J]. Onco Targets Ther, 2019, 12: 6371-6383.
[15] 董 磊, 张仲妍. 靶向IRF2的miR-1290对非小细胞肺癌细胞增殖、侵袭的调控作用及其机制研究[J]. 中国癌症杂志, 2020, 30(1): 32-40.
DONG L, ZHANG Z Y. Regulatory effect of miR-1290 targeting IRF2 on proliferation and invasion of non-small cell lung cancer cells and its related mechanism[J]. China Oncol, 2020, 30(1): 32-40.
[16] 朱海鹏, 胡 军, 姜 敏, 等. GOLM1调控PI3K/AKT/mTOR 信号转导通路促进肺腺癌细胞增殖、侵袭和迁移的机制研究[J]. 中国癌症杂志, 2022, 32(3): 207-217.
ZHU H P, HU J, JIANG M, et al. A study on mechanism of GOLM1 regulating PI3K/AKT/mTOR signaling pathway to promote proliferation, invasion and migration of lung adenocarcinoma cells[J]. China Oncol, 2022, 32(3): 207-217.
[17] EBRAHIMI S, HOSSEINI M, SHAHIDSALES S, et al. Targeting the Akt/PI3K signaling pathway as a potential therapeutic strategy for the treatment of pancreatic cancer[J]. Curr Med Chem, 2017, 24(13): 1321-1331.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言