PNAS:重庆医科大学刘俊彦团队发现高蔗糖饮食致肠损伤的有效治疗靶标—可溶性环氧化物水解酶
2024-11-25 iNature iNature 发表于陕西省
,该团队揭示可溶性环氧化物水解酶(sEH)是高蔗糖饮食致肠屏道损伤的有效治疗靶标。具体地,16周高蔗糖饮食导致小鼠结直肠炎症和紧密连接蛋白受损。
蔗糖是人类日常饮食中最普遍的成分之一,高蔗糖摄入在世界范围内日益普遍。高蔗糖摄入与多种组织和器官功能障碍相关。然而,高蔗糖饮食导致器官损伤的具体分子机制及有效治疗靶标尚待研究。
2024年11月18日,重庆医科大学刘俊彦团队联合加州戴维斯大学Bruce D. Hammock团队在PNAS在线发表题为“Metabolomics reveals soluble epoxide hydrolase as a therapeutic target for high-sucrose diet-mediated gut barrier dysfunction”的研究论文,该团队揭示可溶性环氧化物水解酶(sEH)是高蔗糖饮食致肠屏道损伤的有效治疗靶标。具体地,16周高蔗糖饮食导致小鼠结直肠炎症和紧密连接蛋白受损。代谢组学揭示小鼠结直肠中sEH催化底物5(6)-EET显著下调,而产物5,6-DHET显著上调,提示sEH在高蔗糖致肠屏道损伤的小鼠模型中上调。qPCR和WB实验进一步验证sEH在该小鼠模型中显著上调。sEH抑制剂或肠特异性敲除sEH有效缓解高蔗糖饮食诱导的小鼠结直肠炎症及肠上皮屏障损伤。体外研究显示,高蔗糖导致肠上皮细胞炎症和紧密连接受损,而sEH催化底物5(6)-EET具有抗炎作用,能显著减轻高蔗糖所致肠损伤。
过去四十年,随着经济的发展和加工食品行业的兴起,全球范围内的糖摄入量显著增加。蔗糖是食品中最主要的糖类之一。富含高蔗糖的食品和饮料等被发现是肥胖、胰岛素抵抗、脂肪肝等多种疾病的致病因素,并且与多器官损伤相关。然而,高蔗糖饮食引起器官损伤的分子机制仍然未被揭示。因此,迫切需要探究高蔗糖饮食引起的多器官损伤的机制以及潜在的干预靶点。
刘俊彦团队长期从事代谢组学研究,前期利用代谢组学技术,包括非靶向代谢组学和靶向代谢组学,揭示了急性肾脏病、肥胖相关肾损伤、慢性肾病、痛风性关节炎和结肠癌等疾病的潜在干预靶点或生物标志物。多不饱和脂肪酸(PUFAs),包括亚油酸、α-亚麻酸、花生四烯酸、二十碳五烯酸和二十二碳六烯酸,其代谢过程与多种疾病的病理过程密切相关。由于大多数器官和组织损伤与炎症密切相关,而炎症与PUFAs代谢,尤其是花生四烯酸的代谢有密切关系。因此,作者利用建立的PUFAs靶向代谢组学方法,研究PUFAs代谢在高蔗糖饮食致肠损伤中的作用。
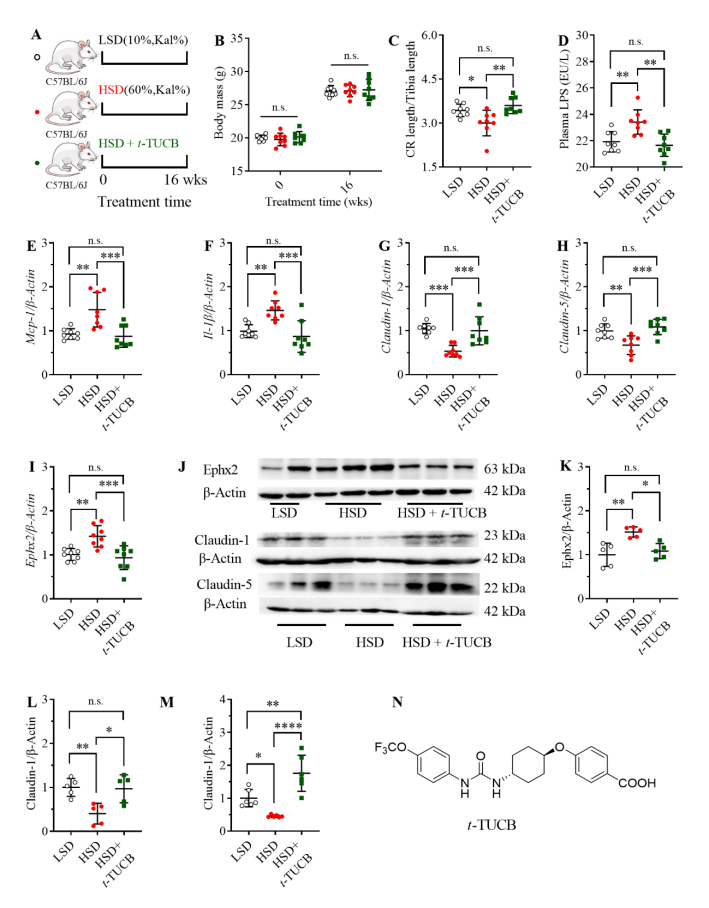
sEH抑制剂t-TUCB有效改善高蔗糖所致肠损伤(图源自PNAS )
研究表明,16周高蔗糖饮食导致小鼠的结直肠长度较对照组显著缩短,炎症因子Mcp-1和Il-1β的mRNA和蛋白水平均显著上调,而肠功能蛋白claudin 1/5显著下调。PUFAs靶向代谢组学表明,相比于对照组,5(6)-EET显著下调,5,6-DHET显著上调,而前者是sEH催化底物,后者是对应的催化产物,揭示sEH在高蔗糖致肠屏道损伤的小鼠模型中显著上调。此外,Ephx2基因(sEH的编码基因)的mRNA表达水平在该模型中显著上调,且WB实验也揭示高蔗糖饲喂小鼠结直肠中sEH蛋白表达显著上调。
为进一步揭示高蔗糖饮食诱导的肠损伤与sEH的关联性,作者对高蔗糖饲喂小鼠同时饮水服用sEH抑制剂t-TUCB,发现其有效缓解高蔗糖诱导的结直肠炎症及肠上皮屏障损伤,这表明sEH在高蔗糖饮食诱导的结直肠炎症中起着重要作用。此外,肠上皮条件性sEH敲除也可有效减轻高蔗糖饮食导致的结直肠炎症及肠道上皮屏障损伤。揭示sEH是治疗高蔗糖引起的结直肠炎症的关键靶点之一。体外细胞实验表明,sEH的催化底物5(6)-EET,而非催化产物5,6-DHET, 具有抗炎作用,能显著减轻高蔗糖介导的肠上皮炎症和紧密连接受损。相关研究结果对蔗糖饮食的摄入具有指导意义,也为高蔗糖饮食所致肠损伤的靶向治疗提供新策略。
原文链接:
https://doi.org/10.1073/pnas.2409841121
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#蔗糖# #肠损伤#
14