SPECT/CT定位诊断皮肤肿瘤前哨淋巴结的应用体会
2023-09-26 协和医学杂志 协和医学杂志 发表于加利福尼亚
本文总结我院自开展该项技术以来的应用体会,以期为临床提供参考和借鉴。
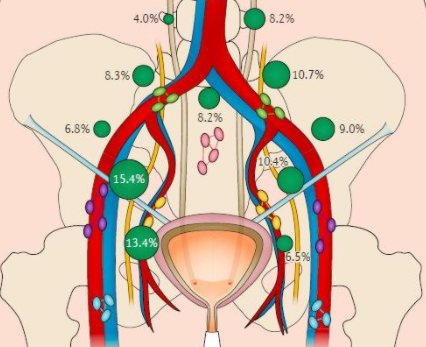
前哨淋巴结是指肿瘤细胞经淋巴管最先到达的淋巴结,即该肿瘤淋巴引流区域内最容易被肿瘤侵犯的淋巴结。通过前哨淋巴结活检可准确评估淋巴引流区域是否受到肿瘤侵犯,对皮肤肿瘤的临床分期、手术方案制定及患者预后具有重要意义。
用于检测前哨淋巴结的方法通常包括活性蓝色染料法和放射性药物淋巴结显像法。前者操作简单,无需特殊设备和条件,但因其在术前无法准确定位深部前哨淋巴结的位置,且蓝色染料在前哨淋巴结停留时间较短,很快出现次级淋巴结显像,因此存在一定的失败率和假阴性率。
放射性药物淋巴结显像法采用放射性核素标记的胶体显像剂,可被淋巴管快速吸收,且可在前哨淋巴结内停留较长时间,术前即可通过单光子发射计算机断层显像(SPECT)进行前哨淋巴结定位,术中易被γ探测仪检测到,可较好地进行术中导航,协助医生准确完成前哨淋巴结活检。
放射性药物前哨淋巴结显像和活检均是经典技术,但既往由于多学科协作不够深入、术中缺少用于导航的γ探测仪设备等原因,该技术在国内开展不多。北京协和医院近年来建立了多学科协作团队并在辅助设备的支持下,规范开展了放射性药物前哨淋巴结显像和活检技术,旨在传统显像技术的基础上,将SPECT/CT用于前哨淋巴结显像中,探索SPECT/CT是否有助于提高皮肤肿瘤前哨淋巴结显像定位诊断的准确性。本文总结我院自开展该项技术以来的应用体会,以期为临床提供参考和借鉴。
1 材料与方法
1.1 研究对象
本研究为回顾性总结。研究对象为2019年4月—2023年2月于北京协和医院皮肤科就诊的皮肤恶性肿瘤患者。
纳入标准:(1)病理活检明确诊断为皮肤恶性肿瘤;(2)治疗前于本院核医学科行前哨淋巴结显像;(3)手术及随访资料齐全。排除标准:同时合并其他恶性肿瘤者。
收集患者一般资料、前哨淋巴结显像及18F-FDG PET/CT等影像学检查结果、前哨淋巴结活检和手术记录、术后病理资料、其他治疗情况、随访资料等。
本研究已通过北京协和医院伦理审查委员会审批(审批号:K23C2098),并豁免患者知情同意。
1.2 前哨淋巴结显像
1.2.1 药物制备与质控
使用99m锝-硫化锑(99mTC-ASC)作为前哨淋巴结显像药物。取1 mL 99TC-ASC溶液加入10 mL 真空瓶中,加入1 N HCl 0.3 mL,调节pH至1.5;将真空瓶放入铅罐中,然后加入2 mL 99mTcO4-,活度0.74~1.11 GBq (20~30 mCi)。将铅罐放入高压锅内加热,待蒸汽将高压锅阀顶起后再高压加热15 min,冷却至室温后取出;加入0.8 M磷酸缓冲PBS(pH=7.4)1 mL。
药物制备完毕后使用0.22 μm滤膜对制备药物进行过滤。产品应为橙黄色透明液体,放化纯度>95%。质控方法为纸层析法,用90%丙酮展开(Na99mTcO4 Rf=1.0,标记物Rf=0)。
1.2.2 示踪剂注射
注射采用瘤周注射方式,在皮肤肿瘤病变周围选取6个注射点,注射点对称分布,距离肿瘤边缘1 cm。采用皮下注射方式,抽回血确认无回血后再推注示踪剂[3.7~7.4 MBq(0.1~0.2 mCi)/支,体积0.05~0.1 mL]。注射前后安抚患者使其配合,注射后用棉球按压注射部位减少周围污染,并稍作按摩注射点使示踪剂快速吸收。
1.2.3 图像采集
注射示踪剂后即刻进行平面连续动态显像,扫描野包含注射部位和引流淋巴结区域,观察到淋巴引流区出现点状浓聚灶即停止平面显像采集。之后立即进行浓聚灶及淋巴引流区的SPECT/CT扫描(Philips Presedece 16),扫描野尽量包含更多的淋巴结引流区,无需涵盖肿瘤注射部位。
若为足部皮肤肿瘤,扫描野则应覆盖腘窝及腹股沟区;若为手部皮肤肿瘤,扫描野应覆盖肘部和腋窝;若为躯干部皮肤肿瘤,扫描野应覆盖双侧淋巴结引流区。
CT扫描参数为管电压120 kV,管电流50 mAs,FOV 350 mm,SPECT扫描参数矩阵为128×128,zoom 1.0,双探头采集共32帧,6度/帧,每帧采集40 s,共采集640 s。采集后在后处理工作站常规重建和融合。
1.2.4 前哨淋巴结显像阅片
由1名阅片经验>10年的核医学科医生独立阅片,记录前哨淋巴结显像浓聚灶部位,并结合SPECT/CT定位前哨淋巴结部位,检查和阅片完成后即刻报告临床医生。
1.3 前哨淋巴结活检
在SPECT/CT显像结束后约1~4 h根据显像定位结果行前哨淋巴结活检术。术前由γ探测仪再次确认显像定位的前哨淋巴结区有过量的γ计数,术中由γ探测仪引导切除有高γ计数的淋巴结,切除后分别探测切除的淋巴结标本和术区γ计数,保证切除的淋巴结为有高γ计数的前哨淋巴结,且完整切净。切除标本常规送病理检测。
1.4 随访
患者均于皮肤科门诊规律随访并记录病理结果、辅助治疗、肿瘤进展、生存情况等。
1.5 统计学处理
采用Excel软件录入患者信息,并对临床资料进行描述性统计分析。符合正态分布的计量资料采用均数±标准差表示,符合偏态分布的计量资料采用中位数(四分位数)表示;计数资料采用频数(百分数)表示。对照活检病理结果分析SPECT/CT定位诊断皮肤肿瘤前哨淋巴结的作用。
2 结果
2.1 一般临床资料
本研究共入组符合纳入与排除标准的皮肤恶性肿瘤患者37例,男女比例为1.2:1,平均年龄(58.7±14.2)岁(范围:30~83岁),中位病程48(12,120)个月(范围:1个月~58年),部位分布、病理类型/分期等信息见表1。
表1 37例皮肤肿瘤患者一般临床资料

其中31例患者在术前行18F-FDG PET/CT肿瘤评估与分期,均未发现明确的淋巴结转移或远处转移,皮肤原发灶中位最大标准摄取值(SUVmax)为5.2(1.2,4.4)(范围:0.4~10.3);其余患者行超声、CT检查亦未见明确转移灶。
2.2 前哨淋巴结显像及活检结果
37例患者均行前哨淋巴结显像,具体结果见表2。
表2 37例皮肤肿瘤患者前哨淋巴结显像结果
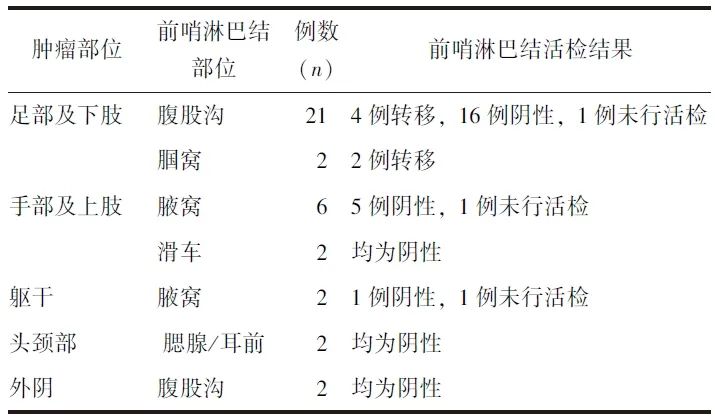
23例皮肤肿瘤位于足部及下肢的患者中,21例(91.3%,21/23)前哨淋巴结定位于同侧腹股沟区,2例(8.7%,2/23)定位于同侧腘窝,皮肤肿瘤类型均为恶性黑色素瘤。经同步γ探测仪引导行前哨淋巴结活检术,发现6例患者前哨淋巴结有转移,16例前哨淋巴结活检病理为阴性,1例未行前哨淋巴结活检。
8例皮肤肿瘤位于手部及上肢的患者中,6例(75.0%,6/8)前哨淋巴结定位于同侧腋窝,2例(25.0%,2/8)定位于同侧滑车。其中5例患者为恶性黑色素瘤,3例为皮肤鳞状细胞癌。7例患者行同步γ探测仪引导下前哨淋巴结活检术,前哨淋巴结均未见转移,1例未行前哨淋巴结活检。
2例皮肤肿瘤位于躯干部的患者中,1例左后背恶性黑色素瘤患者前哨淋巴结定位于左腋窝,经同步γ探测仪引导下行前哨淋巴结活检术,前哨淋巴结未见转移;另1例基底细胞癌患者皮肤肿瘤位于前胸壁,前哨淋巴结定位于双侧腋窝,患者未再行前哨淋巴结活检术。
2例皮肤肿瘤位于头颈部的患者中,1例右耳廓恶性黑色素瘤患者前哨淋巴结定位于右侧腮腺,患者直接行肿瘤及部分右耳廓切除、右腮腺浅叶切除、右颈淋巴结清扫术,淋巴结未见转移;另1例额顶部头皮基底细胞癌患者前哨淋巴结位于双侧耳前区,经同步γ探测仪引导下切除双侧耳前前哨淋巴结,活检病理未见转移。
2例小阴唇恶性黑色素瘤患者的前哨淋巴结均定位于腹股沟,经同步γ探测仪引导下前哨淋巴结活检术,前哨淋巴结均未见转移。
37例患者中,共34例在前哨淋巴结显像后即行γ探测仪引导下前哨淋巴结活检,术中γ探测仪引导下定位的前哨淋巴结部位与前哨淋巴结显像结果均一致,平均前哨淋巴结直径(14.5±4.0)mm,6例患者前哨淋巴结出现转移,且均为足部及下肢的恶性黑色素瘤。
2.3 前哨淋巴结显像中SPECT/CT的作用
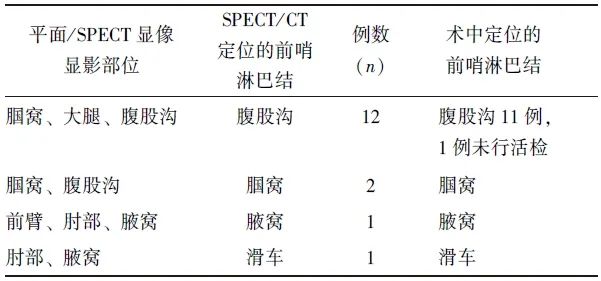
37例患者中,共36例行SPECT/CT显像(1例患者仅行平面动态显像)。其中,16例(44.4%,16/36)患者于同侧淋巴引流途径见多处局灶性浓聚灶(14例为足部及下肢皮肤肿瘤,2例为手部皮肤肿瘤),位于腘窝、大腿、腹股沟、前臂、滑车、腋窝等部位,平面动态显像或SPECT显像难以明确何处为前哨淋巴结显影;经SPECT/CT辅助定位后,16例患者均明确定位了浓聚灶位于淋巴管(13例,为淋巴管内示踪剂一过性滞留)或淋巴结(3例,为前哨淋巴结)(图1、2),从而明确定位了前哨淋巴结部位,具体情况见表3。
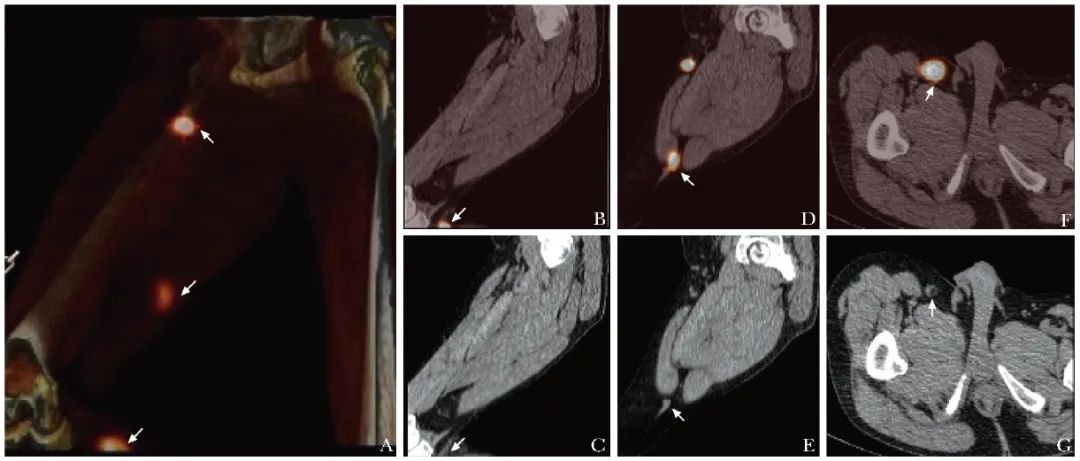
图1 1例右足底恶性黑色素瘤患者(男性,55岁,T1N0M0)前哨淋巴结SPECT/CT显像图(箭头)
A.SPECT/CT融合投影图可见右侧腘窝、大腿及腹股沟区多处局灶性浓聚灶;B~E.SPECT/CT矢状面断层图像见右侧腘窝及大腿处浓聚灶定位于淋巴管,考虑为示踪剂在淋巴管内一过性滞留所致;F~G.SPECT/CT横断层图像见右侧腹股沟区浓聚灶定位于腹股沟一枚淋巴结,考虑为前哨淋巴结,后术中γ探测仪证实右侧腹股沟淋巴结为前哨淋巴结,淋巴结活检病理未见转移
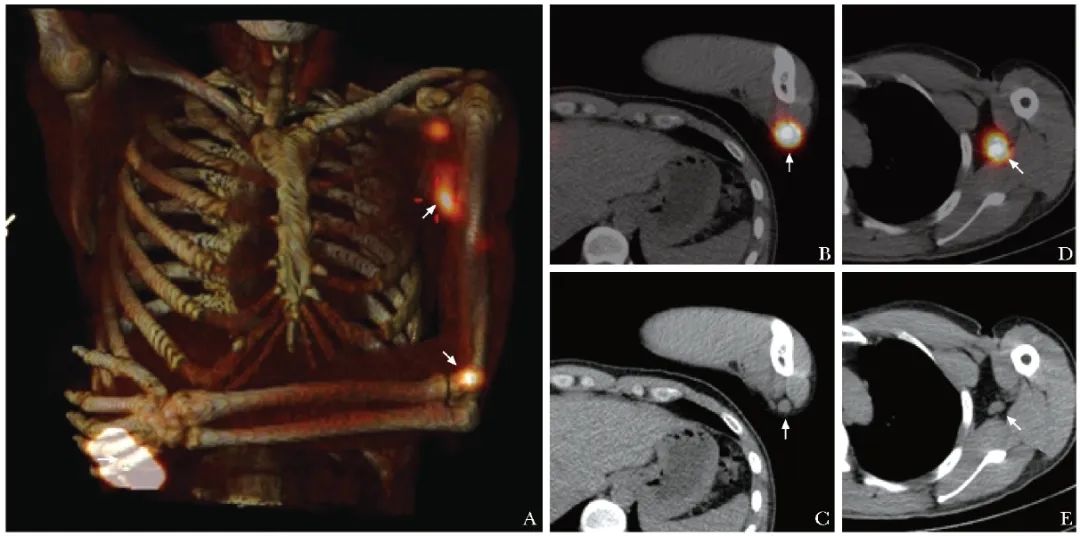
图2 1例左手背高分化鳞状细胞癌患者(男性,37岁)前哨淋巴结SPECT/CT显像图(箭头)
A.SPECT/CT融合投影图可见左手背瘤周注射点,左侧滑车、腋窝多处局灶性浓聚灶;B~C.SPECT/CT横断层图像见左侧滑车浓聚灶;D~E.SPECT/CT横断层图像见左侧腋窝浓聚灶均定位于淋巴结,因此考虑左侧滑车淋巴结为前哨淋巴结,左侧腋窝淋巴结为次级淋巴结,后术中γ探测仪引导下行左侧滑车前哨淋巴结活检,病理未见转移
表3 16例经SPECT/CT明确定位的前哨淋巴结分布情况
哨淋巴结有转移的6例患者中,术后均辅助程序性死亡受体1(PD-1)治疗,3例患者接受了二次手术进行淋巴结清扫,1例患者接受了淋巴结区域放疗;2例患者分别在术后6.4个月和9.4个月后出现肿瘤进展,其余4例患者暂未发现复发或转移(随访期限5.2~24.5个月)。
在31例前哨淋巴结未见转移的患者中,3例患者接受原瘤区辅助放疗, 1例患者接受干扰素治疗;2例患者分别在术后9.5个月和18.8个月后出现肿瘤进展,其余29例患者暂未发现复发或转移(随访期限0.5~42.5个月)。
3 讨论
常见的皮肤原发恶性肿瘤包括恶性黑色素瘤、鳞状细胞癌、基底细胞癌等。对于皮肤黑色素瘤而言,手术切除通常能够控制原发病灶,但肿瘤常通过淋巴管转移至区域淋巴结;大多数皮肤鳞状细胞癌或基底细胞癌局限于皮肤,通过切除、原发灶放疗等局部治疗方式可成功治愈,但约3%~7%的皮肤鳞状细胞癌和极少数的基底细胞癌患者会发生局部区域或远处转移,导致死亡风险上升[1-3]。
淋巴结是皮肤恶性肿瘤最常见的转移部位,对于确诊浸润性皮肤恶性肿瘤的患者,应常规评估区域淋巴结的情况。区域淋巴结的体格检查通常不准确,约20%的临床淋巴结阴性患者存在转移性病变,而20%存在区域淋巴结肿大的患者其病理检查结果却为阴性[4-5],故临床应通过前哨淋巴结活检等方法获得准确的区域淋巴结分期信息,以指导后续治疗。
前哨淋巴结活检最经典的方法是放射性核素前哨淋巴结显像+术中γ探测仪引导前哨淋巴结活检。该技术在欧美国家已非常成熟,并常规开展多年,但国内开展较少。此项技术涉及的放射性药物、显像方法在核医学领域是常规技术,但若单纯进行前哨淋巴结显像而无术中辅助导航技术,则很难准确将显像的前哨淋巴结切除,从而使显像技术失去了意义。因此开展此项技术的关键是需要核医学科、皮肤科、外科等多学科紧密协作[6],另外还需要γ探测仪进行术中导航,引导手术医生成功取得前哨淋巴结活检。
此外,选择合适的患者行前哨淋巴结显像及活检非常重要,检查指征通常由临床医生把握。若临床或影像学检查已发现非常明确的淋巴结转移,则无需进行前哨淋巴结活检,应直接行淋巴结清扫或辅助其他治疗。
对于临床未发现淋巴结转移的情况,应行前哨淋巴结活检予以明确,以免漏诊而影响治疗效果,亦可避免过度行淋巴结清扫而带来手术相关副反应[7]。本研究37例患者术前检查均未发现转移征象(其中31例行18F-FDG PET/CT),6例患者在前哨淋巴结活检后发现前哨淋巴结转移,占所有患者的16.2%,且肿瘤均为足部及下肢恶性黑色素瘤。
前哨淋巴结显像所采用的示踪剂是放射性核素标记的胶体显像剂,胶体颗粒大小需在一定范围内(15~800 nm[7]),以保证示踪剂经皮下注射后进入毛细淋巴管。胶体颗粒若过大,则示踪剂引流缓慢,可能延长显像及手术时间;若颗粒过小,则容易进入血液循环,影响检查结果。
注射示踪剂时,应在瘤周注射4~8针,距离肿瘤边缘1 cm,注射点应覆盖病灶所有引流方向,以真实反映肿瘤的淋巴引流方位。若肿瘤已行切除活检,则应沿切除活检边缘注射,并适当延迟显像及手术时间,因切除术后可能会导致局部淋巴回流受阻。
经典的前哨淋巴结显像是用平面显像的方法进行连续动态采集,这种方法只能大致定位前哨淋巴结位于哪一淋巴结区域,而具体定位则依靠术中γ探测仪引导。通常在前哨淋巴结平面显像中,首先出现的、距离原发灶最近的局灶性浓聚灶被认为是前哨淋巴结[8]。
本研究采用了SPECT/CT进行前哨淋巴结显像,此种方法的优点是可借助同机CT使定位更准确,但不能进行连续动态采集。在本研究中,16例患者在淋巴引流途径上出现多处局灶性浓聚灶,并有13例患者的局灶性浓聚灶定位于淋巴管,提示为示踪剂在淋巴管内的一过性滞留,而非前哨淋巴结显影。
若不辅助SPECT/CT进行精确定位,则可能错误判读此类患者的前哨淋巴结显像结果,这一比例达到了35.1%(13/37):12例足部及下肢肿瘤的前哨淋巴结定位于腹股沟,可能将腘窝淋巴管内浓聚灶错误判读为前哨淋巴结;1例手部皮肤肿瘤的前哨淋巴结定位于腋窝,可能将肘部淋巴管内浓聚灶错误判读为前哨淋巴结。本研究中所有经SPECT/CT显像定位的前哨淋巴结均与术中γ探测仪的定位一致。因此SPECT/CT有助于避免错误判读前哨淋巴结部位,使术前定位准确性提高[9]。
此外,SPECT/CT还可显示前哨淋巴结的具体部位,手术医生可根据淋巴结的表浅程度选择合适的麻醉方式和手术间进行操作,有助于更方便地进行前哨淋巴结活检手术[8-12]。
前哨淋巴结显像和活检是皮肤恶性肿瘤诊治中重要的一环,该技术的成功开展依赖于成熟的、高度配合的多学科协作团队。核医学科作为该技术团队的核心,SPECT/CT技术的进步有助于进一步提高前哨淋巴结显像定位准确性,优化该检查技术。
参考文献
[1]Khan K, Mykula R, Kerstein R, et al. A 5-year follow-up study of 633 cutaneous SCC excisions: Rates of local recurrence and lymph node metastasis[J]. J Plast Reconstr Aesthet Surg,2018, 71:1153-1158.
[2]Genders RE, Osinga JAJ, Tromp EE, et al. Metastasis Risk of Cutaneous Squamous Cell Carcinoma in Organ Transplant Recipients and Immunocompetent Patients[J]. Acta Derm Venereol,2018, 98:551-555.
[3]Karia PS, Han J, Schmults CD. Cutaneous squamous cell carcinoma: estimated incidence of disease, nodal metastasis, and deaths from disease in the United States, 2012[J]. J Am Acad Dermatol,2013, 68:957-966.
[4]Rodrigues LK, Leong SP, Ljung BM, et al. Fine needle aspiration in the diagnosis of metastatic melanoma[J]. J Am Acad Dermatol, 2000, 42:735-740.
[5]Voit CA, van Akkooi AC, Schäfer-Hesterberg G, et al. Rotterdam Criteria for sentinel node (SN) tumor burden and the accuracy of ultrasound (US)-guided fine-needle aspiration cytology (FNAC): can US-guided FNAC replace SN staging in patients with melanoma?[J].J Clin Oncol, 2009, 27:4994-5000.
[6]Zaknun JJ, Giammarile F, Olmos RA, et al. Changing paradigms in radioguided surgery and intraoperative imaging: the GOSTT concept[J]. Eur J Nucl Med Mol Imaging, 2012, 39:1-3.
[7]Alazraki N, Glass EC, Castronovo F, et al. Procedure guideline for lymphoscintigraphy and the use of intraoperative gamma probe for sentinel lymph node localization in melanoma of intermediate thickness 1.0[J]. J Nucl Med, 2002, 43:1414-1418.
[8]Benke M, Wocial K, Lewandowska W, et al. Value of planar lymphoscintigraphy (PL) versus SPECT/CT in evaluation of sentinel lymph node in trunk melanoma - one center, large series retrospective study[J]. Nucl Med Rev Cent East Eur, 2018, 21:79-84.
[9]Zhang S, Zhu S, Hua S, et al. The importance of SPECT/CT in preoperative localization of sentinel lymph nodes in 2 patients with acral melanoma in the foot[J]. Clin Nucl Med, 2022,47:e32-e33.
[10]McGregor A, Kim S, Norwich-Cavanaugh A, et al. Clinical Value of Single-photon Emission Computed Tomography Combined With Computed Tomography for Sentinel Lymph Node Identification in Melanoma[J]. Ann Plast Surg, 2019, 82:192-194.
[11]Quartuccio N, Garau LM, Arnone A, et al. Comparison of (99m)Tc-Labeled Colloid SPECT/CT and Planar Lymphoscintigraphy in Sentinel Lymph Node Detection in Patients with Melanoma: A Meta-Analysis[J]. J Clin Med, 2020,9: 1680.
[12]Valdés Olmos RA, Rietbergen DDD, Rubello D, et al. Sentinel Node Imaging and Radioguided Surgery in the Era of SPECT/CT and PET/CT: Toward New Interventional Nuclear Medicine Strategies[J]. Clin Nucl Med, 2020, 45:771-777.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









感谢分享
76